Introduction
전 세계적으로 화석연료를 대체할 바이오연료(Biofuel)와 바이오 제품(Bio-based product)이 주목받고 있다. 이에 따라 목질계 바이오매스가 바이오에탄올, 바이오 부탄올 같은 에너지원 및 플라스틱 등의 화학 원료 생산을 위한 재료로서 주목받고 있다(Kamm et al., 2007). 이 중 바이오에탄올은 미국, 브라질을 중심으로 휘발유와 혼합되어 이용됨으로써 석유를 대체하는 효과적인 에너지원으로 인식되고 있다. 바이오매스 자원으로부터 생산된 바이오에탄올은 이산화탄소 중립자원으로서 친환경적이고 재생 가능한 경제적인 에너지원으로 인식되고 있다(Gwak et al., 2016). 국내에는 2015년부터 신재생 연료 혼합의무화 제도(Renewable Fuel Standard, RFS)가 시행되었고 2017년부터 바이오에탄올 혼합이 의무화되면서 바이오에탄올 보급이 확대될 것으로
예상되어왔다(Lee and Koo, 2014).
바이오매스는 옥수수, 콩, 사탕수수 등 당·전분질계 1세대 바이오매스, 목질계 2세대 바이오매스 와 미세조류와 같은 3세대 바이오매스로 분류된다. 1세대 바이오매스는 곡물을 이용 하는 점에서 식량자원 부족 및 곡물가 상승 등으로 인해 미국 및 브라질을 제외하고는 경제성 및 실효성에 문제가 되고 있다. 따라서 자연계에 가장 풍부하고 원료의 수급성이 좋은 2세대 바이오매스인 농업부산물과 목질계 바이오매스가 많은 주목을 받고 있다(Nigam and Singh, 2011).
유채대는 바이오 디젤용 유채씨(rapeseed) 채취 후, 남은 부산물로 사료나 퇴비자원으로 주로 이용되었다. 그러나 이외의 소재화 방안이 미비하고 식량자원에도 영향을 끼치지 않아 바이오 에탄올 등 바이오 에너지 자원으로 각광받고 있다(Han et al., 2009).
미생물을 이용해 바이오매스로부터 바이오 화학 물질 및 소재로 생산하기 위해서는 값싸고 효율적인 발효당(fermenatable sugar)의 생산이 필요하다(Shrestha et al., 2013). 일반적으로 바이오매스로부터 화학제품 및 바이오 에너지의 생산을 위한 공정은 효소와 미생물 반응의 저해 물질 성분을 제거하고 cellulose와 hemicellulose에 대한 효소의 효율을 향상시키기 위한 전처리 공정(pretreatment), cellulose와 hemicellulose의 효소가수분해를 통해 발효 가능한 당류로 변환하는 효소 당화 공정(enzymatic saccharification), 그리고 생성된 당을 효모 또는 박테리아 등을 이용하여 바이오에타놀로 전환시키는 미생물 발효공정(microbial fermentation)으로 구분할 수 있다(Mosier et al., 2005).
목질계 바이오매스로부터 만들 수 있는 여러 가지 바이오 제품(bio-based product)들은 지금까지 낮은 효율과 높은 생산원가의 문제점 때문에 상용화에 어려움을 겪고 있다. 미국 NREL (National Renewable Energy Laboratory)의 보고서에 의하면 옥수수대로부터 에탄올 생산을 하는 공정은 당화에 필요한 전처리 비용과 높은 효소 비용이 해결해야 할 두 가지 주요 항목으로 분석되었다(Humbird et al., 2011).
Cellulomonas 속은 Bergey et al. (1923)에 의해 처음 제안되었다. 현재까지 27종이 발견되었으며, 주로 cellulose가 풍부한 토양, 나무 등에서 분리되었다. 대부분의 Cellulomonas 속 균주는 그람 양성 간균이며, 높은 GC 함량(69 - 76 mol%)을 가지고, 무포자형성균이다(Abt et al., 2010). Cellulomonas 속은 cellulose와 hemicellulose의 분해가 가능하며, 이와 같은 다양한 cellulosic 탄소원에서 생육이 가능하다(Beg et al., 2001; Pérez-Avalos et al., 1996; Rajoka, 2004).
본 연구에서는 유채대를 활용한 가장 효율적인 에탄올 고수율 공정을 알아보기 위해 섬유소분해세균 Cellulomonas flavigena 조효소액을 이용하여 전처리 방법에 따른 유채대의 구성성분 변화와 당화효율을 분석하고, 또한 C. flavigena 조효소액과 효모 Saccharomyces cereviase에 의한 분리당화발효법(separate hydrolysis and fermentation, SHF)에 의해 생성된 에탄올 수율을 분석하였다.
Materials and Methods
실험재료
본 연구에 사용된 바이오매스 유채대(잎 포함; 이하 유채대로 지칭)는 대전광역시 중촌동에서 수집하였으며, 건조 후 믹서기를 이용하여 분쇄하였다. 분쇄한 유채대는 10 - 40 mesh 크기의 체를 이용하여 적당한 크기의 바이오매스를 선별하였다.
전처리 및 효소활성에 사용된 시약은 Sigma-aldrich (St. Louis, MO, USA)와 Junsei chemical (Tokyo, Japan)사의 제품을 이용하였다.
생육곡선
배양기간에 따른 생균수와 효소활성을 확인하기 위하여 Cellulomonas flavigena를 Dubos broth에 배양하여 12시간 마다 분광광도계를 사용하여 OD (absorbance) 600 nm에서 배양액의 탁도를 측정함으로써 생육 정도를 확인하였다. Dubos broth는 증류수 1 L에 Dubos salt (1 g NaNO3, 1 g K2HPO4·7H2O, 0.5 g MgSO4·7H2O, 0.5 g NaCl, 0.01 g FeSO4·7H2O), 0.02 g yeast extract와 10 g 탄소원을 첨가 후 acutoclave를 사용하여 멸균하였다(Dubos, 1928). 탄소원은 CMC (carboxylmethyl cellulose), xylan, locust gum (galacto-mannan), 유채대(≤ 40mesh)를 사용하였다. 또한 각 시간 별 배양여액 중의 효소활성을 측정하였다.
단백질 정량
C. flavigena 조효소액의 단백질을 정량하기 위하여, Bradford법(Bradford and Marion, 1976)을 이용하였다. 즉, 배양상등액 0.5 mL에 bradford 시약 1 mL을 첨가한 후, 상온에서 5분간 정치하였다. 이 후 UV spectrometer (Thermo sci. USA)를 이용하여 595 nm에서 흡광도를 측정하여 단백질을 정량하였다. 단백질 정량의 표준물질로는 BSA (Bovin Serum Albumin)을 이용하였다.
효소활성
C. flavigena의 섬유소 분해효소활성을 조사하기 위하여 CMC, xylan, locust gum (galacto-mannan), 유채대를 탄소원으로 하는 Dubos broth를 제조하여 C. flavigena를 배양하였다. 배양액을 4°C, 10,000×g에서 20 min 원심분리한 후 회수한 상등액을 조효소액으로 사용하였다. 배양 12시간 간격으로 조효소액을 0.1 % CMC, xylan, locust gum, 유채대를 기질로 하는 기질 용액과 40℃에서 30 min 반응시켜 반응 후 생성되는 환원당은 DNS법(Miller, 1959)을 이용하여 정량하였다. 즉, 기질용액 0.5 mL를 water bate에서 미리 예열한 후, 조효소 액 0.25 mL를 첨가하여 30분간 반응시켰다. 반응시킨 용액은 DNS시약 3 mL을 넣은 후 5분간 끓여주어 반응을 정지 시키고, 환원당을 발색시켰다. 이 후 UV spectrometer (Thermo, USA)를 이용하여 520 nm에서 환원당을 정량하였다. 사용한 기질용액은 pH 별로 glycine-HCl buffer (pH 3.0), sodium acetate buffer (pH 5.0), sodium phosphate buffer (pH 7.0), glycine-NaOH buffer (pH 9.0)에 각 각의 기질을 첨가하여 사용하였으며, 반응 온도는 40°C로 설정하였다.
유채대의 전처리
유채대의 전처리 방법으로는 산(1% H2SO4), 염기(2% NaOH), 15% 암모니아수 침지, 열수(autoclave) 처리를 하였다.
산 전처리는 1% H2SO4 100 mL에 유채대를 10:1 비율로 하여 1시간 침지 후 autoclave (Sanyo, Japan)을 이용하여 전처리하였다. 염기처리는 2% NaOH에 유채대를 6:1 비율로 하여 85°C에서 1시간 침지하였다. 암모니아수 침지는 15% 암모니아수에 유채대를 6:1 비율로 하여 60°C에서 6시간 침지하였다. 열수처리는 증류수 100 mL에 유채대를 10:1 비율로 하여 autoclave를 이용하여 121°C에서 15분간 반응하였다.
전처리 방법에 유채대 고형물의 성분 변화는 미국 NREL에서 제시된 방법으로 분석하였다(Sluiter et al., 2008). 시험관에 고체 샘플 0.3 g과 72% (w/w) H2SO4 3 mL를 혼합한 뒤 30°C에서 2시간동안 1차 산 가수분해를 하였다. 이후 증류수 84 mL을 넣어 4.0% H2SO4 로 희석한 후 autoclave를 이용하여 121°C에서 1시간 동안 2차 가수분해를 하였다. 가수 분해된 액체를 10 mL를 CaCO3를 이용하여 pH 7로 중화시켜 HPLC를 이용하여 분석하였다.
효소당화
당화실험은 C. flavigena를 유채대를 탄소원으로 하는 Dubos broth에서 48시간 배양 후 원심분리하여 그 상증액을 이용하여 수행하였다. 전처리된 유채대를 기질농도 10 %로 0.4 M sodium acetate buffer (pH 5.0)에 혼합한 후 C. flavigena의 조효소액를 1:1로 첨가하여 40°C의 shaking incubator에서 180 rpm의 속도로 교반을 시키며 당화를 진행하였다. 효소당화 처리효율(Es, %)은 식 (1)로 나타낼 수 있다.
여기서 ΔSts는 효소 가수분해시 생성되는 당의 농도(g/L)이며, TC는 당화 전 유채대의 당성분 함량이다. 당화액은 autoclave를 이용하여 멸균 후 에탄올 발효에 사용하였다.
당화액 에탄올 발효
에탄올 발효는 glucose와 xylose 모두 발효가능한 Saccharomyces cerevisiae를 에탄올 발효에 이용하였다. S. cerevisiae는 potato dextrose broth (PDB)에 24 시간 배양하여 활성화 시킨 후 원심분리하여 배지를 제거하였고 이를 멸균된 당화액에 접종하였다. 당화액과 혼합한 뒤 30°C, 180 rpm의 조건으로 발효를 진행하였다. 발효는 120시간 동안 진행하였으며, 12시간 간격으로 시료를 채취하여 HPLC분석을 통해 에탄올과 유리당을 정량분석 하였다. 분리 당화 발효로 생산된 에탄올의 수율 (YEtoH, g/g)은 다음 식 (2)로 나타낼 수 있다.
여기서 [EtOH]max는 에탄올 발효로 인해 생성되는 최종 에탄올의 농도 (g/L)이며, [Sugar]ini는 에탄올 발효 초기 유리당의 농도(g/L)이다.
HPLC 분석
본 연구에서 에탄올과 유리당의 분석은 모두 HPLC를 이용하여 분석하였다. 모든 시료는 0.45 μm syringe filter를 이용해 여과 후, HPLC를 이용하여 분석하였다. HPLC는 Shimazhu HPLC system (Shimazu, Japan)을 사용하였으며, 컬럼은 Shodex sugar SH1011 (8.0 × 300 mm, 6 μm) column (Showa Denko, Japan)를 사용하였다. 용매는 0.005N H2SO4를 분당 0.6 mL로 흘려주었으며, 컬럼의 온도는 50°C로 유지하였다. 검출은 RI detector (Shimazu, Japan)를 이용하여 확인하였다. Auto sampler (Shimazu, Japan)를 이용하여 시료 25 μL을 주입하여 분석하였다.
모든 표준물질은 Sigma사와 Junsei사에서 구입하여 사용하였다. 표준물질은 1.25, 2.5, 5, 10, 20 g/L 의 농도로 제조 후, calibration curve를 작성하였고, 이를 이용하여 각 물질을 정량하였다.
Results and Discussion
생육곡선
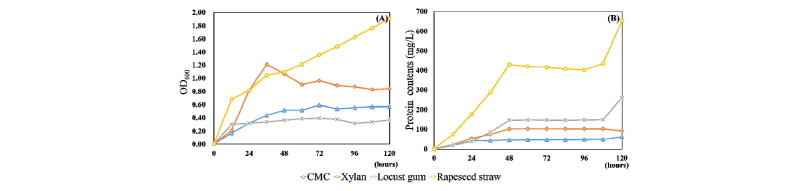
배양기간에 따른 생균수를 확인하기 위하여 C. flavigena를 탄소원 0.1%가 함유된 Dubos broth에 배양하여 12시간 마다 배양액을 600 nm에서 흡광도를 측정하였다. CMC, locust gum을 탄소원으로 가지는 배지에서는 배양 48 시간 후에 정체기가 나타났으며, 두 배지 모두 OD600은 0.4 - 0.5 사이로 나타났다. Xylan을 탄소원으로 가지는 배지에서는 CMC, locust gum과 마찬가지로 배양 48시간 후에 정체기가 나타났으며, 이 때 OD600 값은 1.2 - 1.4를 나타내었다. 단일 탄소원을 가지는 배지와 달리 유채대를 탄소원으로 하는 배지에서는 배양 후 120시간까지 정체기가 나타나지 않았다. 배양 48시간 후에는 OD600 값이 0.5로 CMC, locust gum을 탄소원으로 하는 배지보다 높게 나타났으며, 배양 84시간 후에는 1.5로 xylan을 탄소원으로 가지는 배지보다 높게 나타났다(Fig. 1). 이는 유채대가 분해됨에 따라 배양액의 탁도를 증가되었거나, 유채대에 C. flavigena의 생장을 돕는 영양성분이 풍부하여 정체기가 나타나지 않은 것으로 보인다.
단백질 정량
배양기간에 따른 조효소액 내의 단백질 양을 확인하기 위해 bradford시약을 사용하여 단백질을 정량하였다. 단백질양은 CMC < xylan < locust gum < 유채대 순으로 나타났다. 단백질량은 48시간동안 증가한뒤 정체를 보였다. 배양 48시간 후에 CMC는 45.83, xylan은 102.50, locust gum은 145.00, 유채대는 429.17 mg/L의 단백질량을 보였다(Fig. 1). 유채대는 배양 96시간 이후에 단백질량이 크게 증가하였다. 이는 생육곡선에서 균의 생장이 지속적으로 이루어지는 이유와 같을 것으로 생각된다.
C. flavigena의 섬유소분해 효소활성
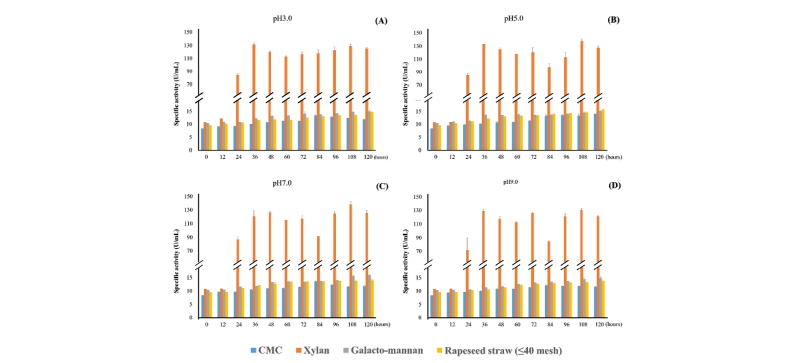
C. flavigena의 섬유소 분해효소활성을 알아보기 위하여 CMC, xylan, locust gum, 유채대를 기질로 하여 효소활성을 측정하였다. pH는 3.0, 5.0, 7.0, 9.0으로 나누어 진행되었으며 반응온도는 40℃로 설정하였다. 기질용액으로는 0.1 %의 기질을 포함한 lycine-HCl buffer (pH 3.0), sodium acetate buffer (pH 5.0), sodium phosphate buffer (pH 7.0), glycine-NaOH buffer (pH 9.0)를 사용하였다. 각 탄소원의 분해활성은 locust gum < CMC < 유채대 < xylan 순으로 나타났으며, 모두 pH 5.0에서 가장 높은 활성을 나타내었다. CMCase활성은 배양기간동안 점점 증가하여, 배양 120시간 후(pH 5.0)에 14.02 U/mL로 가장 높게 나타났다. Xylanase 활성은 배양 48시간 후(pH 5.0)에 133.40 U/mL로 가장 높게 나타났으며, 이 후 점차 감소하여 배양 120시간 후에는 127.62 U/mL로 나타났다. Xylanase는 다른 효소보다 활성이 매우 높게 나타났다. Galacto-mannanase활성은 CMCase와 마찬가지로 배양기간 동안 점점 증가하여 배양 120시간 후(pH 5.0)에 15.21 U/mL로 가장 높게 나타났다(Fig. 2). 유채대를 기질로 할 때, C. flavigena의 유채대 분해 효소활성은 배양 기간 동안 점점 증가하여 배양 120시간 후에 15.731 U/mL로 가장 높은 효소활성을 나타내었다.
유채대의 전처리 전·후 구성성분 변화
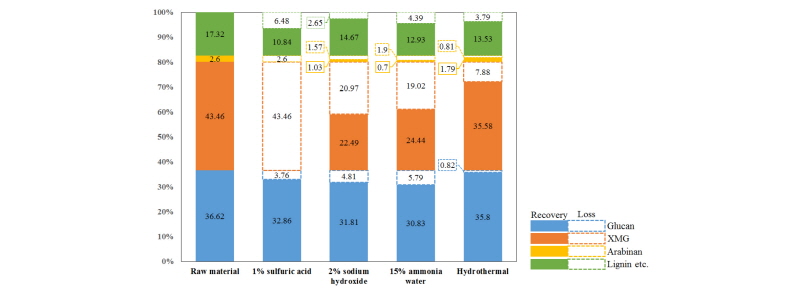
유채대를 산(1% H2SO4), 염기(2% NaOH), 15% 암모니아수 및 열수를 이용하여 전처리한 후, 전처리 전·후의 구성성분의 변화를 조사 하였다. 본 연구에 사용된 유채대는 glucan 36.62%, XMG (xylan + mannan + galactan) 43.20% , arabinan 2.73%으로 높은 hemicellulose 함량을 보였으나, 유채대를 1% H2SO4로 전처리 후에는 구성성분의 상대적인 비율이 glucan (75.2%)을 제외한 대부분의 구성성분이 제거되었고, 고형성분의 회수율도 43.7%로 절반 이하의 회수율을 보였다. 2% NaOH를 사용한 전처리 후에는 glucan 45.44%, XMG 32.13%, arabinan 1.47%로 상대적으로 glucan과 XMG의 비율이 다소 감소하였고 고형성분의 회수율도 70%로 산처리 보다 높은 회수율을 보였다. 15% 암모니아수 처리 후에는 glucan 44.75%, XMG 35.47%, arabinan 1.02%로 NaOH 전처리 보다 상대적으로 glucan과 arabinan의 비율은 다소 감소하였고, XMG의 비율은 증가하였다. 회수율 또한 68.9%로 NaOH 전처리보다 조금 더 유실율이 높았다. 열수처리한 유채대는 glucan 41.29%, XMG 41.04%, arabinan 2.06%으로 구성성분의 변화가 가장 적었고, 회수율도 86.7%로 가장 높아 분해가 안된 것으로 판단되었다(Fig. 3). Kang et al (2012)은 유채대가 cellulose 33.32%, hemicellulose 18.52% 그리고 Talebnia et al. (2015)은 cellulose 38.1%, hemicellulose 20.4% 으로 구성되어 있다고 보고하였다. 본 연구에 사용된 유채대는 hemicellulose 성분인 XMG가 43.20%로 Kang et al. (2012)과 Talebnia et al. (2015)이 분석한 유채대보다 hemicellulose 함량이 높게 나타났다.
에탄올 분리 당화 발효
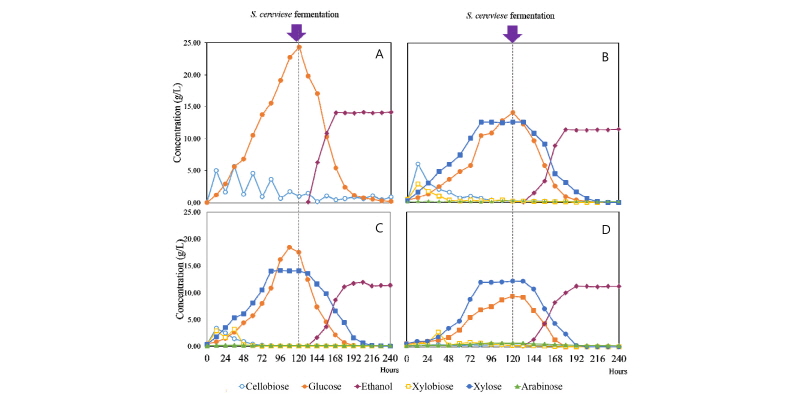
각 전처리과정을 거친 기질과 C. flavigena의 조효소액을 이용하여 120시간 효소당화를 진행하였고 이 후 멸균과정을 거쳐 S. cerevisiae를 접종하여 바이오에탄올을 생산하였다. 전처리 방법 별로 효소당화 및 에탄올 생산 결과를 Fig. 4에 나타내었다. 산 전처리 한 유채대의 경우 cellobiose는 생산과 분해를 반복하였으며 당화 120시간 후 glucose는 24.36 g/L의 농도로 생산되었다. 효모 접종 후 glucose는 감소하여 발효 96시간 후 0.53 g/L 으로 감소하고, 발효 48시간 후 에탄올은 14.15 g/L가 생산되었다. 이 때 당 전환율은 64.81%, 에탄올 수율은 58.06% 였다. 염기 전처리한 유채대는 당화 120시간 후 14.11 g/L의 glucose가 생산되었으며 당화 84시간 후 12.61 g/L의 xylose가 생산되었다. 발효 전 총 당은 26.73 g/L였고 발효 84시간 후 0.21 g/L로 감소하고 발효 120시간 후에 에탄올은 11.46 g/L 였다. 이 때 glucan 전환율은 62.12% xmg (xylose + mannose + galactose) 전환율은 78.59%, 에탄올 수율은 56.72% 였다. 암모니아 침지한 유채대는 당화 120시간 후 18.64 g/L의 glucose가 생산되었으며 당화 84시간 후 14.02 g/L의 xylose가 생산되었다. 발효 전 총 당은 27.71 g/L였고 발효 84시간 후 0.90 g/L로 감소하고 이때 에탄올은 11.92 g/L였다. 이 때 glucan 전환율은 60.98% XMG 전환율은 79.11%, 에탄올 수율은 54.66% 였다. 열수 전처리한 유채대는 당화 120시간 후 9.38 g/L의 glucose가 생산되었으며 당화 84시간 후 11.97 g/L의 xylose가 생산되었다. 발효전 총 당은 21.57 g/L였고 발효 72시간 후 0.59 g/L로 감소하고 이때 에탄올은 11.29 g/L였다. 또한 glucan 전환율은 45.42% XMG 전환율은 58.46%, 에탄올 수율은 52.88% 였다. Glucan 전환율과 에탄올 수율은 산 > 염기 > 암모니아침지 > 열수, XMG 전환율은 암모니아침지 > 염기 > 열수 순으로 높게 나타났다.
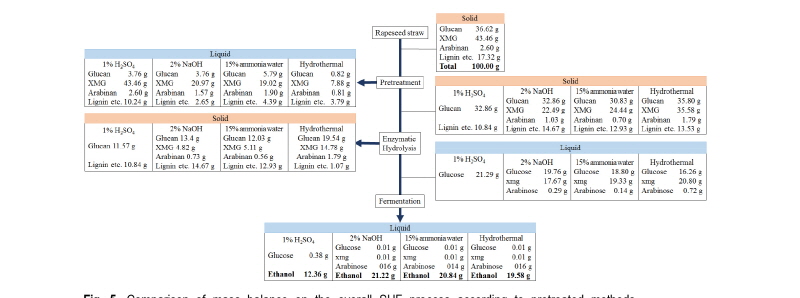
Mass balance
유채대를 이용한 각각의 전처리 방법에 따른 효소당화 및 에탄올발효 효율의 mass balance를 조사한 결과, 유채대 100 g 당 산 전처리 12.36 g (14.15 g/L), 염기 전처리 21.22 g (15.16 g/L), 암모니아침지 20.84 g (15.12 g/L), 열수 전처리 19.58 g (11.29 g/L)의 에탄올 생산량으로 조사되어 NaOH 전처리 방법이 가장 높게 나타났다(Fig. 5).
Conclusion
본 연구에서는 화학적 방법에 의해 전 처리된 유채대(rapeseed straw)를 섬유소분해세균 Cellulomonas flavigena의 조효소액과 Saccharomyces cereviase를 이용한 분리당화 발효법(separate hydrolysis and fermentation, SHF)에 의해 생성된 에탄올 수율을 분석하였다. Biomass 기질 CMC, xylan, locust gum 와 유채대에 대한 C. flavigena의 조효소액의 분해활성은 pH5.0, 40°C 에서 각 14.02 (CMC), 137.35 (xylan), 15.21 (locust gum), 15.73 (유채대) U/mL의 활성을 보였다. 유채대는 HPLC 분석결과, glucan 36.62%, xylan + mannan + galactan (XMG) 43.46%, arabinan 2.6%로 구성되었으며, 전처리 방법에 따라 H2SO4 전처리 후 glucan 75.2%, NaOH 전처리 후 glucan 45.44% 와 XMG 32.13%, NH4OH 전처리 후 glucan 44.75% 와 XMG 5.47%, 열수 전처리 후에는 glucan 41.29% 와 XMG 41.04%로 구성비율이 변하는 것으로 조사되었다. 유채대 전처리물을 C. flavigena 조효소액으로 당화한 후 당화산물을 HPLC 분석한 결과, glucan의 45.42 - 64.81%가 glucose로 당화 되었고, XMG는 58.46 - 78.59%의 xylose + mannose + galactose로 분해되는 것으로 조사되었다. 이들 전처리 별 당화액에 S. cerevisiae를 접종하여 분리당화발효(SHF)하여 생산된 에탄올 수율은 약 52.88 - 58.06 % 수준인 것으로 계산되었다. 또한 Mass balance는 NaOH 전처리 시, 유채대 100 g당 에탄올 생산량이 21.22 g으로 전처리 방법 중 가장 높게 나타났다. 결과적으로 유채대를 이용한 당화 및 에탄올 발효 공정 시, NaOH 전처리 방법과 C. flavigena의 조효소액을 이용한 당화법이 가장 효율적인 방법이었다.