Introduction
이유자돈 시기에 설사를 일으키는 주요 요인 중 하나로 Escherichia coli (E. coli)가 지목 되고 있으며, 이로 인한 설사는 성장률 저하, 폐사와 같은 증상을 초래 하고 양돈 농가에 경제적 손실을 가져 온다(Kim et al., 2011). Enterotoxigenic E. coli (ETEC)는 신생자돈이나 이유자돈에서 공통
적으로 설사를 유발 시킬 수 있는 인자로써(Moon et al., 1980; Moon and Bunn, 1993; Melin et al., 2000), 통성혐기성(facultative anaerobe) 박테리아가 병원성 대장균과 비병원성 대장균의 형태로 장내나 대변에 존재한다(Hampson, 1994; Pluske et al., 2002). ETEC는 병원성 대장균으로, 이에 민감한 십이지장과 공장 등을 감염 시키고 증식하여 독소를 발생 하고 소장과 대장 점막을 자극하므로 전해질과 수분 대사에 이상을 초래하여 조직 내 수분을 장관 내로 유출시켜 설사를 유발시킨다(Cho et al., 1992). 이유자돈은 환경 변화, 생리적 변화, 영양적 스트레스로와 모돈으로부터 전달 받은 면역력이 감소하는 시기로, 병원성 대장균의 독소 발생으로 인한 감염에 매우 민감한 시기라 할 수 있다(Hedemann et al., 2006; Heo et al., 2010; Kim et al., 2012; Heo et al., 2013). 하지만 이유자돈의 성장률과 소화관내 건강에 관한 연구들은 일반 양돈 사양 농가의 환경과는 다르게 깨끗하고 위생적인 환경으로 만들어진 실험 시설에서 수행되었다(Beloeil et al., 2003; Heo et al., 2013; Kim et al., 2014). 따라서 이러한 환경에서 얻어진 연구 결과물을 실질적으로 현장에 적용하기에는 더 많은 실험적 검증이 필요하다 할 수 있다(Heo et al., 2013). 그러므로 이러한 환경적 차이를 줄이고 현실적인 결과를 도출하고자 이유자돈 실험을 대상으로 ETEC를 구강 공격 접종 모델로 하여 일반 농장 환경을 모방하는 방법들이 시도되어 왔다(Heo et al., 2013; Kim et al., 2014). ETEC 공격 접종을 하기 위해서는 생시 체중, ETEC의 농도, 자돈의 일령 및 건강상태 그리고 돈사의 시설과 환경 등이 고려되어야 할 사항들이 있다(Fairbrother et al., 2005). ETEC 공격 접종의 문제점은 첫째로, 접종 시 ETEC의 농도를 즉시 측정 할 수 없고, 두번째로 적절한 접종 농도를 준비하는데 시간이 오래 걸린다는 것이다. 또한 trypticase soy broth (TSB)로 배양한 ETEC를 PWD증상을 유도하기 위하여 사료에 섞어 급여하거나 공격 접종을 하게 되는데 TSB가 이유자돈에게 기호성이 낮아 ETEC의 접종이 원활히 되지 않으며, 공격 접종 시 ETEC가 식도로 주입되지 않고 기도로 주입 될 수가 있어 폐사로 이어 질 수 있다(Kim et al., 2014). 이러한 다양한 문제점을 해결하고자 sweetener와 dextrose를 TSB와 혼합하여 이용함으로써 이유자돈에게 기호성을 높이는 방법이 보고 되었다(Kim et al., 2014). 또한 Sucrose를 사료에 5% 첨가함으로써 기호성이 높아졌다는 연구가 있다(Munro et al., 2000).
따라서 본 실험의 목적은 첫째, ETEC의 colony forming unit과 optical density의 관계를 이용하여 ETEC의 농도를 측정하는데 이용 할 수 있는 공식을 수립하며, 둘째, ETEC를 -20℃에 저장 보관한 뒤 생존율을 확인하고, 셋째, ETEC에 다양한 농도의 sucrose를 첨가하여 ETEC에서의 생존 적정 농도를 알아 보는 것이다.
Materials and Methods
대장균의 분리 및 배양
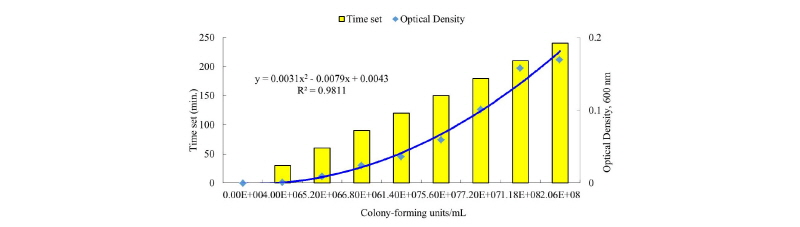
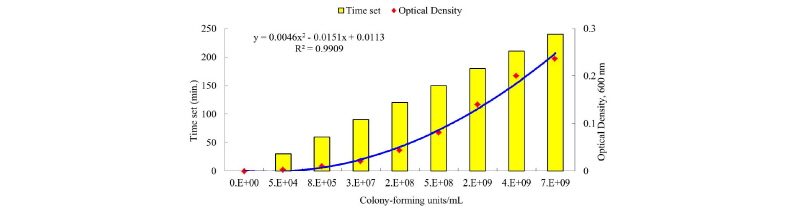
Enterotoxigenic Escherichia coli (E. coli O141: K85ab, and E. coli O139: K82; Centers for Disease Control & Prevention, Cheongju, Chungbuk, South Korea)의 균주를 in vitro 실험에 이용했다. ETEC를 sheep blood (50 mL/L; MB cell, LA, CA, USA) agar plate (Blood agar base, MB cell)에 도포하고(McDonald et al., 2001), 37°C 인큐베이터에서 24시간 동안 배양하였다. 그 후 ETEC의 single colony를 취하여 멸균된 튜브에 준비한 20 mL TSB에 넣고 상온 (20 - 25°C)에서 24시간 배양하였다. 그 후 4 mL를 취하여 400 mL TSB가 들어있는 글라스 비이커에 옮겨 100배 희석시켰다. 희석시킨 용액을 37°C로 조정된 수조에서 4시간동안 배양시켰다. 배양 동안 30분 단위로 나누어 총 9번의 serial dilution과 UV-VIS spectrophotometer (Ultrospec 2100 pro, Biochrom, Cambridge, England)를 이용하여 colony forming unit의 측정값과 600 nm에서의 optical density를 조사하였다.
대장균 동결
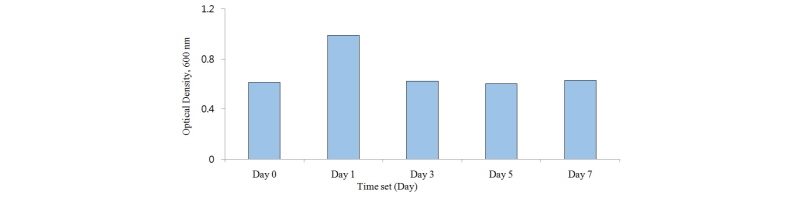
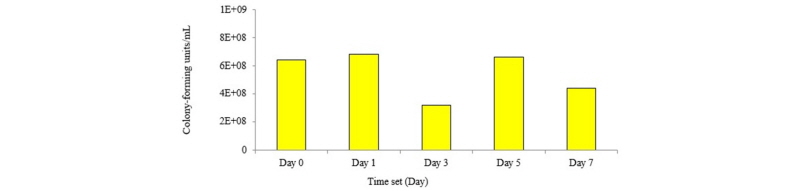
ETEC (E. coli O141: K85ab)의 colony-forming unit (cfu)/mL이 108 - 109에 도달하였을 때, 50 mL씩 falcon tube에 8개로 나누어 분주하였다. 분주된 샘플들은 원심분리기를 이용하여 4°C에서 15분 동안 3,000 × g로 원심 분리를 한 뒤, 상층액 제거 후 -20°C에서 동결 시켰다. 동결 시킨 ETEC를 1, 3, 5 그리고 7일에 각각 37°C 의 TSB 50 mL를 넣어 해동 후 serial dilution 한 후 optical density를 측정하였다.
Sweetener 처리
분리 및 배양 그리고 희석된 ETEC (E. coli O139: K82) 25 mL와 phosphate buffered saline (PBS)으로 희석된 sucrose (0, 5, 10, 20%, 40%) 25 mL을 각각 혼합 시킨 뒤 생존률을 조사하였다.
Results and Discussion
각각의 ETEC (E. coli O141: K85ab, and E. coli O139: K82)를 serial dilution한 용액을 5% sheep blood agar에 도포한 후 37°C 인큐베이터에서 24시간 동안 배양하였다. 배양 후 colony forming unit 개수와 optical density를 측정한 값의 관계는 각각 Fig. 1 과 Fig. 2에 나타내었다. 측정된 optical density는 ETEC colony forming units 각각에서 R2 = 0.9811, R2 = 0.9909 값이 성립되었다. 그러므로 설립된 곡선형공식은 TSB에서의 ETEC 농도 정량 시 이용 할 수 있으며, 각 개체마다 필요한 접종 ETEC 농도의 정확성이 상기 결과의 곡선형공식에 의하여 개선될 수 있다.
동결보존하여 1, 3, 5, 7일 동안 저장한 ETEC의 생존 능력은Fig. 3와 Fig. 4와 같다. ETEC의 각 저장기간 동안 optical density값은 1일을 제외하고 값에 차이가 나지 않았다(Fig. 3). Fig. 4에서는 1, 3, 5, 7일의 colony forming unit의 값이 서로 다르게 나타났는데, Jensen et al. (2006)과 Kim et al. (2014)에 따르면 colony forming unit이 108 - 109이면 일반 양돈 농장과 유사한 환경을 만들 수 있다고 보고한 바 있다. 따라서 본 실험결과에서도 108 cfu/mL을 유지하였으므로 ETEC를 7일간 동결 보존 후 효과적으로 사용할 수 있다고 사료된다(Fig. 4). E. coli의 균주는 저장 및 이동 시 -70°C 또는 더 낮은 온도에서 보관하는 경우도 있다 (Noamani et al., 2003; Chen et al., 2004; Sorensen et al., 2009). 본 연구결과에서는 ETEC가 -20°C 에 효과적으로 저장 되어 해동된 뒤 배양한 결과 대장균 생존 능력에는 문제가 없음을 알 수 있었다(Fig. 3 and Fig. 4).
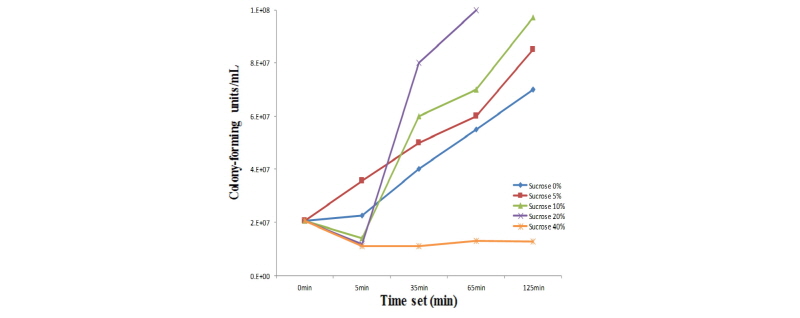
서로 다른 sucrose 농도 대한 colony 수는 Fig. 5와 같다. 그 결과 5% sucrose 농도에서는 0%와 비슷하게 자라는 것을 볼 수 있다. 10 또는 20%처리 시 5분 후에 감소하는 경향을 보였으나 차후에 급격한 성장을 하였다. 40%처리 시 5분 후부터 감소하는 경향을 보였으며 그 이후에는 유의적 변화가 없었다. Small et al. (1994)에 따르면 TSB로 희석한 45%의 sucrose를 60분 처리하였을 때 삼투압에 높아지는 영향으로 대장균이 사멸하여 증식하지 않았다고 보고 된바 있다. 하지만 본 결과에서는 PBS로 희석한 10%와 20% sucrose 농도에서 생존 능력이 점진적으로 증가한 바, 대장균 증식에 긍정적인 영향을 끼치는 것을 확인하였다. 그러므로 PBS와 TSB희석액에 따른 비교 실험과 더불어, sucrose 농도에서의 생존율을 알아보기 위한 실험이 필요하다고 보여진다. 추가적으로 sucrose 처리 시 이유자돈의 기호성 적합 여부에 관한 실험이 필요 하다고 사료된다.
Conclusion
공격 접종에 필요한 ETEC에 농도 측정방법, 보관 온도에 따른 생존율 그리고 기호성을 높이기 위한 sucrose첨가 실험은 다음과 같은 결과를 얻었다. ETEC에 colony forming unit, optical density를 측정한 값의 관계를 통하여 설립된 곡선형공식을 이용하게 되면, TSB에서의 ETEC의 세포 density의 농도를 구할 수 있다. 또한, ETEC를 -20°C에서 7일간 보관한 결과 colony forming unit이 108 cfu/mL 이상을 유지 할 수 있었다. PBS로 10%와 20% 희석된 sucrose 첨가 시 colony forming unit값이 5분 후에 감소하는 경향을 보였으나 차후에 급격한 성장을 하였다. 결과적으로 이유자돈에 대한 공격 접종을 위한 효과적인 방법을 수립할 수 있었다.