Introduction
가축사양에서 항생제의 사용은 질병의 예방과 사료효율 증진, 성장촉진 등을 목적으로 사료첨가제로 사용되어 왔다(Cromwell et al., 2002). 하지만 체내 잔류 문제와 항생제 오남용으로 인한 병원균의 내성 증가 및 슈퍼박테리아의 등장으로 2006년 1월부터 유럽연합에서는 사료첨가제용으로 항생제 사용을 금지했다(Kamphues et al., 1999). 우리나라도 2011년 7월 이후 치료목적 외의 항생제 사용이 법적으로 금지되었고, 항생제나 화학용법의 대안으로 생균제에 대한 관심이 높아졌다. 항생제와 생균제는 둘 다 성장률을 개선하고 사료효율을 높인다고 보고되지만, 항생제는 축산물 내 잔류 문제와 내성 문제가 우려되는 반면, 생균제는 비교적 이러한 문제점들에서
자유롭다는 것에 관심이 몰리고 있다.
생균제의 급여는 살아있는 미생물을 사료에 첨가하여 가축에게 투여 하였을 때, 가축의 장내 미생물 균 총의 균형을 개선시킴으로써 숙주동물에게 유익한 작용을 유도 할 수 있는 것으로 알려져 있다(Fuller et al., 1989). 또한 가축의 성장과 사료효율에 영향을 미친다고 알려진 후 가축의 질병예방이나 치료와 생산성 향상에 효과적이며(Tortuero et al., 1973), 장내 유익한 미생물을 공급하여 사료의 소화흡수, 성장촉진, 사료효율 개선에 효과가 있는 것으로 알려졌다(Han et al., 1984; Maeng et al., 1987). 생균제를 통해 공급된 유익한 미생물들은 장내 세균의 증식을 억제하고 장관 면역기관을 자극하여 면역기관의 발달을 촉진하고 최종적으로는 가축의 건강을 유지하고 생산성 향상에 도움을 준다(Kim 2007). 최근까지 생균제에 대한 많은 연구가 이루어져 동물체내 작용기전이 많이 밝혀지고 있지만(Muralidhara et al., 1977), 아직도 밝혀지지 않은 부분들이 많고 특히 반추동물에 대한 생균제의 작용 및 효과는 단위동물에 비해 많이 알려지지 않았다(Ware et al., 1988).
LPS (lipopolysaccharide) 즉, 그람 음성세균 표층의 peptidoglycan을 싸고 있는 외막의 중요 구성성분으로 실험에서는 내독소로 사용해 시험 축에게 동시 다발적으로 병적 상태를 유발하는 것으로 알려져 있고, LPS challenge는 소의 급성면역반응을 분석하는데 대단히 효과적인 시험방법으로 사용 되어 왔다(Carroll et al., 2009). 본 실험에서는 일반사양을 실시한 대조구와 생균제를 급여한 처리구간의 면역반응의 차이를 알아보고자 하였다. 생균제를 미경산 한우에게 6개월간 급여하였고, 급여가 끝난 한우를 이용하여 실험적 기법인 LPS challenge를 실시 하였다. 이러한 방법을 이용하여 생균제의 급여가 일시적 병적인 상태에서 혈중 면역성분과 대사물질에 어떠한 영향을 미치는지를 시험하였다.
Materials and Methods
공시동물
본 실험은 2013년 5월 27일부터 10월 17일까지 약 6개월 간 국립축산과학원 한우연구소에서 사육되는 13개월령 미경산우 20두를 공시하였고, 시험구는 한 구당 2두씩 10우방을 사용하여 완전임의 배치하여 수행하였다. 한우 미경산우의 개시체중은 각각 대조구 236.5 ± 8.5 kg와 처리구 235.5 ± 7.4 kg으로 사양시험을 개시하였다. 처리방법은 대조구에는 일반사양을, 처리구에는 일반사양과 함께 생균제를 급여하였다. 사양실험이 끝난 후 LPS Challenge는 20두 중에 16두를 임의로 선발하여 2회에 걸쳐 실시하였다.
시험사료 및 사양관리
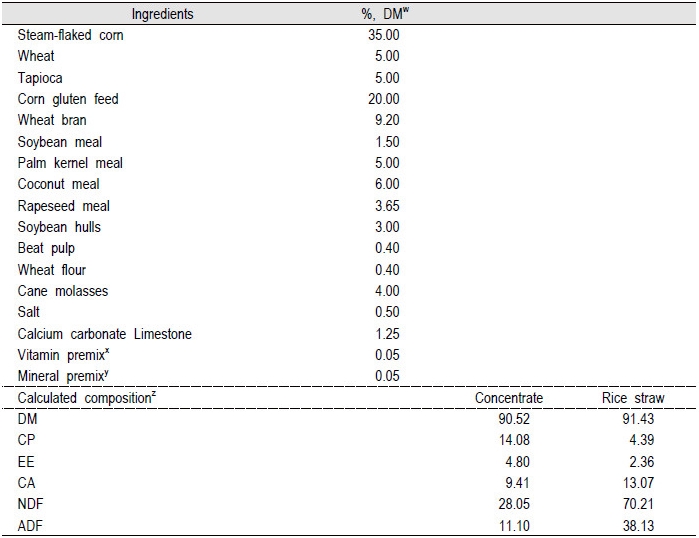
시험축은 콘크리트 재질의 바닥의 톱밥 우사에서 군집 사육하면서 배합사료는 1일 급여량을 2회(08:00, 16:00)균등 분배하여 부족하지 않게 제공하였으며, 조사료는 자유채식 하도록 하였다. 물과 무기물은 항시 섭취할 수 있도록 하였다. 시험에 사용된 사료는 시판되는 번식우용 배합사료와 조사료는 볏집을 급여 하였다. 시험사료의 일반성분 함량은 각각의 시료(2.0 kg)을 수집하여 AOAC 방법에 준하여 분석하여Table 1에 나타내었다. 사양 방법은 대조구는 일반사양을 처리구는 일반사양에 생균제를 추가로 급여하였다. 대조구와 처리구 모두 배합사료는 체중의 1.5% 수준으로 급여 하였고, 처리구는 생균제를 배합사료의 5%수준으로 매일 오전 배합사료 급여 시 탑드레싱하였다.
조사항목
체중조사는 시험개시일로부터 한 달 간격으로 총 6번에 걸쳐 축사 내에 설치된 우형기(CAS Korea, Newton HT-501A)를 이용하여 측정일 오전 사료급여 전에 수행하였다. 증체량은 개시 체중에서 매회 측정된 값의 차로 구하였고, 각 처리별 평균값을 실험일 수로 나누어 일당증체량을 구하였다.
혈액조사는 체중 측정 시 오전 사료급여 전에 공시축의 경정맥으로부터 채취 한 후 vacutainer (Becton Dickinson Korea)에 보관하였다. 채취한 혈액은 약 24시간 후에 원심분리기를 이용하여 3,000 rpm에 20분간 분리하였고 분리된 혈청은 micro tube에 1mL씩 담아 -70°C 초저온냉동고에 분석 전까지 보관하였다. 혈청 내 생리대사 물질인 Albumin (ALB), Glucose (GLU), Triglyceride (TG), Blood urea nitrogen (BUN), Total protein (TP), Phosphorus (IP), Non-esterified fatty acid (NEFA),의 농도를 혈청 분석기 (Hitachi 7020, Japan)를 이용하여 분석하였다.
LPS Challenge
사양실험이 끝난 16마리의 시험축을 축산과학원 한우연구소 내 대사실로 이동한 후 진행 하였다. 소를 한 마리씩 대사 틀에 보정한 후 경정맥에 70% ethanol과 betadine topical solution을 이용하여 소독을 한 후 5 mm정도 절개하여 catheter (16G, 1.72 mm, 정원메딕스)를 연결해 주었다. 24시간 물을 충분히 공급해 주고 순치를 시킨 후 다음날 아침에 catheter의 이상 유무를 확인한 후 혈액채취의 편의를 위해 식염수와 heparin용액으로 채운 링거 줄을 연결해 주었다. 모든 시험축의 연결이 끝난 후 실험을 시작하였다. 혈액채취는 30분 간격으로 총 13번을 실시하고, LPS의 주입 시기는 세 번째 채혈이 끝난 후 실시하였다. 채취한 혈액은 항응고제가 첨가되어 있는 vacutainer와 아무것도 첨가되어 있지 않은 vacutainer에 나누어 보관하였고, 아무것도 첨가되어있지 않은 vacutainer는 실험 후 혈청을 분리하여 분석 전까지 -70°C 초저온 냉동고에 보관하였다. 또한 항응고제가 첨가되어있는 vacutainer는 채혈 즉시 연구소 내의 실험실로 가져와 혈구분석기(Hemavet 950, UK)를 이용하여 혈구분석(WBC, BA, NE, NY, EO, MO, MPV, PLT, RBC, Hb, MCHC, HCT, MCV, MCH, RDW)을 실시하였다. 이후 사양 실험 때와 마찬가지로 생리대사 물질인 ALB, GLU, TG, TP, IP, NEFA는 연구소 내의 혈청 분석기(Hitachi 7020, Japan)를 이용하여 분석하였으며, 실험에서 사용된 LPS는 SIGMA의 Lipopolysaccharides from Escherichia coli 0111:B4를 이용하여 체중 1 kg당 1 µg으로 희석하여 주입하였다.
통계처리
통계처리를 위해서 얻어진 모든 성적들은 SAS (Statistical Analysis System software version 9.2)의 MIXED방법을 이용하여 분석하였다(처리구, 시간 및 처리구 × 시간 상관관계). 6개월간의 사양시험에서는 우방을 실험 유닛으로 사용하였다. LPS challenge 시험에서는 각각의 한우 미경산 암소를 실험 유닛으로 사용하였다. p < 0.05의 p-value 값을 유의성이 있는 것으로 분석하였고, 0.05 > p ≤ 0.10을 경향치로 분석 하였다.
Results and Discussion
사양실험
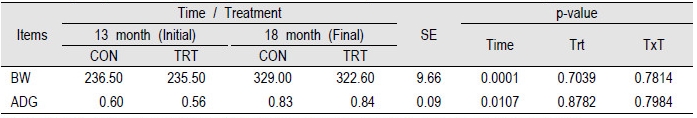
생균제를 급여하는 6개월, 사양실험이 진행되는 동안에 영양사양에 따른 체중 분석은 Table 2에 나타내었다. 사양실험이 진행되는 동안에는 체중 (p < 0.05)과 일당증체량 (p < 0.05) 모두 시간에 따라 유의적으로 증가하였다. 처리에 따른 유의성은 나타나지 않았고, 시간과 처리의 상관관계에서도 유의적인 차이가 나타나지 않았다 (p > 0.05). 실험이 진행되는 6개월 동안은 비육전기에 해당하는 시기로 몸무게가 급속도로 성장하기에 유의적인 차이가 나타났을 것으로 판단된다. 선행연구에서 56일 동안 chromium을 급여하는 동안 측정한 체중에서는 대조구와 처리구간의 수치적인 차이는 나타났지만, 유의적인 차이는 나타나지 않은 것으로 보아 사료첨가물의 급여로 짧은기간에 유의적인 차이를 나타내기에는 개체별 차이의 영향을 많이 받는 것으로 판단된다(Bernhard et al., 2012). 한우의 경우 15개월령에 일당증체량이 약 0.8 - 0.9 kg으로 알려져 있는데(Kim et al., 2012), 본 실험에서도 비슷한 수치가 나타났다.
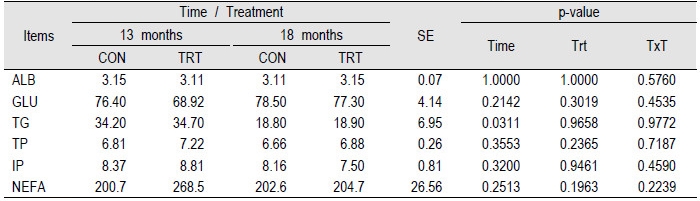
혈청내의 생리활성화 물질을 분석하여 Table 3에 나타내었다. 분석결과 시간과 처리구에 따라 유의적인 차이는 나타나지 않았고, TG의 경우에만 시간에 따른 유의적 차이가 나타났다. 선행연구에 따르면 13개월령의 농도는 육성기 거세우(Kim et al., 2012)와 비육전기 수소(Park et al., 2015)와 유사한 수치를 나타내고 있다. 이러한 결과로 볼 때 수소나 거세우에 비해 미경산우나 경산우의 혈중 TG농도가 대체적으로 높은 것으로 보인다. 또한 13개월령 시점이 18개월령 시점보다 혈중 TG의 농도가 높았던 것은 육성기가 지나고 비육전기로 들어감에 따라 성장이 활발하게 일어나는 시기였기 때문으로 보여 진다. 나머지 ALB, GLU, TP, IP, NEFA의 경우 대조구과 처리구간의 차이는 나타나지 않은 것으로 볼 때 생균제의 급여가 혈청 내 생리활성화 물질들에 많은 영향을 미치지 않은 것으로 보여진다.
LPS challenge
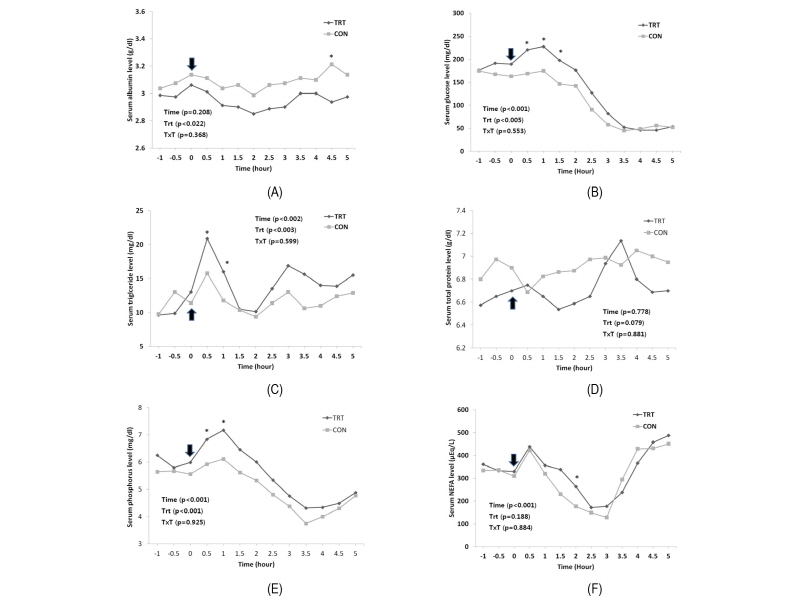
6개월 사양시험 후 18개월령 16두를 이용하여 2회에 걸쳐 LPS challenge를 시행하였고, 혈액 내 생리대사물질은 Fig. 1 , 혈구분석 결과는 Fig. 2와 Fig. 3에 나타내었다.
혈중 ALB는 사람의 경우 병적인 상태에서 감소하는 것으로 알려져 있으며, 각종 질환의 지침으로 가치가 있다고 알려져 있다(Choi et al., 2003). 본 실험에서는 LPS 주입 후 적은 수치로 감소하였다가 2시간 이후부터는 증가하는 경향을 보였지만 유의적인 차이는 나타나지 않았다(p > 0.05). 또한 LPS 주입 후 수치가 상승하는 것으로 볼 때 병적인 상태가 유발된 것을 확인 할 수 있었고, 또한 실험시간 동안에 대조구가 처리구에 비해서 높게 나타났다(p < 0.05). 혈중 ALB농도는 처리구와 시간의 상관관계가 없는 것으로 보아 LPS에 의한 병적상태 유발시 크게 차이가 나타나지는 않는 것으로 보인다.
혈중 GLU는 사람에게서는 대사에 이상을 일으키는 질환의 진단 및 치료 경과의 관찰에 쓰이고 있다(Park et al., 2001). 또한 스트레스가 발생하였을 때 스트레스 호르몬인 cortisol과 함께 민감하게 반응하는 지표 물질로 알려져 있고, 선행연구에 의하면 소의 운송기간 중 발생하는 스트레스의 생리적 지표로 가장 일반적으로 사용된다고 알려져 있다(Knowles et al., 1999; Broom, 2003; Tadich et al., 2005; Lopez et al., 2006; Averos et al., 2008). LPS 주입 후 상승하였다가 감소하였고 2시간 이후부터는 처리전과 비교하여 낮은 수치를 유지하는 결과를 나타내었다(p > 0.05). LPS에 의한 혈중 GLU의 반응은 처리 후 1시간 후에 가장 높은 수치를 나타냈고 이후 점차 감소하여 2시간 이후에는 원래 농도로 회복하는 경향을 나타내었다. 또한 혈중 GLU의 수치가 생균제를 급여한 처리구에서 대조구 보다 높게 나타난 것으로 볼 때 처리구에서 스트레스에 민감하게 반응하는 것을 확인 할 수 있었다. 선행연구에 의하면 ZH를 급여한 처리구의 LPS를 처리한 후 GLU농도가 높게 나타난 것으로 보아 처리구별 영향에 의하여 혈중 GLU농도가 민감하게 반응하는 것으로 나타났다(Bernhard et al., 2012). 본 결과에서도 이와 유사한 경향으로 나타나는 것으로 보아 생균체 처리가 대조구와 비교하여 LPS처리후 체내의 GLU농도를 증가시킨다는 결론을 가질 수 있었다.
혈중 TG는 중성지방으로 사람에서는 혈관질환과 당뇨진단에 중요한 검사항목으로 알려졌다(Park et al., 2006). 본 실험에서는 LPS처리 30분후에 수치가 급격하게 상승하였으며 곧바로 다시 감소하는 경향이 나타났고, 선행연구에서도 일정한 시간 동안에 LPS에 노출된 미경산우에서 TG의 농도가 수치적으로 확연히 감소하는 것을 확인 할 수 있었다(Steiger et al., 1999).
본 연구에 의한 혈중 TG의 변화를 비교하여 봤을 때 처리구가 대조구에 비하여 유의적으로 높게 나타났다(p < 0.05). 이러한 결과는 생균제의 급여가 LPS에 노출되었을 때 혈중 TG농도를 높이는 것으로 보여진다.
혈중 TP은 총 단백질량을 나타내는 수치이며, 생체 내에서 일어나는 생리기능의 변화, 생체를 구성하는 조직 및 장기의 병변을 반영한다고 알려져 있다. 선행 연구에서는 TP를 조사하지 않았지만, 이번 실험에서 조사를 해본 결과 LPS 주입 후 처리구가 수치적으로 낮은 결과를 나타냈고, 유의적인 경향은 나타나지 않았다(p > 0.05). 다만 정반대의 결과를 나타낸 것으로 볼 때 생균제의 급여가 혈중 TP 농도에 영향을 미치는 것으로 보인다.
혈중 IP의 경우에는 수치적으로는 LPS주입 후 조금 상승하였다가 천천히 감소하는 경향을 나타냈고, 유의적 차이는 나타나지 않았다(p > 0.05). IP는 무기인으로 각종 대사과정에 중요한 역할을 담당한다고 알려져 있다. 본 실험에서는 LPS 주입 후에 대조구와 처리구 모두 수치적으로 상승한 후에 시간에 지남에 따라 감소하였고, LPS 주입 3.5시간 후부터는 모두 상승하는 경향을 나타냈다. 이번 실험을 통해서 병적상태에서 면역이 상승함에 따라 IP의 수치도 변하는 것을 확인 했다.
혈중 NEFA의 경우에는 전체적으로 LPS주입 직후 상승하였다가 급격한 감소 후 다시 상승하는 경향을 나타냈다. NEFA는 유리지방산으로 ALB과 결합하여 말초조직의 에너지원으로 사용된다고 알려져 있고, 일반적으로 기아, 추위, 공포와 대사성 질병과 같은 병적상태가 유발될 때 NEFA의 농도가 높아진다고 보고되어 있다(Drackley, 1998). 선행연구 결과에서는 LPS 주입 후에 병적상태로 들어감에 따라서 수치적으로 상승하는 경향을 보였고(Bernhard et al., 2012; Waldron et al., 2003), 이번 실험에서도 LPS 주입 후 상승하는 경향이 나타났다. 대조구와 처리구 간의 유의적 차이는 나타나지 않았다(p > 0.05).
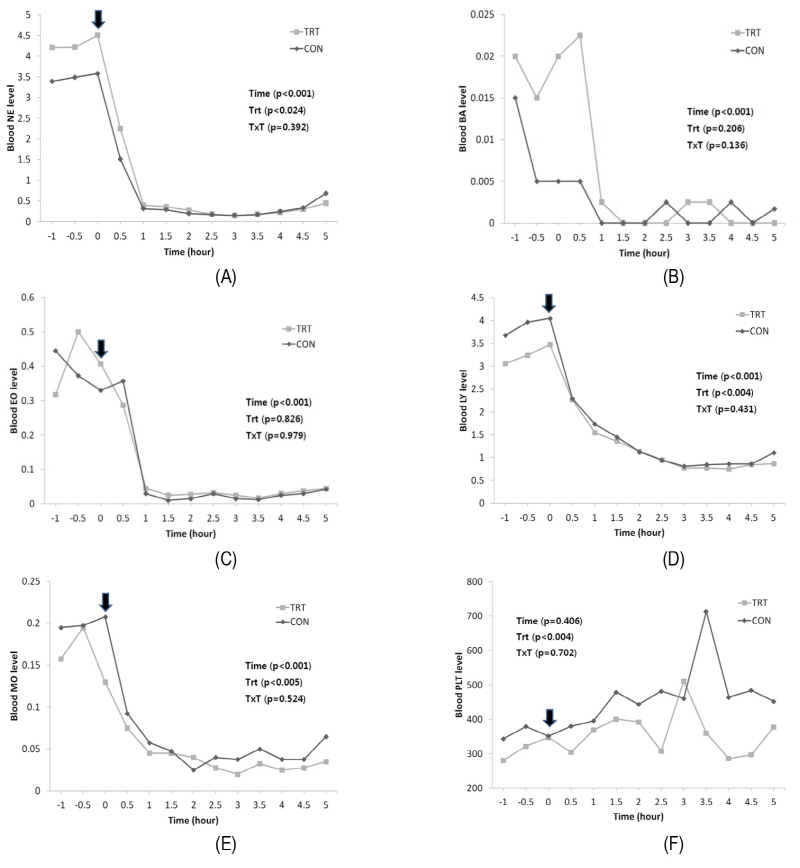
LPS challenge를 실시한 후 채혈한 혈액을 가지고 4시간 이내에 혈구 분석을 실시하였다. 크게는 백혈구 집단, 적혈구 집단, 혈소판으로 나누어진다. 먼저 백혈구 분석항목은 백혈구(WBC)를 포함 하여 호염구(BA), 호중구(NE), 호산구(EO), 림프구(LY), 단핵구(MO)가 있다. 적혈구 분석항목에는 적혈구(RBC)를 포함하여 혈색소(Hb), 평균 적혈구 혈색소(MCHC), 적혈구 용적(HCT), 평균 적혈구 용적(MCV), 평균 적혈구 농도(MCH), 적혈구 분포폭(RDW)로 나눠지고, 혈소판은 혈소판(PLT)과 평균 혈소판 용적(MPV)로 나뉜다.
백혈구는 혈액을 구성하는 세포 중 하나로서 식균 작용을 하여 우리 몸을 방어해 주는 일을 하는 혈구세포이다. 백혈구는 크게 과립구, 단구, 림프구로 나누어지고 과립구는 염색성에 따라서 다시 호중구, 호산구, 호염구로 나누어진다. 이중에 호중구는 백혈구의 60 - 70% (Bruce et al., 2002), 과립구의 90%를 차지하고, 주로 박테리아와 곰팡이에 작용한다고 알려져 있다. 또한 질병이 발생하였을 때 제일먼저 이동을 하고, cytokine을 발현하고 방출하여 다른 세포에 의해 염증반응이 증폭되게 하는 역할을 한다(Ear et al., 2008). 이번 실험에서는 LPS주입 후 호중구의 수치가 급격하게 감소하였고, 대조구와 처리구 사이에 유의적 차이는 나타나지 않았다(p > 0.05). 이러한 반응으로 볼 때 질병이 유발되었음을 확인할 수 있었다. 하지만 선행연구에서는 LPS challenge를 할 때 혈구분석을 실시하지 않았지만, 위의 결과를 볼 때 분석의 가치가 있을 것으로 보여 진다. 호염구, 호산구, 림프구, 단핵구 또한 LPS주입 후 급격하게 수치가 감소하였으며, 대조구와 처리구 사이에 유의적 차이는 나타나지 않았다(p < 0.05).
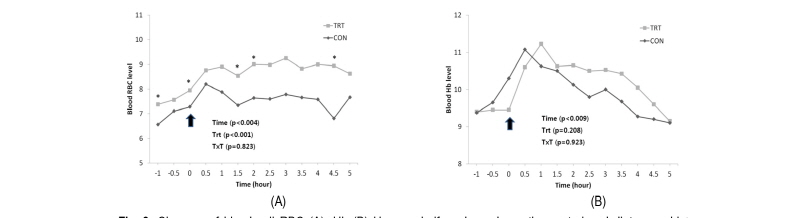
적혈구는 혈액 세포 중에서 수적으로 가장 큰 비중을 차지하는 세포로 주된 역할은 혈관을 통해 신체 각 조직에 산소를 공급하고 이산화탄소를 제거하는 역할을 한다. 또한 적혈구는 헤모글로빈이라는 혈색소를 포함하고 있는데 이는 적혈구의 약 30%를 차지하고 있으며 철을 함유하고 있어 적혈구가 붉은색으로 보이게 한다. 이번 실험에서는 LPS주입 후 적혈구는 완만하게 증가하는 수치가 나타났고, 주입 후 1.5시간, 2시간, 4.5시간에서 유의적 차이가 나타났다(p < 0.05). 또한 대조구에 비해 처리구에서 수치적으로 높게 나타났다. 혈색소는 LPS주입 후 대조구와 처리구 모두 증가는 영향이 나타났고, 시간에 따른 유의적 차이도 나타났다(p < 0.05).
적혈구도 백혈구와 마찬가지로 선행연구에서는 다루지 않았던 항목이지만 LPS주입에 따른 변화가 나타난 것으로 볼 때 반복적인 실험을 통해서 결과를 수집할 필요성이 보여진다.
혈소판은 혈액 내에 존재하는 혈구의 일종으로 부착과 응집을 통하여서 지혈작용을 담당하는 물질이다. 이번 실험에서는 LPS주입 후 수치가 완만하게 증가하다가 대조구는 3.5시간 후, 처리구는 3시간 후에 가장 높은 수치를 나타낸 후 다시 감소하는 경향이 나타났다. 정확한 수치의 변화의 이유를 알기 위해서는 반복적인 실험이 필요 할 것으로 보여진다.
Conclusion
본 연구는 대추 부산물 유래 생균제를 첨가제로 급여 후 실험적인 기법인 LPS challenge를 이용하여 시험 축에게 인위적인 병적 상태를 유발한 뒤, 시간 경과에 따른 생리활성화 물질 및 혈구변화에 대해서 알아보고자 수행하였다. 본 실험에서 생리활성화 물질에서는 ALB, IP, NEFA의 수치가 상승하는 경향이 나타났고, GLU, TG의 경우에는 감소하는 경향이 나타났다. 혈구 분석에서는 LPS 주입 후 백혈구 집단이 크게 감소하는 경향을 나타냈고, 이런 것으로 볼 때 면역반응이 활발하게 일어나고 있음을 확인 할 수 있었다. 또한 생균제를 급여한 처리구에서 대조구에 비해 대사관련 인자들이 수치가 높게 나타나는 경향을 보였다. 앞으로 더 나은 항생제 대제 물질 개발을 위해서는 LPS의 농도나 처리구를 다양하게 하는 실험이 추가적으로 필요할 것으로 보여진다.