Introduction
항생제는 성장촉진 및 질병치료의 목적으로 널리 사용되어 왔으나 항생제의 체내 잔류문제로 사용이 금지되고 있다. EU연합에서는 2006년부터 동물사료 내 성장 촉진용 항생체 첨가를 전면 금지하였고, 국내에서도 2011년도부터 사료 내 첨가가 금지되었다. 따라서, 가축의 생산성을 개선시킬 수 있는 항생체 대체제에 대한 관심이 고조되었다(Altmeyer et al., 2014). 생균제
는 항생제 대체제 중 하나이며 살아있는 미생물을 지칭하고 급여 시 장내 미생물총 균형을 개선시키고 숙주에 긍정적인 영향을 미치는 보조사료 또는 사료첨가제로 분류된다(Fuller, 1989). 양돈사료 내 생균제의 첨가는 성장률, 사료효율 등 생산성 개선에 효과가 있다고 보고되고 있다(Min and Kim, 2002). 또한, 생균제를 활용한 발효산물들을 이용한 연구들도 수행되어 왔다. 자돈사료 내 손바닥선인장 열매발효물 첨가는 체중을 증가시키고(Park et al., 2004), 발효초유사료 급여는 증체량 개선 및 혈중 면역글로불린을 증가시켰다(Na et al., 2008). 제분공정에서 발생되는 밀기울은 생산량이 많으나 단백질함량이 낮고 섬유소함량이 높아 소화율이 좋지 않아 활용도가 낮지만 Aspergillus niger를 이용한 발효밀기울은 마우스의 체내 영양소대사에 긍정적인 영향을 미친다고 보고되었다(Kim and Han, 1970).
돼지에서 질병 또는 질환은 양돈산업에 심각한 손실을 야기한다. 특히, 분만 뒤 4주 전․후에 발생되는 질병은 자돈의 성장에 부정적인 영향을 미친다(Park et al., 2004). 이 시기의 자돈은 이유를 시작하여 모돈과의 격리, 돈방이동, 사료변화, 이복 자돈간 합사 등으로 인해 생애 중 스트레스를 가장 많이 받아 성장 및 면역적으로 부정적인 영향을 받는다(Campbell et al., 2013; Cho et al., 2016). 또한, 이유시기의 자돈은 초유에서 획득한 유즙면역의 대부분을 소진한 상태이며 영양소공급원이 모유에서 사료로 변경되는 과정에 대한 거부감으로 섭취량이 급감하여 위축이 발생하고 장관벽에 병원성 박테리아가 우점하게 되면서 영양소 소화 및 흡수저하가 발생해 경제적 손실이 일어난다(Silva et al., 2010; Park et al., 2016).
따라서, 본 연구는 생균제를 이용한 발효밀기울의 급여가 이유자돈의 생산성, 혈구조성 및 면역에 미치는 영향을 구명하고자 실시하였다.
Materials and Methods
공시동물 및 시험설계
3원교잡자돈(Landrace × Yorkshire × Duroc; initial body weight, 7.78 ± 0.04 kg) 36두를 공시동물로 사용하였다. 기초시험사료는 시판자돈사료를 이용하였고 영양소함량은 Table 1과 같다. 시험설계는 발효밀기울을 사료내 0.0, 0.5 및 1.0% 첨가하여 총 3처리구, 처리구 당 3반복, 반복 당 시험동물을 4두씩 평사에 배치하였다. 사양시험은 7주간 실시하였고 시험기간동안 공시동물은 사료와 물을 자유채식하였다.
발효밀기울제조
밀기울은 농협중앙회에서 구입해 사용하였으며 1 kg의 밀기울에 350 mL의 증류수 및 10 mL의 종균을 접종하고 균일하게 혼합하였다. 사용된 종균은 Lactobacillus plantarum M10과 Saccaromyces cerevisiae 배양액을 동량으로 혼합하여 사용하였다. 혼합된 밀기울은 air-tightly 용기에 밀봉하고 30℃에서 2일동안 배양한 후 사용하였다. 발효가 종료된 밀기울은 10.19 ± 0.27 log CFU/g의 Lactobacillus plantarum과 7.73 ± 0.38 log CFU/g의 Yeast를 포함하고 있는 것으로 분석되었다.
조사항목
체중은 시험개시일 및 종료일에 측정하였고, 일당증체량은 종료체중에서 개시체중을 뺀 후 사육기간으로 나누어 구하였으며 일당사료섭취량은 매주 사료급여 시 잔량을 측정하여 급여량에서 잔량을 뺀 후 사육일수로 나누어 계산하였다. 사료요구율은 일당사료섭취량을 일당증체량으로 나누어 산출하였다. 폐사율은 시험개시일 자돈수 대비 종료일 생존자돈수를 백분율로 나타냈다.
처리구 당 4두씩 임의로 선발하여 경정맥에서 혈액을 채취하였고 헤파린 처리 및 무처리 튜브에 각각 나누어 담았다. 헤파린 처리 튜브 내 혈액은 자동혈구분석기(Hemavet 950, Drew Scientific, USA)를 이용하여 백혈구계 혈구조성을 분석하였다. 무처리 진공튜브의 혈액은 2,000 × g, 4℃ 조건에서 15분간 원심분리하여 혈청을 분리하였다. 분리된 혈청은 면역글로불린 G (Immunoglobulin G, IgG) 함량분석을 위해 porcine IgG ELISA kit (E101-104, Bethyl Lab., USA)를 이용해 microplate reader (VersaMax, Molecular Devices, USA)로 측정하였다. 측정방법은 제조사에서 제공하는 방법에 의해 분석하였다.
통계처리
수집된 모든 결과는 SAS ver. 9.2. (SAS Institute, Carym NC, USA)를 이용해 분산분석을 실시하였고, 처리구간 유의적 차이는 Duncan’s multiple range test을 사용해 0.05 미만에서 인정하였다.
Results and Discussion
생산능력
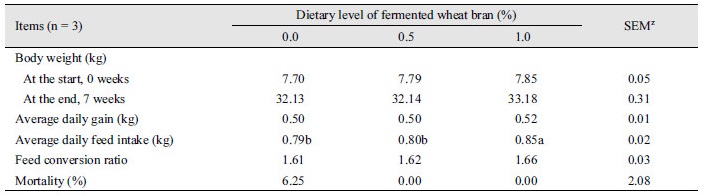
이유자돈에서 발효밀기율의 급여가 생산성에 미치는 영향은 Table 2에 나타냈다. 사양시험 종료 시 체중은 발효밀기울 1.0% 처리구에서 대조구 및 발효밀기울 0.5% 처리구보다 약 1 kg 증가했으나 처리구간 유의한 차이는 없다. 평균일당증체량은 발효밀기울 1.0% 처리구에서 다른 처리구에 비해 20 g 높게 계산되었다. 평균일당사료섭취량은 발효밀기울 1.0% 처리구에서 대조구 및 발효밀기울 0.5% 처리구보다 증가했다(p < 0.05). 그러나 사료요구율은 처리구간 차이를 보이지 않았다. 시험기간동안 폐사율은 대조구가 6.25%이고 발효밀기율 0.5 및 1.0% 처리구에서는 폐사가 발생하지 않았지만 처리구간 통계적인 차이는 없다.
선행연구들은 생균제 및 발효산물의 급여가 생산성을 개선시키는 것으로 보고하고 있다. 액상발효곡물사료 및 액상발효사료의 급여는 비발효사료에 비해 사료섭취량 또는 증체량이 증가되었다(Canibe and Jensen, 2007; Wang et al., 2014). 또한, 유산균 또는 복합생균제의 사료내 첨가는 이유자돈의 사료섭취량, 일당증체량 및 체중을 개선시켰다(Giang et al., 2011). 이러한 이전연구결과들은 본 연구의 일부 결과와 일치하였다. 특히, 사료섭취량증가는 발효과정 시 사료의 풍미를 증가시켜 기호성 향상에 의한 결과로 보인다(Canibe and Jensen, 2007). 그러나, 본 연구에서 체중 및 평균일당증체량은 처리구간 통계적인 차이를 보이지 않았는데 이는 이전 연구와 본 연구에서 사용된 발효에 사용된 균주 또는 발효방법의 차이로 판단된다. 자돈에서 이유는 폐사율과 정의 상관관계를 나타내는 것으로 알려져 있다(Pié et al., 2004). 하지만, 본 연구에서 폐사율은 대조구에서만 발생되어 발효밀기울의 급여가 폐사율 감소에 도움을 주는 것으로 나타났다. 따라서, 발효밀기울 급여는 이유자돈의 생산성에 부분적으로 긍정적인 영향을 미치는 것으로 사료된다.
혈액 내 백혈구계 혈구분석
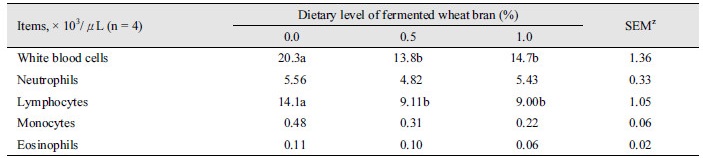
이유자돈에서 발효밀기울의 급여가 백혈구계 혈구들(leukocyte’s copuscles)에 미치는 영향은 Table 3과 같다. 혈중 백혈구(white blood cell)는 발효밀기울 0.5 및 1.0% 처리구에서 대조구에 비해 감소했다(p < 0.05). 림프구(lymphocyte)는 발효밀기울 0.5와 1.0% 처리구들에서 대조구보다 감소했다(p < 0.05). 호산구(eosinophil), 단핵구(monocyte), 호중구(neutrophil)는 발효밀기울 급여에 의한 변화를 나타내지 않았다.
혈구분석은 돼지의 건강상태를 나타내는 간접적인 지표로서 유용하게 활용되고 있다(Klem et al., 2010). 본 연구에서 백혈구 계 혈구분석은 Klem et al. (2010)이 제시한 reference range (15.6 - 38.9 ×103/μL)와 유사한 결과치를 나타났지만 발효밀기울의 급여는 박테리아 감염유무를 나타내는 백혈구를 감소시키는 것으로 분석되었다. 림프구는 스트레스 및 도축을 위한 stunning 등의 외부자극 시 감소하는 것으로 알려져 있다(McGlone et al., 1993; Okafor et al., 2013). 비록, 본 연구에서 발효밀기울 처리구의 림프구(9.00 - 9.11×103/μL)는 대조구(14.1 × 103/μL)에 비해 낮지만 이전 연구(Klem et al., 2010)의 reference range에 해당된다. 이러한 유의한 차이의 원인은 채혈 스트레스로 판단된다. 채혈을 위해 돼지보정을 선행하고 대조구에서 발효밀기울 처리구들로 순차적으로 혈액을 수집하였다. 이 과정에서 대조구의 공시동물보다 처리구들의 공시축이 보정에 의한 스트레스에 많이 노출되어 림프구의 수치가 감소한 것으로 보인다. 최근 연구에서 이유자돈에 발효유의 급여는 혈구조성에 변화를 야기하지 않아 발효물의 급여는 어떠한 부정적인 영향도 미치지 않는다고 보고했다(Song, 2017). 따라서, 본 연구에서 발효밀기울은 백혈구계 혈구조성의 큰 영향을 미치지 않은 것으로 사료되며 이는 이유자돈에서 발효밀기울의 급여가 부정적인 요인으로 작용하지 않음을 의미한다.
혈중 IgG 농도
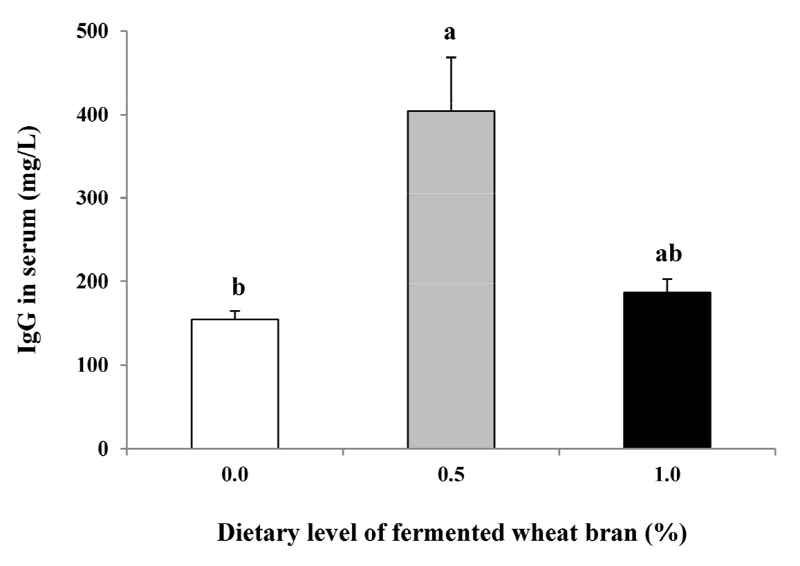
Fig. 1은 발효밀기울의 급여가 이유자돈의 혈청 내 IgG 농도에 미치는 영향을 나타냈다. 혈중 IgG는 발효밀기울 0.5% 처리구에서 대조구 및 발효밀기울 1.0% 처리구에 비해 통계적으로 증가했다(p < 0.05). 또한, 발효밀기울 1.0% 처리구도 대조구에 비해 수치적으로 높게 분석되었으나 처리구간 유의적인 차이는 관찰되지 않았다. 이전 연구자들(Hung et al., 2008; Na et al., 2008; Kumar et al., 2012; Park et al., 2013)은 생균제 또는 발효산물의 급여는 면역능에 긍정적인 영향을 미친다고 보고하여 본 연구결과와 유사하다. 반면에, 발효유의 급여는 혈중 IgG농도에 영향을 미치지 않았다(Song, 2017). 기존 연구들간 상반된 결과의 원인은 시험동물의 건강상태에 의한 영향일지도 모른다. 건강한 개체에 생균제는 면역에 영향을 미치지 않지만, 스트레스 및 외부독성자극동안 생균제의 급여는 체내 면역계를 활성화시켜 면역능이 개선되었다(Mishra et al., 2016). 하지만, 면역체계에 미치는 기전은 명확하게 밝혀진바 없다. 따라서, 추가연구로서 생균제 또는 발효산물이 체내 면역에 미치는 메커니즘 연구가 필요하다.