Introduction
이유 자돈은 돼지의 성장 단계 중 가장 민감한 시기 중 하나로 사양 환경의 변화, 병원성 미생물의 침입 등 다양한 스트레스를 받는 시기이다. 이유 자돈은 이러한 스트레스로 인해서 장내상피세포의 피해를 입게 되고 병원성 대장균에 감염되는 등의 피해를 입을 수 있다. 그 중 병원성 대장균에 의한 감염은 이유 자돈의 설사를 일으킬 수 있는 원인으로 작용하여 궁극적으로는
성장에 문제를 일으켜 양돈 농가들에게 경제적인 손실을 일으킨다(Marquardt et al., 1999; Owusu-Asiedu et al., 2002). 항생제는 이유 자돈의 설사를 예방함과 동기에 성장률을 향상시키는 부가적인 효과를 보이며, 이 때문에 양돈농가들은 항생제를 사용하여 이유 자돈의 설사를 해결하여 왔다. 하지만, 항생제의 무분별한 사용은 항생제 내성박테리아 출현 등 부작용을 일으킬 수 있다는 문제가 제기되었다(Heo et al., 2009). 이에 세계 여러나라들은 이를 해결하기 위하여 항생제의 사료 내 사용을 금지시켰으며, 과학자들은 이후 항생제 대체물질을 찾으려는 시도를 하고있다. 항생제 대체물질 관련하여 많은 연구가 진행되어왔으며, 현재는 probiotics, prebiotics, synbiotics, organic acids, zinc oxide, plant extracts and clay minerals 등의 대체물질이 각광을 받고 있다(Vondruskova et al., 2010; Lei et al., 2017).
뉴클레오타이드는 항생제 대체물질 중 하나로서, 효소 추출물, 모돈의 우유 등 단백질이 풍부한 원료 내에 주로 함유되어있는 성분이다. 뉴클레오타이드는 DNA와 RNA 분자로 구성되어있으며, adenosine 5’monophosphate (AMP), cytidine 5’monophosphate (CMP), guanosine 5’monophosphate (GMP), inosine 5’monophosphate (IMP), and uridine 5’monophosphate (UMP)의 5가지 종류가 있다(Sauer et al., 2011). 주로 세포의 분화, 성장, 대사, 에너지대사의 다양한 기능을 가지고 있어, 뉴클레오타이드는 사료 내에 첨가하였을 때 장내건강증진, 면역 강화 그리고 설사 예방 등 다양한 역할을 수행한다. 또한 뉴클레오타이드는 유아 시기에 급여 시 설사의 발생을 예방하였다는 보고가 있으며(Carver et al., 1991; Pickering et al., 1998), 이러한 보고는 뉴클레오타이드가 이유 자돈의 장내 건강 및 설사 예방에 효과가 있다는 주장에 근거가 되고있다. 뉴클레오타이드는 장내 발달, 유익균 발생, 면역 효과가 있다고 알려져 있으며(Sauer et al., 2012), 이는 산업적으로도 사료첨가제로서 양돈 농가들에게 도움을 줄 수 있다. 하지만, 뉴클레오타이드에 대한 연구는 충분히 이루어 지지 않고 있는 실정이고, 오직 몇몇 연구만이 그 영양적인 가치에 주목하였다. 그렇기 때문에 본 리뷰 논문은 뉴클레오타이드의 사료 내 항생제 대체 물질로서의 가치를 파악하고, 이 물질이 장내 구조와 기능, 미생물 그리고 면역적에 효과가 있는지 알아보기 위해 작성되었다.
Nutritional management of newly-weaned pigs
돼지는 모돈과 분리되고 이후에 이유 스트레스로 인하여 장내 건강이 악화되는 증상을 보인다(Lallès et al., 2007; Park et al., 2016; Balasubramanian et al., 2017). 이유 시기에 자돈들은 기존의 액상의 우유 대신 고형의 사료를 섭취하게 된다. 하지만 이유 직후의 자돈은 소화기관이 충분히 발달하지 않아 영양소의 소화가 이루어지지 못한다. 이로 인해 자돈은 설사가 발생하고 2차염증반응을 보이는 경우가 많으며, 이러한 증상들은 소장 내의 융모를 탈락시키고 소화효소의 활성을 저해한다(Pluske et al., 1997). 장 질환은 자돈 소화 능력의 발달을 저해하여 장내 병원성 박테리아를 증식시키고 면역 능력을 악화시킨다. 이러한 모든 이유 후 증상들은 궁극적으로 성장률의 저하로 이어지며 농가의 손해를 끼쳐왔다. 농가들은 항생제를 급여하여 문제점을 해결하고 성장 촉진의 효과 또한 얻어왔다(Cromwell, 2002). 그러나 무분별한 항생제의 사용은 항생제 내성 박테리아의 출현을 일으켜 부작용이 존재하였으며, 이로 인해 여러 나라들은 사료 내의 항생제 사용을 금지시켰다(Li et al., 2012). 이런 항생제 사용의 금지는 항생제 대체할 수 있는 적절한 물질을 찾는 연구를 촉진시켰으며, 현재 많은 연구자들은 사료 내 추가적인 물질을 급여하여 문제를 해결하려 하고있다. 최근에는 분무건조 돼지혈장, acidifiers, 고농도의 zinc와 copper salts, probiotics, essential oils, egg yolk antibodies, 허브와 향신료 등 여러 종류의 물질을 가지고 연구가 진행되고 있으며, 몇몇의 물질은 이유 스트레스를 줄이는데 효과를 보이고 있다. 하지만 대다수의 물질들은 제품으로 개발하여 실제로 적용하기에 어려움이 따른다(De Lange, 2010; Ding et al., 2011; Li et al., 2012; Thacker, 2013). 구체적으로 organic acid와 zinc oxide 급여는 이유자돈의 항생제 대체 물질로서 효과가 있다는 보고가 있지만, 이 물질들은 안전성이 검증되지 않았고 또한 환경오염의 우려도 존재하여 실질적으로 상용화로 이어지기는 어렵다. 정리하면, 항생제 급여가 금지된 이후 여러가지의 대체물질들이 개발되고 있지만, 이러한 개발은 여전히 실험적인 단계에 머물고 있어 상업적으로 발전하기에는 어려움이 따르고 있다. 그렇기 때문에 확실한 항생제 대체물질의 개발은 아직 미흡한 단계이다.
Biochemical characteristic of nucleotides
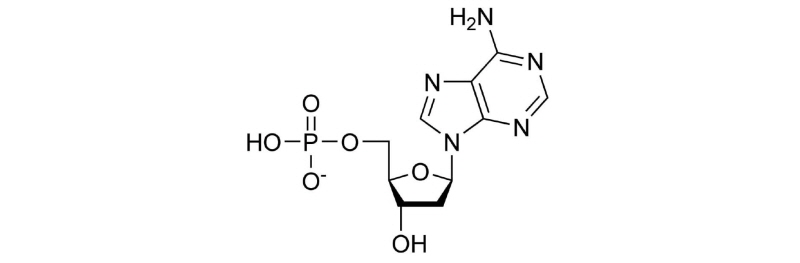
뉴클레오타이드는 DNA와 RNA 분자의 복합체로 이루어져 있으며 세포에서 흔히 관찰 가능하다. 뉴클레오타이드는 질소 염기, 당 그리고 하나 이상의 인으로 이루어져 있으며 퓨린, 피리미딘으로 나뉘게 된다. 자연상태에서 퓨린은 티민, 시스틴 그리고 우라실을 포함하며, 피리미딘은 구아닌, 크산틴 그리고 하이포크잔틴으로 구성되어있다(Henderson and Paterson, 2014) (Fig. 1). 또한 세포의 구조, 대사, 에너지 등의 활동에 관여하기 때문에 신체대사조절을 위해 필수적인 물질로 알려져 있다(Rudolph, 1994). 구체적으로 Carlson (2005)은 뉴클레오타이드의 급여가 돼지의 일당증체량을 높인다고 보고했고, Sauer (2012)의 실험도 뉴클레오타이드가 성장률의 감소 없이 IgA를 증가시킨다고 보고했다.
뉴클레오타이드는 신체 내 모든 조직에서 생성, 사멸을 반복하며(Uauy, 1989), 생성 기전은 de novo 합성, salvage 기전 그리고 사료를 통한 흡수의 세가지 경로를 통하여 진행된다(Sauer et el., 2011). de novo 합성은 에너지와 대사전구물질인 amino acid, ribose-5-phosphate, CO2, NH3를 재료로 mammalian 세포에서 진행된다(Chu, 1991). Salvage기전은 염기와 뉴클레오시드를 활용하는 기전으로 RNA와 DNA의 저감 시 이것을 재료로 일어나게 된다(Uauy, 1989). 때문에 salvage기전은 de novo합성에 비하여 에너지의 소모가 적고 생성 능력이 많은 것으로 알려져 있다(Cosgrove, 1998). 또한 salvage기전은 de novo합성에 비하여 90% 이상의 염기를 재활용 할 수 있는 장점 또한 가지고 있다(Uauy, 1989). 하지만 조직에 따라 de novo 혹은 salvage기전을 할 수 없는 조직이 존재하기 때문에 두 기전 모두 뉴클레오타이드의 합성에 필수적이다. 예를 들어 점막 세포, 골수 내의 조혈모세포, 백혈구, 적혈구 그리고 림프구 등은 de novo합성을 스스로 할 수 없어 뉴클레오타이드 합성을 salvage기전에 의존한다(Pearson and Gordon, 1985). 이러한 점에서 볼 때, 사료를 통한 뉴클레오타이드의 급여는 de novo합성에 비하여 에너지 소모가 적으면서도 신체 내의 염기를 제공하여 salvage기전을 증가시킬 수 있는 좋은 방법이라고 할 수 있다.
Source of dietary nucleotides
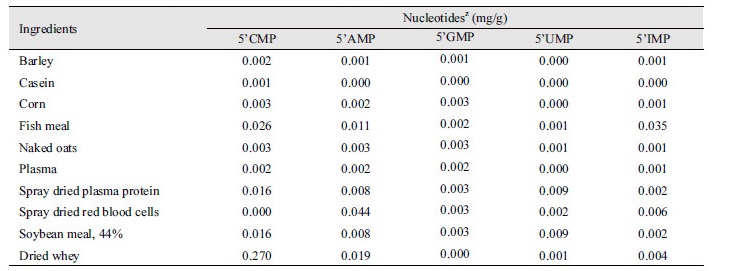
뉴클레오타이드는 DNA와 RNA의 복합체로 이루어져 있는 성분으로, 세포나 단백질이 풍부한 사료원재료에 많이 함유되어있다(Li, 2006). 구체적으로, 효모, 효모 추출물 그리고 우유에 뉴클레오타이드가 많이 함유되어있다(Table 1). Table 1은 사료에서 많이 쓰이는 Corn, Barley 보다는 우유, 효모에서 더욱 많은 뉴클레오타이드가 있다는 것을 보여준다(Gil and Sanchez-Medina, 1982; Ingledew, 1999). 연구자들은 뉴클레오타이드를 사료 내 배합 시 필수적인 부분이 아니라 이유, 병원균의 침입 그리고 성장촉진 시기 등 특수한 시기에 필수적으로 배합될 수 있는 원재료라고 이야기한다(Sauer et al., 2012).
자돈 들은 이유 전 단계까지 모돈의 초유와 우유를 통하여 뉴클레오타이드를 꾸준하게 섭취하고 이 뉴클레오타이드는 자돈의 대사 발달에 중요한 역할을 한다(Martinez-Puig et al., 2007). 하지만, 이유 후 자돈들은 뉴클레오타이드를 충분히 섭취할 수 없는데 그 이유는 뉴클레오타이드가 적게 함유된 옥수수-대두박 위주의 사료를 섭취하기 때문이다. 그렇게 때문에, 양돈농가들은 우유의 부산물이나 초유 그리고 효모제품들을 이용하여 자돈들에게 뉴클레오타이드를 섭취 시켜왔다. 그러나 우유 내 뉴클레오타이드의 농도와 조성은 축종과 수유 시기에 따라 차이가 있어 정확한 양을 급여하지 못하고 있는게 현실이다(Gil and Sanchez-Medina, 1981; Gil and Sanchez-Medina, 1982; Duchén and Thorell, 1999; Stein and Mateo, 2004).
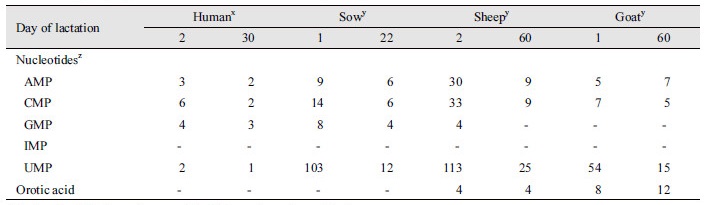
종에 따라 우유 내 뉴클레오타이드의 함유량은 차이가 있으며, 이러한 차이점은 축종에 따라 뉴클레오타이드 급여량이 달라져야 한다는 것을 보여준다(Sauer et al., 2011) (Table 2). Table 2는 우유 내 뉴클레오타이드의 조성과 농도가 사람, 모돈, 양 그리고 염소 등 종과 수유 시기에 따라 어떻게 달라지는지 비교하였다. 수유 시기에 따라서 비교한 결과, 초유 보다는 늦은 시기의 우유에서 UMP의 농도가 AMP와 GMP보다 높은 것을 알 수 있었다. 특히 모돈 내 UMP는 사람, 양 그리고 염소 우유 내의 UMP 보다 매우 높았으며 양의 우유에는 AMP와 CMP가 다른 종에 비하여 높은 것으로 나타났다.
결론적으로 Table 1과 Table 2의 결과는 뉴클레오타이드의 조성 및 농도는 사료의 재료, 축종 그리고 수유 시기에 따라 달라진다는 것을 알려준다. 이러한 점에서 볼 때 뉴클레오타이드의 요구량을 축종 및 성장 그리고 상태에 따라 설정하는 작업은 매우 중요하다고 할 수 있다. 하지만 축종에 따른 뉴클레오타이드의 조성을 분석하고 비교한 연구는 거의 진행되지 않았다. 그러므로 이유 자돈에게 적절한 뉴클레오타이드를 급여하기 위해서 이에 관한 데이터를 축적하고 비교 분석하는 연구가 선행되어야 한다.
Feeding value of dietary nucleotides
뉴클레오타이드는 비단백태질소화합물 중 하나로서 면역체계 활성화, 장내 성장과 발달, 지질 대사와 간 기능을 작동시켜 특정한 상황에서는 필수적인 영양 성분 중 하나이다(Johke, 1963; Carver and Walker, 1995). 그 이유는 뉴클에오타이드가 에너지와 아미노산을 재료로 신체 조직에서 합성이 가능하여 병원균의 침입, 성장 촉진, 면역 공백 등 특정한 상황을 제외하고는 신체 내 합성으로 사용이 가능하기 때문이다.
하지만 자돈의 이유와 같은 상황에서는 신체 내 뉴클레오타이드의 합성이 충분하지 않는데 이런 상황에서는 뉴클레오타이드가 필수적인 영양성분이 된다. 구체적으로 뉴클레오타이드의 급여는 설치류와 돼지가 스트레스를 받았을 때 면역기능, 혈액 성상 그리고 성장률에서 효과가 있는 것으로 나타났다(Novak et al., 1994; Ferreira et al., 2012; Sauer et al., 2012). 이는 이유자돈 또한 마찬가지로 이 시기의 자돈은 면역력이 약하고 병원성 박테리아의 침입이 쉬운 시기이기 때문에 많은 양의 뉴클레오타이드가 필요하다. 하지만 이유 자돈 시기의 뉴클레오타이드 요구량에 관련된 연구는 거의 진행되지 않아 정확한 양은 알지 못하고 있는 실정이다(Stein and Kil, 2006). 오직 이유 자돈 시기는 장 질환의 발생빈도가 높으며(Heo et al., 2009), 장내 조직이 회복하고 설사를 방지하는 이유 스트레스를 줄이기 위해서 많은 양의 뉴클레오타이드가 필요 할 것이라는 예측만 하고있다(Carver et al., 1991).
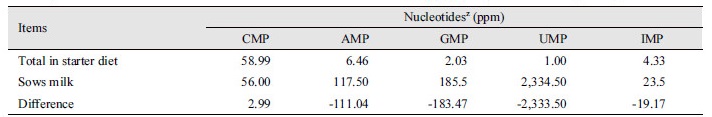
Stein and Mateo (2004)의 연구는 이유 자돈 시기에 뉴클레오타이드 요구량이 de novo합성양보다 많다는 것을 알려준다. 이러한 것은 Table 3 모돈의 우유 조성을 보면 알 수 있다(Table 3). Table 3에서 모돈은 AMP, GMP, UMP, IMP의 양이 많지만 상대적으로 CMP의 양이 적은 것을 알 수 있었다. 이러한 점에서 볼 때 이유 시기에 뉴클레오타이드를 사료에 첨가하는 것은 뉴클레오타이드 요구량을 맞추는 것과 동시에 부족한 CMP의 양을 채워줄 수 있는 장점이 있다. 게다가 추가적인 뉴클레오타이드의 급여는 이유스트레스를 극복하고 성장을 촉진하여 성장 촉진의 효과 또한 얻을 수 있다(Sauer et al., 2011). 이는 최근 연구에서도 나타났는데 뉴클레오타이드를 급여하였을 때 장내 Cl. perfringens, L. acidophilus 그리고 Bifidobacterium spp. 미생물을 감소시켜 장내 건강에 도움을 주어 성장을 촉진시킨다는 보고가 있다(Stein and Mateo, 2004).
뉴클레오타이드는 또한 순도가 높으며 생물적기능이 많다는 장점이 있다. 그 이유는 뉴클레오타이드는 효모 발효 추출로서, 펩타이드나 β–글루칸 복합체와 혼재되어 사용할 수 있는 장점이 있어 산업적으로 많은 활용이 가능하다(Sauer et al., 2011). 이런 장점들은 뉴클레오타이드가 양돈분야에서 항생제의 대체물질로서 실질적으로 활용이 가능하며 널리 연구되어야 하는 이유를 설명해준다. Lee et al. (2007)의 연구는 뉴클레오타이드와 organic acid를 같이 급여하였을 때, 장내의 Payer’s patch와 장간막 림프절의 림프구의 분화에 긍정적인 영향을 끼친다는 결과를 보였다. 또한 효모와 효모 추출물로 이루어져있는 뉴클레오타이드는 탄수화물의 β 1,3-glucans 과 mannan oligo polysaccharides라는 세포벽을 구성하는 성분으로 이루어져있다. 이 성분들은 신체 내에서 prebiotic으로 작용할 수 있으며(Lipke and Ovalle, 1998), 장관 조직의 발달과 면역체계를 자극하여 활성화하는데 도움을 주는 것으로 알려져 있다(Shen et al., 2009). 또한 최근의 연구는 뉴클레오타이드가 lactobacillus와 같은 장내 유익균의 발달을 돕는것과 동시에 mannose에 친화적인 병원성 박테리아가 장내 조직에 결합하는 것을 방해한다고 보고했다(Fairbrother et al., 2005). 뉴클레오타이드는 다른 탄수화물 소화효소와 결합하여 응용될 수 있으며, 같이 사용했을 때에 추가 효과 또한 얻을 수 있다(Kiarie et al., 2008). 즉 이유자돈시기에 사료를 통한 뉴클레오타이드의 급여는 이유스트레스를 줄이고 성장에 이로운 역할을 할 뿐 아니라 다른 성분들과 같이 급여 시 복합 상승효과 또한 얻을 수 있는 가치가 있다.
Growth and intestinal effect
최근 연구에 따르면, 뉴클레오타이드는 사멸과 발생이 빠르게 전환되는 장내 조직과 같은 부분에 많이 요구된다(Domeneghini et al., 2004; Mosenthin, 2012). 또한 자돈에게 0.05%의 뉴클레오타이드를 급여하였을 때 실험 첫주에 성장이 증가하였다는 보고도 존재한다(Domeneghini et al., 2004). Waititu et al. (2015)의 연구에 따르면 자돈에게 0.1%의 뉴클레오타이드를 급여하였을 때 항생제를 급여한 것과 비슷한 성장률을 보였다.
이는 장내건강에서도 마찬가지로 나타났는데 태아에서 뉴클레오타이드는 신체 내 장내 조직의 분화와 성장에 중요한 역할을 수행하는 것으로 알려져왔다(Carver and Walker, 1995). 또한 뉴클레오타이드를 함유한 사료를 급여하였을 경우 자돈 내 점막 단백질, DNA, 융모, 이당류의 활성 그리고 내부 손상 시 회복이 유의하게 증가하는 것을 볼 수 있었다(Domeneghini et al., 2006). 뉴클레오타이드가 장 건강에 효과가 있는 이유는 여러가지 효과가 있겠지만, 글루타민과 같이 점액겔을 두껍게 하여 장 보호에도 효과를 보이는 것으로 나타났으며(Domeneghini et al., 2004), 이유 후 고형 사료 소화능력부족으로 인한 융모의 탈락을 최소화 하는 효과도 있는 것으로 나타났다(Martinez-Puig et al., 2007). 또한 연구에서는 뉴클레오타이드가 장내건강을 증진시켜 설사를 유의적으로 감소시키는 것으로 나타났으며, 이 결과는 뉴클레오타이드가 이유 시기 혹은 스트레스로 인한 성장 저하 및 질병이 일어나는 현상이 발생하였을 대 효과적인 해결책이 될 수 있다는 것을 보여준다(Brunser et al., 1994; Adjei et al., 1995; Martinez-Puig et al., 2007).
Immunological effect
뉴클레오타이드의 많은 장점 중에서 특히 면역기능을 조절하고 활성화시키는 기능을 가지고 있는데 이는 자돈의 이유 후 면역 공백을 해결하기위한 방법으로 주목되어왔다. Wang et al. (2008)의 보고에 따르면 설치류에게 뉴클레오타이드를 급여하였을 때 흉선 세포의 손상이 감소한 것으로 나타났으며, 이는 뉴클레오타이드가 면역 기능을 향상시킨다는 증거 중 하나이다. Carver and Walker (1995)는 설치류에서 뉴클레오타이드의 결핍은 phagocytic 세포, natural killer 세포, macrophage, lymphokine 그리고 lymphocyte의 활성 및 생산을 감소한다고 보고하였다. 또한 뉴클레오타이드가 태아의 항체 반응을 향상시켜 감염이나 전염병에 대한 면역력을 향상시키고(Fanslow et al., 1998; Pickering et al., 1998), LPS가 감염된 송아지에게 급여 시 IgM이 증가하는 것으로 나타났다(Oliver et al., 2003). 이러한 연구결과들은 뉴클레오타이드가 면역세포의 손상을 회복시키는데 효과적이라는 것을 말해준다(Frankič et al., 2007). 뉴클레오타이드를 추가적으로 급여하면 세포의 증식과 면역체계의 발달까지 도울 수 있으며, 자돈의 림프구 증식에는 효과가 없었지만 IgA와 IgM등 면역조절물질의 분비는 향상되는 것을 알 수 있었다(Lee et al., 2007). 이 결과는 뉴클레오타이드가 림프구의 증식하여 급성 반응을 치료하는데 효과적이지 않을 수 있지만 다른 면역조절물질을 분비하고 손상된 세포를 치료하는데 효과가 있다는 것을 보여준다.
뉴클에오타이드가 면역활성화에 도움을 준다는 증거는 장내미생물의 조절에서도 나타난다. 예를들어, 뉴클레오타이드의 급여는 이유자돈의 장내 미생물 조성을 안정적으로 유지하는데 도움을 주는 것으로 나타났으며, 이는 장내 질병을 예방하는데 효과가 있는 것으로 나타났다(Andrés-Elias et al., 2007). 게다가, 뉴클레오타이드의 급여는 Lactobacilli와 Bifidobacteria의 성장에 도움을 주는데, 이 미생물의 증식은 병원성 박테리아의 증식을 억제하여 설사의 발생을 줄이는데 효과적이라고 알려져 있다(Tanaka et al., 1980). 최근의 연구에 따르면 뉴클레오타이드는 태아의 장내 미생물 조성에도 효과적이라고 나타났는데(Singhal et al., 2008), 구체적으로 뉴클레오타이드로 인한 Lactobacilli의 발달은 glycoprotein의 합성을 촉진시켜 장내 발달에 도움을 주는 것으로 나타났다(Pestova et al., 2000, Uauy et al., 1994). 이유 자돈 시기에는 위벽을 보호하고 장내 윤활제 역할을 하는 뮤신의 분비가 감소되는데(Liu and Sharom, 1997), 이러한 감소는 장내 Lactobacilli가 감소하여 나타나는 현상으로 알려져 있다. 그러므로 뉴클레오타이드의 급여는 면역반응을 조절하며 세포를 치료하는데 효과적일 뿐 아니라 미생물 조성을 안정시키고 유익균의 성장을 돕는 성분이라고 할 수 있다.
Conclusion
항생제 대체 물질로서 뉴클레오타이드는 성장률, 장내 형태 그리고 면역 반응에 효과가 있는 성분이라고 할 수 있다. 또한 사료로서 뉴클레오타이드는 평상시 돼지들이 성장하는 시기에는 필수적이지 않지만, 이유 시기, 병원성 미생물이 감염된 시기 그리고 성장이 빠르게 이루어지는 시기에는 필수적인 성분으로서 작용한다. 뉴클레오타이드는 우유, 초유, 효모, 그리고 효모 추출물 등 단백질이 풍부한 사료원재료에 많이 함유되어있다. 하지만 우유 내 뉴클레오타이드의 조성은 동물에 따라 매우 차이가 있으며 데이터 또한 제한적이다. 이러한 문제 때문에, 뉴클레오타이드의 양과 농도 그리고 이유 시기에서의 사용에 있어서는 차이점이 존재하여 왔다. 이러한 문제를 극복하기 위해서는 뉴클레오타이드의 농도 및 수준을 정확히 파악하고 기능과 기전 파악에 관한 더 많은 연구가 필수적이라고 할 수 있다.