Introduction
옥수수는 벼, 밀과 더불어 세계 3대 식량작물 중 하나이며, 우리나라에서의 재배 역사는 500여년 정도로 짧지만 다양한 쓰임새로 인하여 세계 경제에 대한 파급력은 매우 큰 작물이다(Lee et al., 2006). 고 에너지, 고 수확성 등의 많은 장점을 지닌 옥수수는 가축의 주 에너지 공급원으로서 가장 대표적인 원료이며, 배합사료의 50 - 70% 정도를 차지할 정도로 가축의 주 에너지 공급원으로 이용되고 있다(Lee et al., 2006; Siverson, 2013).
한편 우리나라는 세계 2위의 옥수수 수입국으로 국내 총 곡물 수입량의 약 45%인 9백여만 톤이 수입된다(AFRASY, 2016). 최근 수출국 생산지의 옥수수 작황, 기상상태, 곡물가격 변동성 등 여러 변수에 따라 수입선이 다변화 되고 있는데, 2013년도에는 미국의 corn belt지역의 극심한 가뭄으로 남미산이 주로 수입되었으며, 2014년에는 다시 미국산 비중이 높아지다가 2015년도에는 미국산 비중이 다시 낮아지고 있다(AFRASY, 2016). 우리나라의 미국산 옥수수 대체 수입국으로서는 주로 브라질, 아르헨티나, 우크라이나 등이다(Moon, 2014). 이와 같이 우리나라에서 옥수수는 가축사료 원료 중 사용비율이 가장 높고, 최근 옥수수의 원산지가 다변화된다는 것을 감안하면, 옥수수의 원산지별 품질은 국내 배합사료의 전체 품질에 직접적으로 영향을 준다고 추측할 수 있다. 또한, 원료 사료는 배합 시 사료의 소화율이나 영양소 이용성을 고려하지 않고 총에너지가나 화학적 분석치 만으로 사료를 제조하게 되면 영양소의 과부족 또는 과잉공급이 생기고 가축의 생산성이 저하하게 되거나 경제적으로 손실이 발생될 수 있다(Moon, 2014; Choi, 2015). 따라서 본 연구는 원산지별 옥수수의 반추위 이용률을 보다 정확하게 평가하여 경제적으로 가축의 요구량을 충족하고 생산성을 향상시킬 수 있는 기초 자료를 확보하고자 수행하였다.
Materials and Methods
Corn preparation
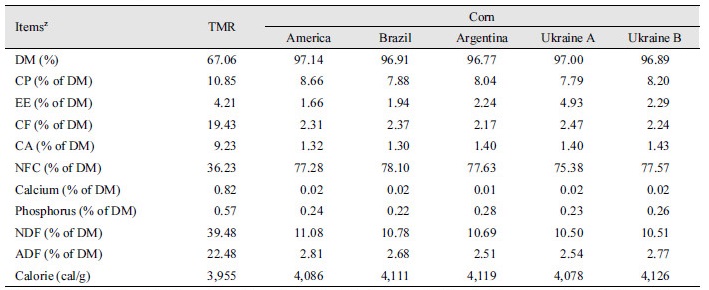
수입산 옥수수의 선발은 국내 사료회사의 옥수수 사료 수입국 결정이 옥수수 생산국의 작황상태에 따른 경제성이 고려됨을 감안하였으며, 또한 수입한 옥수수의 품질은 수송 모선별 차이가 날 수 있음을 반영하여 결정하였다. 시험사료로 사용된 원산지별 옥수수는 2015년 5월 국내 N사료회사로 수입된 4개국 총 5개 종류의 옥수수로써 미국산, 브라질산, 아르헨티나산, 우크라이나산(A), 우크라이나산(B)을 사용하였고, 우크라이나산 A 및 B는 수입된 선박에 따라 구분되었다. 시험에 이용된 기초사료 및 원산지별 옥수수의 건물, 조단백질, 조지방, 조회분, 칼슘 및 인 함량은 Choi (2015)에 설명한 바와 같이 분석하였으며, acid detergent fiber (ADF)와 neutral detergent fiber (NDF)는 Van Soest et al. (1991)의 방법에 준하여 분석하였다(Table 1). 공시재료는 60℃ dry oven에서 48시간 건조시켜 2 mm screen으로 분쇄 후 in vitro 배양에 사용하였다.
Rumen inoculum preparation and in vitro incubation
반추위액은 반추위 캐뉼라가 장착된 2두의 홀스타인 거세우(평균체중: 452 ± 42)로부터 채취하였다. 반추위액 공여축은 1일 2회 분할하여 섬유질배합사료(TMR)를 섭취하였고(Table 1), 물과 미네랄 블록은 자유 섭취토록 하였다. 반추위액은 오전 사료 급여 2시간 후에 반추위 캐뉼라를 통하여 4겹의 cheese cloth를 이용하여 사료입자를 제거하고 CO2 가스를 충진시킨 보온병(39℃)에 담아 채취된 위액이 외부온도에 따른 변화를 최소화하기 위하여 신속하게 실험실로 운반하였다. 완충용액은 McDougall (1948)의 방법으로 제조하였으며, 반추위액과 1 : 1의 비율로 혼합하여 CO2 가스를 주입하여 혐기상태를 유지하여 수행하였다. 시험구로써 첨가된 사료는 TMR 3.0 g (control), 미국산, 브라질산, 아르헨티나산, 우크라이나산 A 및 우크라이나산 B 옥수수 사료를 각각 3.0 g씩을 120 mL serum bottle에 넣고 혐기상태에서 rumen inoculum 25 mL을 주입하고 bottle은 butyl-rubber stopper와 aluminum cap으로 밀봉한 후 39℃로 설정된 항온교반기(SI-600R, Lab. companion, Seoul, Korea)에서 120 rpm으로 교반하면서 배양하였으며 배양시간은 0, 1, 3, 6, 12, 24, 48시간으로 하였다. 각 배양시간 경과 후 배양액의 시료를 채취하고 rumen fermentation parameter인 pH, 총가스발생량, 암모니아태 질소농도 및 휘발성지방산(VFA) 농도를 분석하여 원산지별 옥수수의 반추위 내 발효성상을 평가하였다.
In vitro rumen fermentation
각 배양 시간별 배양이 끝난 serum bottle을 incubator에서 꺼낸 후, Theodorou et al. (1994)의 방법으로 serum bottle의 head space에 있는 가스 발생량을 detachable pressure transducer 및 digital read-out voltmeter (Laurel Electronics, Inc., CA, USA)를 이용하여 측정하였다. 가스 발생량 측정 후, serum bottle의 aluminum cap 및 butyl rubber를 제거하고 배양액의 pH (Pinnacle M503, Corning, NY, USA)를 측정하였다. pH 측정 후 배양 상등액 1.5 mL을 micro tube에 채취하여 사료입자를 제거하기 위해 3,000 rpm에서 15분간 원심분리 하였다. 상등액을 0.20 µm syringe filter로 여과 후 HPLC를 이용하여 VFA를 분석하였다(Lee et al., 2016). 시료의 주입량은 20 µL였고, 이동상 용액은 0.0085 N H2SO4를 사용하였으며, 유속은 0.60 mL/min이었다. Column은 300 mm × 7.8 mm I.D. MetabCarb 87H (Varian, Palo Alto, CA, USA)를 이용하여 분석하였다. 암모니아 분석을 위해 1.5 mL micro tube에 미생물의 작용을 정지시키는 HgCl2 10 µL를 첨가하여 voltexing한 후 12,000 rpm에서 5분간 원심분리 후 상층액을 이용하여 분석하였다. 암모니아 분석은 Chaney and Marbach (1962)의 방법에 따라 phenol color reagent와 alkali-hypochlorite reagent로 배양액의 암모니아를 발색한 후 spectrophotometer (BIO-RAD, Model 680, CA, USA)를 이용하여 630 nm에서 optical density 값을 구하여 측정하였다.
통계분석
본 실험의 결과는 SAS package program의 일반선형모형 GLM procedure를 이용하여 분산분석을 시행하였고, 처리 평균 간 비교를 위하여 Duncan 다중비교 검정방법으로 95% 신뢰 수준에서 검증하였다(SAS, 2002).
발효 시간별 가스발생량은 Ørskov and McDonald (1979)의 모델 계수를 통해 effective gas production rate를 계산하였으며, 그 식은 다음과 같다. Gp = a + b (1 - exp-c × time), Gp는 시간 t에서의 가스발생량, a는 y축 절편의 계수인자, b는 잠재적 가스발생량, c는 시간당 가스발생량의 속도상수, time은 발효 시간을 나타낸다. 원산지별 옥수수의 effective gas production rate 데이터는 SAS package program (SAS Inst. Inc.)의 비선형회귀방정식 NLIN procedure와 Duncan 다중비교 검정방법으로 95% 신뢰 수준에서 검증하였다.
p>Results and Discussion
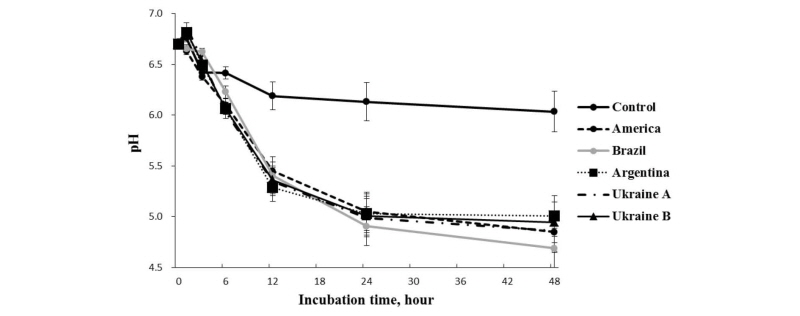
원산지별 옥수수 사료를 처리한 in vitro 반추위 발효실험에서 발효시간별 pH 변화는 Fig. 1과 같다. 발효 시간이 경과할수록 pH는 점점 낮아지고 있으며, 원산지 간 pH 변화의 차이는 비교적 크지 않았으며, 전체 평균값에 있어서도 원산지별 유의적인 차이는 보이지 않았다(p > 0.05). 다만, 24시간 이후의 in vitro 반추위 pH의 변화는 미국산 옥수수 처리구가 다른 처리구에 비하여 낮게(p < 0.05) 나타났다. 반추위내 적정 pH 수준은 약 7.0 - 6.0 정도로서 산성이나 염기성 어느 한 쪽으로 치우치게 되면 1위내 미생물의 활동에 영향을 미쳐 영양소의 소화에 부정적인 영향을 미친다(Mould et al., 1984). 원산지별 모든 옥수수에서 발효 12시간 이후에 pH가 6.0이하로 떨어져 발효에 의한 급격한 산 생성이 일어나고 있음을 알 수 있고, 사료 내 비섬유성탄수화물(non-fibrous carbohydrate, NFC)의 함량이 증가는 반추위내 전분의 급격한 발효로 인해 pH가 낮아지는 원인인 것으로 보고되어 있다(Valadares et al., 1999). 본 실험에서도 옥수수 처리구에 비해 대조구의 pH의 변화가 완만하게 감소하고 pH 6.0이상을 유지하는 가장 큰 이유는 원료사료내 NFC 함량의 영향이 큰 것으로 사료된다.
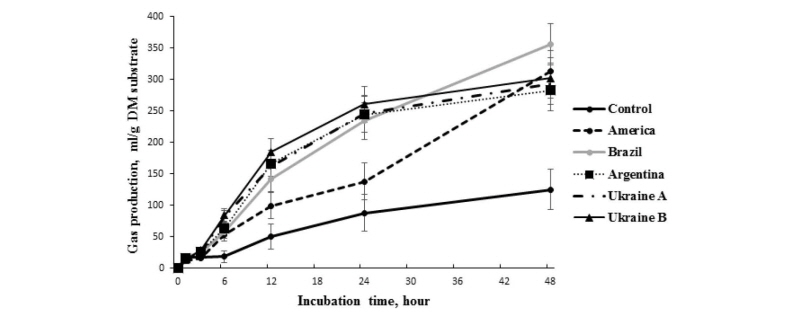
원산지별 옥수수 발효시간별 총가스발생량 변화는 Fig. 2와 같다. 발효 12시간과 24시간에서 미국산 옥수수의 가스발생량이 다른 원산지별 옥수수에 비하여 낮은 수치를 보였으며(p < 0.05), 발효 48시간에서는 브라질산 옥수수의 가스발생량이 가장 높은 수치를 보였다(p < 0.05). 또한, 원산지별 옥수수의 effective gas production rate는 미국산, 브라질산, 아르헨티나산, 우크라이나산 A, 우크라이나산 B가 각각 10.41, 17.63, 16.31, 16.69, 17.82%의 결과를 보였으며, 미국산 옥수수의 effective gas production rate의 값이 가장 낮게 나타났으며(p < 0.05), 다른 원산지별 옥수수에서는 유의적인 차이를 보이지 않았다. In vitro 반추위 발효에 있어서 가스발생량은 영양가의 평가에 유용하게 사용되는 결과 중 하나이며, 가스발생량 측정은 반추위에서 분해되는 또는 미분해되는 영양소의 소화동역학적인 결과의 해석에 하나의 중요한 자료로 활용된다(Sallam et al., 2007). 원산지별 옥수수의 가스발생량 데이터를 통해 계산된 반추위에서 분해되는 영양소는 미국산, 브라질산, 아르헨티나산, 우크라이나산 A, 우크라이나산 B가 각각 55.39, 40.11, 30.82, 31.90, 32.18%이었고, 미국산이 다른 옥수수에 비하여 반추위내에서 분해가능한 영양소를 많이 함유하고 있었다(p < 0.05). 브라질산 옥수수는 아르헨티나산, 우크라이나산 A와 B에 비하여 높은 경향을 보였다(0.05 < p < 0.1).
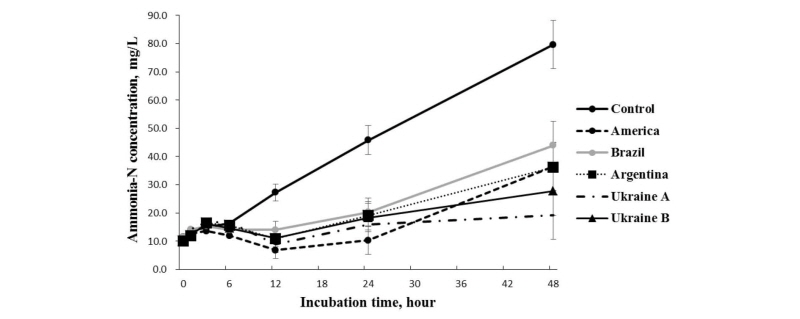
원산지별 옥수수 사료 발효시간별 암모니아태 질소농도의 변화는 Fig. 3과 같다. 발효시간이 경과할수록 옥수수 원산지별 암모니아태 질소 농도변화는 발효 24시간까지는 비교적 큰 변화는 없었다. 발효 48시간에서는 브라질산 옥수수가 가장 큰 농도를 나타낸 반면 우크라이나산 A가 가장 낮은 농도를 보였다(p < 0.05). 일반적으로 사료 내 조단백질의 함량에 따라 암모니아태 질소 농도가 일치하는 것으로 반추위내 미생물 활성의 증가로 인한 사료 단백질 분해의 증가가 암모니아태 질소 농가의 증가에 기인한다(Hristov et al., 2000). 반추위 분해단백질 및 미분해 단백질의 영향으로도 반추위 미생물체 단백질의 합성 및 이용에 영향을 미친다(Reynal and Broderick, 2005). 사료 내 반추위 미분해 단백질의 감소는 반추위에서 분해 가능한 단백질이 반추위 미생물에게 보다 많이 공급되어 반추위 암모니아태 질소의 농도를 증가시키며(Pina et al., 2009), 암모니아의 증가는 또한 미생물의 단백질원으로서 암모니아의 이용을 증가시킬 수 있다(Ma et al., 2013). 또한, 반추동물 사료원의 NFC 함량의 증가는 반추위 미생물체 단백질 합성을 향상시킬 수 있다(Ramos et al., 2009). 따라서 원산지별 옥수수 사료 내 NFC 함량에 따라 암모니아태 질소 농도가 일치하는 것은 반추위내 미생물 활성의 증가로 인한 사료 단백질분해가 증가하여 암모니아태 질소 농도가 증가하는 것으로 사료된다.
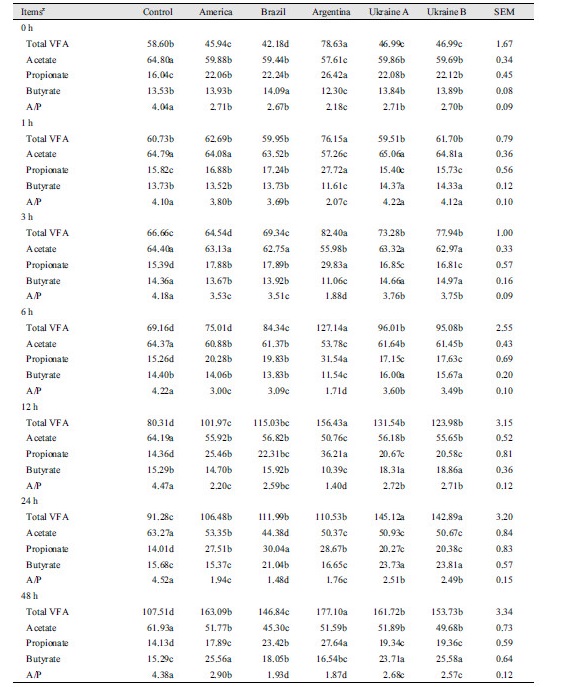
원산지별 옥수수 사료 발효시간별 휘발성지방산 농도의 변화는 Table 2와 같다. Total volatile fatty acid (total VFA) 및 propionate의 in vitro 반추위 발효 농도변화는 발효 24시간을 제외하고는 전 구간에서 아르헨티나산 옥수수가 가장 높은 농도를 보였다(p < 0.05). 반면 acetate 농도 변화는 발효 24시간과 48시간을 제외하고 전 구간 가장 낮은 수치를 보였고(p < 0.05), butyrate 농도변화는 48시간을 제외하고 전 구간 원산지별 옥수수 비교에서 아르헨티나산이 가장 낮은 수치를 보였다(p < 0.05). In vitro 반추위 발효 24시간과 48시간에서는 브라질산 옥수수의 acetate 농도가 원산지별 옥수수간의 비교에서 가장 낮게 나타났다(p < 0.05). 최근 수입산 옥수수의 원산지가 다변화 되고 있는 점을 고려하면(Moon, 2014), 본 연구 결과는 화학적 분석치가 비슷한 성분함량의 옥수수라 하더라도 반추위내 영양소의 분해 및 이용에 차이가 발생할 수 있음을 의미하는 결과이며, 옥수수는 배합사료 원료 중 사용비율이 가장 높은 원료인 점을 감안하면(Lee et al., 2006), 원산지별 옥수수의 반추위에서의 영양소 이용성이 고려된 결과를 활용한 사료배합이 이루어져야 될 것이며, 향후 본 연구의 결과는 사료 업체 또는 TMR 자가배합사료 제작 시 원가절감을 위한 유용한 자료로써 활용 가능성이 클 것으로 판단된다.
Conclusion
옥수수는 가축 배합사료의 주 에너지 공급원으로서 사용비율이 가장 높은 원료로서 옥수수의 품질은 곧 배합사료의 품질에 직접적으로 큰 영향을 미친다. 따라서 본 연구는 현재 수입되는 원산지가 다변화되고 있는 점을 고려하여 수입 원산지별 옥수수의 in vitro 사료가치 평가를 수행하였으며, 그 결과 원산지별 옥수수의 영양소 성분함량이 비슷하다 하더라도 반추위내 영양소의 분해 및 이용에 차이가 있음을 확인하였으며, 이는 가축의 생산성에 영향을 줄 수 있으므로 옥수수 선택 시 고려해야 할 조건이라 판단된다. 향후 정확한 자료 확보를 위해 생체 대사시험, 현장실증시험 등이 추가적으로 요구된다 할 것이다.