Introduction
작은뿌리파리(Bradysia difformis, fungus gnat)는 검정날개버섯파리과(Sciaridae)에 속하며 Diadocidiidae, Ditomyiidae, Keroplati-dae, Bolitophilidae, and Mycetophilidae 등의 작은 크기의 파리목에 속하는 그룹으로 전세계에 걸쳐 널리 분포하고 있는 것으로 알려져 있다(Hamlen and Mead, 1979; Jagdale et al., 2004; Vaughan et al., 2011). 작은뿌리파리는 주로 시설하우스내에서 발생하여 여러 작물에 피해를 주고 있으며(Harris et al., 1996), 특히 식물체의 뿌리가 생장하는 과정에 가해를 하여 뿌리를 자른다든가 혹은 상처를 주어 식물병원균에 의한 2차 감염으로 더 많은 피해를 주기도 한다(Wilkinson and Daugherty, 1970; Chambers et al. 1993; Cloyd, 2000). 특히 검정날개버섯파리과에 속하는 Bradysia속의 곤충은 온대와 열대 지역에서 버섯류와 토마토, 고추, 상치, 양파와 같은 과채류에 특히 많은 피해들이 보고되어 있다.
우리나라에서 작은뿌리파리는 1999년 경남 진주의 육묘장 내 수박 육묘에 발생하여 처음으로 보고되었다(Park et al., 1999). Lee et al. (2001)은 Bradysia spp.의 기주에 대해 보고하였는데 고추, 국화, 멜론, 수박, 토마토, 파프리카 등 21종에서 발생을 확인하였다. 특히 암면재배를 하는 시설하우스에 발생하여 토마토, 파프리카 등에서 발생할 시에 피해가 심한 것으로 보고되고 있다. 그리고 구근류나 뿌리를 이용하는 작물인 백합, 글리다올러스, 생강 등에서도 피해가 확인되었다. 이처럼 시설재배지의 과습한 환경이나 토양 중의 풍부한 유기물, 지제부에 대한 접근 용이성에 따라 버섯파리 밀도가 크게 늘어나 피해가 심해지게 된다(Lindquest et al., 1985; Roberts, 1992). 뿐만 아니라 다른 많은 작물에서도 작은뿌리파리 생육에 알맞은 환경이 조성되었을 경우에 대발생하여 심각한 해충으로 작용할 수 있다.
작은뿌리파리는 완전변태를 하는 파리목에 속하는 곤충으로 알과 유충, 번데기, 성충의 발육 단계를 거치면서 생장하게 된다(Fig. 1). 토양중의 유기물이나 식물의 잔재물을 주로 섭취하는 것으로 알려진 작은뿌리파리 유충은 난균, 자낭균, 담자균 등도 섭취하는 것으로 알려져 있다(Kennedy, 1974; Gardiner et al., 1990; Michael et al., 1998). 이러한 작은뿌리파리의 유충은 토양 중에서 살아있는 식물체의 작은 잔뿌리도 가해를 하게 되는데, 이러한 과정에서 식물이 식물병원성 미생물에 감염이 촉진되기도 하고, 뿌리 자체의 생육이 저하되기도 하여 식물의 생장에 나쁜 영향을 미치게 된다(Binns, 1973; Springer and Carlton, 1993; Jagdale et al., 2004). 작은뿌리파리는 유기물을 많이 사용하는 시설재배작물에서 토양 중에 모든 발육 단계가 함께 혼재하여 방제하기가 쉽지 않다(Jeon et al., 2007).
해충을 방제하기 위한 방법으로는 여러가지 방법을 사용할 수가 있다. 대표적인 방법이 살충제를 사용하는 화학적 방제 방법으로 가장 많이 사용되고 있으며, 현재에도 꾸준히 새로운 살충제들이 등록되고 있다(Min et al., 2017a, b). 뿐만 아니라 같은 살충제라 하더라도 살충제의 사용방법에 따라서도 살충 효과에 많은 차이를 보이는 만큼 살충제의 살포 방법을 개선함으로써 살충제의 사용량을 줄이고 최대한의 방제효과를 얻기 위한 방법 등이 연구되고 있다(Kim, et al., 2016; Kim et al., 2017). 그 이외에도 친환경적인 방법을 사용하는 생물학적 방제와 분자생물학적인 방법을 응용한 방법들이 시행되고 있다(Kwon et al., 2011; Kim et al., 2015; Ko and Youn, 2015). 현재까지 우리나라에서는 작은뿌리파리 방제를 위해서 주로 화학적방제를 주로 시행하고 있으며, 티아메톡삼 입상수화제, 테플루벤주론 액상수화제, 클로티아니딘 액상수화제, 클로르페나피르 액상수화제, 아세타미프리드 수화제 등 12종의 살충제가 고추, 착색단고추, 토마토, 파, 오이, 딸기에 등록되어 있다(KCPA, 2017). 반면에 많은 나라에서는 작은뿌리파리를 생물학적방제 방법을 포함한 환경친화적인 방법을 이용하여 방제하려는 노력이 수행되었다/ 예를 들어, 세균(Cloyd and Dickinson, 2006), 곰팡이(Huang et al., 1992; Andreadis et al., 2016), 포식성 응애(Ali et al., 1999; Freire et al., 2007), 포식성 곤충(Carney et al., 2002), 에센셜오일(Park et al., 2008; Erler et al.,2009), 곤충기생성 선충(Scheepmaker et al., 1998a; Scheepmaker et al., 1998b; Jagdale et al., 2004) 등을 들 수 있다.
본 연구에서는 작은뿌리파리에 대한 살충제의 효과를 조사하기 위하여 서로 다른 계통과 성분을 가진 살충제를 선발하여 총 20종류의 화학합성 살충제의 작은뿌리파리 유충에 대한 살충 활성을 조사하였다(Table 1). KCPA(2017)에 따른 각 약제별 특성을 알아보면, 클로르페나피르 액상수화제는 파이롤계 약제로서 접촉독 및 소화중독에 의한 에너지 대사를 저해함으로서 살충 효과를 보이고 있으며, 배를 포함한 30개 작물에, 꼬마배나무이를 포함한 28종의 해충에 등록되어 있고, 작은뿌리파리는 딸기, 착색단고추, 토마토에 등록되어 있다. 페나자퀸 액상수화제는 퀴나졸린계 약제로서 꿀벌이나 누에 등에 독성이 강하여 사용할 때에 주의를 해야 되는 약제로서 사과, 배, 포도, 수박 등에 발생하는 점박이응애, 사과응애를 방제하는데 등록이 되어 있다. 피리다벤 수화제는 피리다지논계 약제로서 감귤, 수박 등 11개 작물에 응애류와 가루이류를 방제하는데 등록이 되어 있다. 디플루벤주론 수화제는 벤조닐우레아계 약제로서 곤충의 탈피를 저해시키는 작용을 통하여 살충 효과를 나타내며, 사과를 포함한 11개 작물에, 잎말이나방을 포함한 14종의 해충에 등록이 되어 있고, 작은뿌리파리는 단고추를 포함한 고추에 등록되어 사용되고 있다. 엑토사졸 액상수화제는 옥사졸린계 약제로서 사과를 비롯한 16개의 작물에 사과응애를 비롯한 응애류를 방제하는데 등록되어 있다. 루페뉴론 유제는 벤지마이드계 약제로서 곤충 체벽의 키틴합성을 저해시켜 살충 효과를 나타내며, 배추를 비롯한 28개 작물에서 발생하는 파밤나방을 포함한 18종의 나방류에 등록이 되어 있으며, 딸기와 고추에 작은뿌리파리가 등록되어 있다. 스피로디클로펜 수화제는 테트로닉에시드계 화합물로서 주로 응애를 방제하기 위하여 사과를 포함한 20개 과수와 작물에 등록되어 있는 응애약제다. 스피로메시펜 액상수화제 역시 테트로닉에시드계통의 응애약제로서 사과를 포함한 21개의 작물에 등록되어 있지만, 스피로디클로펜과 마찬가지로 작은뿌리파리에는 등록되어 있지 않다. 테트로닉에시드계통의 응애약제는 주로 지방합성을 저해하는 것으로 알려져 있다.
|
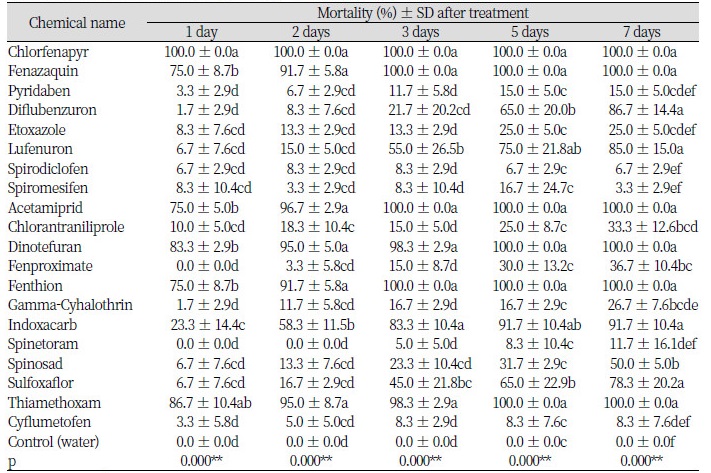
Table 1. List of 20 insecticides tested in this study 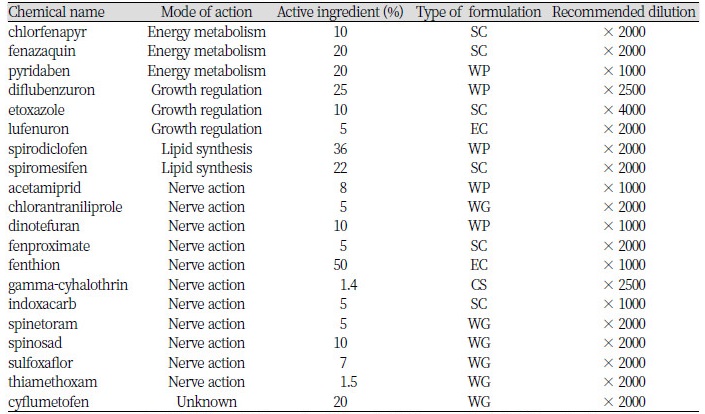
|
|
|
SC, suspension concentrated; WP, wettable powder; EC, emulsifiable concentrated; WG, water dispersible granule; CS, capsule suspension. |
|
아세타미프리드 수화제는 클로로니코티닐계통의 살충제로 사과를 포함한 40개 작물에 등록되어 진딧물류와 나방류를 포함한 50여종의 해충에 등록되어 있고, 작은뿌리파리의 경우 딸기, 토마토, 착색단고추에 등록되어 있으며 곤충의 신경연접후세포에 작용하여 전신적인 경련과 마비증세를 일으켜 곤충을 죽게 한다. 클로란트라닐리프롤 입상수화제는 다이아마이드계통의 살충제로 곤충체내의 칼슘채널을 교란시켜 빠른 섭식저해 효과를 나타내어 살충시키는 약제로서 사과를 포함한 40개 작물에 등록되어 주로 20여종의 나방류 방제에 등록되어 있다. 디노테퓨란 수화제는 네오니코티노이드의 3세대 계통인 후라니코티닐계 살충제로 니코틴형 아세틸콜린작용점에 작용하여 살충 효과를 보인다. 침투이행성이 뛰어나며 기존 유기인계, 카바메이트계, 합성피레스로이드계 등의 약제에 저항성이 생긴 해충에도 효과가 좋은 약제로 고추를 포함한 33개의 작물에 발생하는 진딧물류를 포함한 30여종의 해충에 등록되어 있으며, 작은뿌리파리는 딸기와 토마토에 등록되어 사용되고 있다. 펜피록시메이트 액상수화제는 페녹시피라졸계 응애약제로 응애 채내의 미토콘드리아에서 전자전달계에 영향을 주며, 응애의 알, 약충, 성충 등 모든 생육단계에 걸쳐 효과가 우수하여 사과를 포함한 18작물에 등록되어 주로 응애류의 방제에 사용하고 있다. 펜티온 유제는 유기인계통의 살충제로 신경연접후세포에서 아세틸콜린에스터레이즈 작용을 억제하여 살충 효과를 나타낸다. 주로 벼에 발생하는 이화명나방을 포함한 10종의 해충에 등록되어 있으며 조에 발생하는 애기노린재와 목재에 발생하는 미국흰불나방에 등록되어 사용되고 있다. 감마사이할로트린캡슐현탁제는 합성피레스로이드계통의 약제로 고추를 포함한 19개 작물에 등록되어 담배나방을 비롯한 20여종의 해충에 등록되어 사용되고 있는 약제이다. 인독사카브 액상수화제는 옥사디아진계통의 약제로 곤충 신경세포의 나트륨 전달을 막음으로써 신경전달을 차단하여 곤충을 치사시키는 약제로 배추를 포함한 23개 작물에 등록되어 배추좀나방을 비롯한 주로 나방류 해충에 적용되어 있다. 스피네토람 입상수화제는 주성분이 토양방선균에 의한 발효대사과정에서 생성되는 천연물질의 유도체로서 스피노신계 계통의 약제로 해충의 신경전달체계를 마비시켜 살충 효과를 나타내며, 배추를 비롯한 29개 작물에 등록되어 작은뿌리파리를 비롯한 30여종의 해충에 등록되어 있다. 스피노사드 입상수화제는 주성분은 토양방선균의 발효대사과정에서 생성되는 스피노신계 천연물질로 신경전달체계를 마비시켜 살충 효과를 나타내며, 오이를 포함한 25개 작물에 등록되어 목화바둑명나방을 포함한 20여종의 해충에 등록되어 있다. 설폭사플로르 입상수화제는 설폭시민계통의 약제로 곤충 중추신경계의 니코틴형 아세틸콜린작용점에 작용하여 살충 효과를 나타내며, 감귤을 포함한 18작목에 등록되어 조팝나무진딧물을 비롯한 20여 종의 해충에 등록되어 있다. 티아메톡삼 입상수화제는 치아니코티닐계통으로 니코틴형 아세틸콜린작용점에 작용하여 근육을 마비시켜 치사에 이르게 하며, 45개 작물에 등록되어 작은뿌리파리를 비롯한 50여 종의 해충에 등록되어 있다. 사이플루메토펜 액상수화제는 벤조일아세토니트로닐계통의 응애약제로 미토콘드리아의 대사를 억제함으로서 응애를 치사하게 하며, 감귤을 포함한 20종의 작물에 등록되어 귤응애를 포함한 응애류의 방제에 이용되고 있다.
본 연구는 작은뿌리파리에 대한 높은 살충 효과를 가진 화학합성 살충제를 탐색하고, 생물적 방제원으로써 Bacillus thuringiensis의 새로운 균주를 선발하여 작은뿌리파리 유충을 방제하는데 사용할 수 있는 기초적 자료를 제공하고자 실험을 수행하였다.
Materials and Methods
화학합성 살충제의 살충 효과
감자디스크를 이용한 살충 효과
20종의 각 약제는 희석배수에 해당하는 약량을 구한 후에 물 50 ml에 혼합하여 희석액을 조제하여 페트리디쉬(Φ 60 × 15 mm)에 여과지와 감자 절편(2 × 2 × 0.5 cm)을 깔고 spray tower (Burkard, UK)를 이용하여 1 ml를 살포한 후, 희석액이 고루 묻도록 감자 절편을 뒤집어 1 ml를 다시 한번 살포하였다. 약액이 충분히 마른 후에 알에서 깨어난 후 5일 된 작은뿌리파리 유충을 20마리씩 접종하였다. 무처리도 동시에 진행하였으며, 모든 처리는 3반복으로 실시하였다. 이후 온도 25 ± 1℃, 광주기 16L : 8D, 상대습도 50 - 60%의 조건에서 1, 2, 3, 5, 7일 후의 생존 개체수를 조사하여 사충률을 계산하였다.
포트에서 관주처리를 이용한 살충 효과
앞선 감자디스크 실험에서 높은 살충 활성을 보인 9종류의 화학합성 살충제를 관주처리하였을 경우, 살충 효과를 알아보기 위하여 딸기를 심은 포트에서 작은뿌리파리 유충에 대한 살충 활성을 조사하였다. 알에서 깨어난 후 5일 된 작은뿌리파리 유충을 각 포트에 50마리씩 접종하고 각 약제를 권장희석배수로 살포액을 조제하여 100 ml씩 근부관주 처리하였다. 그리고 황색끈끈이 트랩(5 × 5 cm)을 포트 표면 상하부에 각각 설치하여 약제 처리 후 7, 14일에 우화하여 황색끈끈이 트랩에 잡힌 성충 수를 조사하였다. 모든 처리는 3반복 처리하였고, 온도 25 ± 1℃, 광주기 16L : 8D, 상대습도 50 - 60%의 조건에서 실시하였다.
통계분석
모든 약제에 대한 살충효력실험 결과는 SPSS (SPSS Statistics 22.0, IBM, New York, USA) 일원배치분산분석(ONE way analysis of variance, ANOVA)을 통해 각 기록 결과 간 p < 0.05범위에서 유의성 검정을 수행하였으며, 사후검정은 Duncan분석을 통해 약제 간의 유의차를 확인하였다.
Bacillus thuringiensis (BT) 균주 선발
BT 균주 선발
국내 농작물 경작지와 산림, 밭 주변의 토양을 샘플링하여 하여 토양에서 분리한 16종류의 B. thuringiensis (BT) 균주의 작은뿌리파리에 대한 살충 효과를 검정하였다. 각 균주는 NA배지에 접종하고 5일 이상 배양한 후, 완전히 autolysis가 일어난 균체만을 긁어 모아 멸균수에 희석하여 107 cfu/ml 농도로 포자 및 내독소단백질 현탁액을 만들어 본 생물검정에 이용하였다. 각 페트리디쉬(Φ 60 × 15 mm)에 여과지와 감자 절편(2 × 2 × 0.5 cm)을 깔아두고 피펫을 이용하여 감자 앞 뒷면에 100 μl씩 고루 도포하였다. 균액이 충분히 마른 후, 작은뿌리파리 유충을 20 마리씩 접종하였으며, 무처리구와 함께 모든 처리구는 3반복으로 처리하였고, 온도 25 ± 1℃, 광주기 16L : 8D, 상대습도 50 - 60%의 조건에서 실시하였다. 균액 처리 후 1, 2, 3, 5, 7, 10일 후의 생충수를 조사하여 이 자료를 바탕으로 사충률을 계산하였다.
선발된 균주의 농도별 살충활성 검정
앞선 실험으로 선발된 살충 효과있는 균주의 반수치사약랑(LD50)값을 구하기 위해 희석약량을 작은뿌리파리 유충의 치사율이 0%에서 100% 되는 희석량까지 5 - 6개의 범위를 조사하였다. 모든 처리구는 작은뿌리파리 유충 20마리씩 6반복 실시하였다. 반수치사약량(LD50)값은 사충률을 구한 후 probit 계산법을 이용하여 PC프로그램으로 산출하였다(Raymond, 1985).
Results and Discussion
화학합성 살충제의 살충 효과
감자디스크를 이용한 방법
작은뿌리파리의 효과적인 방제를 위해 살충 활성이 높은 화학합성 살충제를 선별하기 위하여 본 실험을 진행하였다. 작은뿌리파리는 주로 토양에서 뿌리를 가해하기 때문에 직접적인 살충 효과를 검정하기 위하여 감자디스크를 이용한 방법으로 수행하였다. 20종의 살충제를 처리한 결과는 Table 2와 같다. 살충제를 처리한 후 1일이 경과한 후 90%이상의 높은 살충 효과를 보이는 살충제로는 chlorfenapyr가 100%의 살충률을 나타내어 가장 높았다. 2일이 경과한 후 살충 활성이 높은 살충제로는 fenazaquin, acetamiprid, dinotefuran, fenthion, thiamethoxam 등이 90% 이상의 살충 효과를 보였다. 이는 약제의 작용기작과는 크게 관계가 없이 살충 효과를 나타내고 있다. 약제 처리 1주일이 경과한 후에는 약제 처리 후 초반에 살충력이 높은 약제들이 100%의 살충 효과를 나타내었고, indoxacarb는 90% 이상의 살충 효과를 나타내었다. 반면에 pyridaben, etoxazole, spirodiclofen, spiromesifen, gamma-cyhalothrin, spinetoram, cyflumetofen 등의 약제는 30% 이하의 살충효과를 보였다.
포트 실험
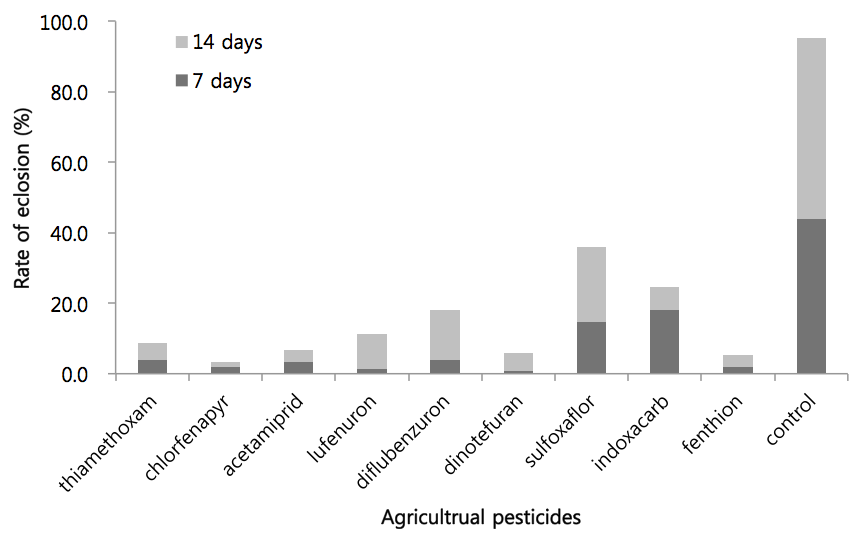
감자디스크 실험에서 높은 살충 활성을 보인 9종류의 화학합성 살충제를 관주처리하여 작은뿌리파리의 우화율을 관찰하였다(Fig. 2). 관주처리하였을 경우 살충 효과는 직접처리하였을 때 보다는 살충효과가 약간씩 감소하였다. 살충 효과가 가장 높게 나온 약제는 chlorfenapyr로 약제 처리 14일 후 성충으로의 우화율이 3.3%로 나타났으며, thiamethoxam, acetamiprid, dinotefuran, fenthion 등은 약제 처리 14일 후의 우화율이 10% 이하로 높은 살충 효과를 나타내었다. 반면에 lufenuron, diflubenzuron, sulfoxaflor, indoxacarb 등의 약제는 약제 처리 14일 후의 우화율이 25 - 35%로 살충효과가 떨어지는 것으로 나타났다. 무처리구의 경우에 관주 처리 14일 후의 우화율은 95.3%이었다.
곤충병원성 미생물의 선발
Bacillus thuringiensis 균주 선발
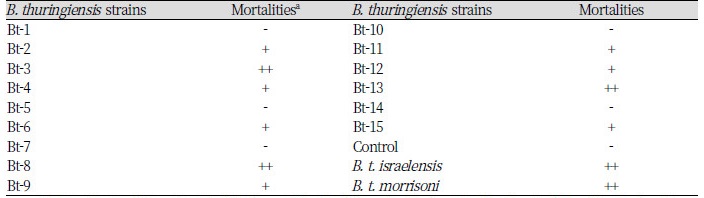
작은뿌리파리에 살충 효과를 나타내는 B. thuringiensis 균주를 선발하기 위하여 16개 균주를 감자디스크방법을 이용하여 살충력을 조사한 결과는 Table 3과 같다. 16개의 균주 중 Bt-3, Bt-8, Bt-13 균주가 70% 이상의 살충 효과를 나타내었으며, 대조균주로 사용된 B. thuringiensis subsp. israelensis와 B. thuringiensis subsp. morrisoni 균주와 유사한 살충 효과를 나타냈다. 또한 Bt-2, Bt-4, Bt-6, Bt-9, Bt-11, Bt-12, Bt-15 균주는 50 - 70%의 살충 효과를 보였다.
선발된 균주의 농도별 살충활성 검정
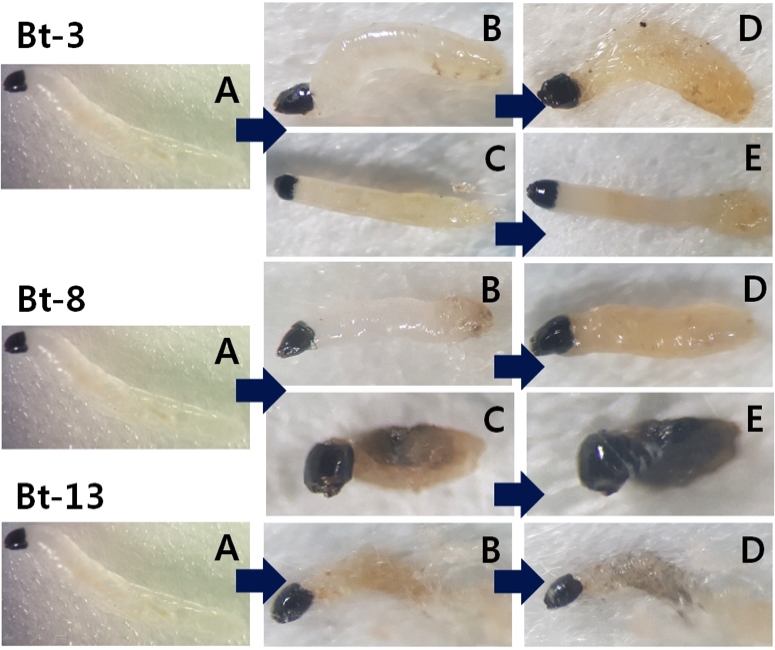
앞선 실험에서 일정 이상의 살충 효과를 나타내어 선발한 Bt-3와 Bt-8, Bt-13 균주를 감자디스크 방법을 사용하여 작은뿌리파리 유충에 대한 치사율이 0%에서 100% 되는 범위의 여러 단계의 희석배수를 처리하여 살충효과를 조사한 결과, 반수치사농도(LC50)와 95% 치사농도(LC95)는 Table 4와 같다. 작은뿌리파리에 병원성이 가장 뛰어났던 Bt-8의 LC50과 LC95값은 1.4 × 105, 1.1 × 107 cfu/ml이다. 다음으로 병원성이 높았던 Bt-13의 LC50과 LC95는 1.4 × 105, 1.3 × 107 cfu/ml이다. 마지막으로 Bt-3의 LC50과 LC95는 3.7 × 105, 4.7 × 108 cfu/ml로 Bt-8과 Bt-13 균주의 반수치사농도 보다 높았다). Fig. 3은 Bt-3와 Bt-8, Bt-13을 작은뿌리파리 유충에 같은 농도로 처리하였을 경우, 처리 2일과 5일 후 유충 상태로 감염되어 죽은 작은뿌리파리를 확인할 수 있다. 여기서 A는 감염되지 않은 작은뿌리파리 유충의 모습이고, B, C, D, E는 감염된 작은뿌리파리 유충의 모습으로 시간이 흐르면서 몸 전체가 검게 변하며 죽는 것을 확인할 수 있었다.
|
Table 4. Lethal concentration at 50 and 95% as determined by bioactivity of B. thuringiensis strain against Bradysia difformis 
|
시설재배지에서 발생하는 작은뿌리파리는 국내뿐만 아니라 전 세계적으로 다양한 작물에 발생하여 피해를 입힌다는 연구결과가 보고되어 있다. Harris et al. (1996)은 베고니아, 카네이션, 오이 등 54종류에 이르는 작은뿌리파리의 기주를 정리하였다. 이외에도 작은뿌리파리에 의한 실제 피해가 확인된 작물 외에 많은 식물을 가해할 것으로 예상되며 온실재배작물에서 연중 발생하여 큰 피해를 유발하는 주요해충으로 인식되고 있다(Harris et al., 1995). 이처럼 작은뿌리파리는 광범위한 기주를 가지고 있어 환경조건이 맞을 경우 어느 작물에서든 발생해 피해를 입힐 가능성이 크기 때문에 이에 따른 연구가 필요한 실정이다.
작은뿌리파리는 해를 거듭할수록 시설하우스나 육묘장에서 그 피해가 증가하고 있으며 피해 작물의 종류도 다양해져 시급한 방제기술 개발이 요구되고 있다(Kim et al., 2000). 효과가 확실하고 빠른 화학합성 살충제뿐만 아니라, 보다 안전한 천적과 병원성 미생물의 대체 이용 기술이 필요한데 미국과 유럽을 포함한 선진국에서는 포식성 응애류와 곤충병원성 선충, 세균 등이 실용화되어 있다. Gouge and Hague (1995)는 바늘꽃과 식물인 후크시아(fuchsia) 시설재배지의 B. paupera를 방제하기 위하여 곤충병원성 선충 Steinernema feltiae를 처리한 결과 성충을 92% 감소시켰다고 하였다. 그리고 Gillespie and Quiring (1990)은 토양서식성 포식성 응애인 Geolaeaps sp. nr. aculeifer를 방사하여 Bradysia 파리 유충과 성충 수를 10주 동안 성공적으로 감소시켰다고 하였다. 따라서 본 연구에서는 효과적인 방제법 개발을 위한 기초자료를 마련하고자, 작은뿌리파리 유충에 대한 화학합성 살충제 20종과 B. thuringiensis 16균주를 이용하여 작은뿌리파리에 대한 방제 효과를 알아본 결과, 화학합성 살충제들 가운데서 chlorfenapyr, thiamethoxam, acetamiprid, dinotefuran, fenthion과 BT 균주 가운데 Bt-3, Bt-8, Bt-13 균주가 방제효과가 높게 나타나 활용가능성이 높은 방제제로 확인되었다.
Conclusion
시설재배지에서 발생하는 작은뿌리파리는 전 세계적으로 다양한 작물에 발생하여 피해를 주고 있다. 국내에서는 딸기와 파프리카와 같은 시설 작물 재배지에서 피해가 확산되고 있어, 작은뿌리파리에 의한 실제 피해가 확인된 작물 외에 많은 식물을 가해할 것으로 예상되며 시설재배지에서 연중 발생하여 피해가 심한 해충으로 인식되고 있다. 본 연구에서는 작은뿌리파리를 효과적으로 방제할 수 있는 방제 방법을 알아보기 위하여 작은뿌리파리 유충에 대하여 감자디스크방법과 포트를 이용한 관주처리방법을 이용하여 화학합성 살충제 20종에 대한 살충 효과를 검정하였고, 감자디스크방법으로 B. thuringiensis 16균주의 방제 효과를 살펴보았다. 감자디스크를 이용한 작은뿌리파리 유충에 대한 살충효과에서 살충제를 처리한지 2일이 경과한 후 살충 활성이 높은 살충제로는 chlorfenapyr가 100%의 살충률을 나타내었고, fenazaquin, acetamiprid, dinotefuran, fenthion, thiamethoxam 등이 90% 이상의 살충 효과를 보였다. 관주 처리를 하였을 경우, 살충효과가 가장 높게 나온 약제는 chlorfenapyr로 약제 처리 14일 후 성충으로의 우화율이 3.3%로 나타났으며, thiamethoxam, acetamiprid, dinotefuran, fenthion 등은 약제 처리 14일 후의 우화율이 10% 이하로 높은 살충 효과를 나타내었다. 작은뿌리파리에 살충 효과를 나타내는 B. thuringiensis 균주를 선발하기 위하여 16개 균주를 감자디스크방법을 이용하여 살충력을 조사한 결과, 16개의 균주 중 Bt-3, Bt-8, Bt-13 균주가 70% 이상의 살충 효과를 나타내었으며, Bt-3과 Bt-8, Bt-13의 LC50과 LC95값은 각각 3.7 × 105, 4.7 × 108 cfu/ml, 1.4 × 105, 1.1 × 107 cfu/ml와 1.4 × 105, 1.3 × 107 cfu/ml이였다.