Introduction
초콜릿은 코코아 버터(Cocoa butter, CB)를 주원료로 하여 코코아 매스와 당류를 함께 적절히 배합하여 만든 가공식품으로 정의한다. 코코아 버터는 덥고 습한 열대우림 지역에서 자라는 벽오동과 목본식물 카카오(Theobroma cacao)의 종자에서 얻을 수 있다(Liendoa et al., 1997). 코코아 버터는 실온에서 굳은 상태로 존재하고 부러지기 쉬우나 체온에서는 급속히 녹는 예민한 융점을 갖는다. 이러한 특징은 코코아버터를 구성하는 triacylglycerol (TAG)의 지방산 조성이 palmitic acid 25 - 30%, stearic acid 31 - 37%, 그리고 oleic acid 31 - 38%의 단순한 지방산 조성으로 이루어져 있고(Spangenberg, 2001), TAG를 구성하는 지방산의 분포가 포화-불포화-포화(Saturated–Unsaturated–Saturated TAG, SUS-TAG)의 대칭형 구조를 갖기 때문이라고 알려져 있다(Salas et al., 2011). 하지만 코코아 버터는 원료의 공급이 불안정하다는 단점이 지적되어(Kang and Kim, 2010) 코코아 버터와 유사한 성질을 갖는 다양한 대체유지들이 개발되고 있다(Hyeon et al., 2013).
재구성 지질(Structured lipid)은 TAG의 지방산 조성과 그 위치를 고온과 고압 그리고 알칼리 금속 등에 의한 화학적 합성법을 이용하거나 lipase에 의한 효소적 합성법을 이용하여 재배치한 지방질을 의미한다(Iwasaki and Yamane, 2000). 화학적 합성법(Chemical interesterification, CIE)은 화학적 촉매를 사용하여 대량 생산이 용이하지만 반응에 고 에너지를 필요로 하고 부반응으로 부산물이 생기며 지방산을 무작위로 재배치하는 acyl migration을 촉진하는 것으로 알려져 있다(Macrae, 1983; Jennings et al., 2010). 이에 반해 효소적 합성법(Enzymatic interesterification, EIE)은 낮은 온도에서 반응이 이루어져 비교적으로 적은 에너지로도 합성이 가능하다는 점과 효소의 기질특이성을 이용하여 지방산을 원하는 위치에 선택적으로 재배치할 수 있기 때문에 산업적으로 널리 사용되고 있다(Lee and Akoh, 1996; Paiva et al., 2000). 최근 그 중요성이 부각되고 있는 고정화 효소(Immobilized enzyme)는 효소를 고분자 담체나 일정한 공간에 결합시킨 것을 말하며 효소의 반복적인 사용을 가능하게 하고 높은 온도에서도 효소의 활성을 발현시킬 수 있다는 장점이 있다(Soumanou and Bornscheuer, 2003). Acyl migration은 TAG를 구성하는 지방산의 무작위적인 이동으로 sn-1, 3에 위치한 지방산이 sn-2의 위치로 바뀌거나 sn-2에 위치한 지방산이 sn-1, 3의 위치로 이동하는 현상을 의미한다. 효소를 이용하여 지방산을 선택적으로 특정 결합 위치에 오도록 반응을 하고자 할 때는 acyl migration을 최소화 시켜야 하기 때문에, 이때 발생하는 acyl migration 반응은 문제점으로 지목되고 있으나 최근 acyl migration을 활용하는 연구도 진행되고 있다(Hyun and Lee, 2013). Palm oil은 지방산 조성이 palmitic acid가 약 45%이며, oleic acid가 약 40%를 차지하기 때문에 palm olein 및 palm stearin (PS) 등으로 분획하여 목적에 맞게 사용할 수 있다(Tan et al., 1981; Deffense, 1985; Hamm, 1995; Kamm et al., 2001). High oleic sunflower oil (HOSO)은 기존의 sunflower oil의 품종을 개량하여 생성된 유지를 말하며 oleic acid 함량이 80%를 초과하고 linoleic acid 함량이 10% 미만인 지방산 조성을 갖는 특징이 있다(Purdy, 1986).
반응표면분석(Response surface methodology, RSM)은 다양한 요인변수가 복합적으로 상호작용하여 반응변수에 영향을 미칠 때, 반응의 변화가 나타내는 반응표면상의 통계적 분석방법을 의미한다. 이를 이용하여 목적으로 하는 수치의 특정지점에서의 관계를 규명할 수 있어 최근 식품의 개발 및 제품 품질을 개선하고 제조 조건을 최적화하는 등 여러 분야에서 응용되고 있다(Lee et al., 2000).
본 연구에서는 palm stearin (PS)과 high oleic sunflower oil (HOSO)을 blending하여 Thermomyces languinosa lipase를 silica gel에 고정화한 lipozyme® TLIM을 이용하여 TAG와 TAG 간의 효소적 합성반응을 진행하였고 얻은 재구성 지질은 중심합성계획에 의한 반응표면분석법의 기질로 하여 반응시간, 반응온도, 효소 비율을 각각 설정하여 SUS-TAG에 적합한 최적의 합성 모델을 확립하고자 하였다.
Materials and Methods
재료 및 시약
본 실험에서 기질로 사용한 PS은 롯데중앙연구소(Seoul, Korea)에서 제공받았으며 HOSO은 CJ 사(Suwon, Korea)에서 제공받았다. Thermomyces languinosa에서 얻은 lipase를 silica에 고정화한 효소인 lipozyme® TLIM은 Novozymes (Bagsvaerd, Denmark)에서 구입하여 사용하였다. HPLC 분석과 GC 분석에 사용한 모든 용매는 HPLC grade 특급시약을 사용하였으며, 기기분석에 사용한 용매들을 제외한 모든 용매는 normal-grade 시약을 사용하였다.
과산화물가 측정
실험에 사용한 반응 기질인 PS와 HOSO의 과산화물가는 식품의약품안전처에 고시된 식품공전의 제 7 일반시험법(KFDA, 2016)에 따라 측정하였다. PS은 1.72 ± 0.02로 나타났으며 HOSO는 1.2 ± 0.14로 나타났다. 두 기질 모두 식품공전의 기준치에 부합하여 실험을 진행하였다.
Palm stearin 분별
PS의 고융점 분획물을 얻기 위하여 선행된 연구 방법에 따라 acetone을 이용한 분획을 진행하였다(Son et al., 2010). 2 L의 beaker에 완전하게 녹인 PS와 acetone을 1 : 9 (200 g : 1.8 L, w/v)의 비율로 혼합하여 투명해질 때까지 충분히 교반하였다. 이를 dry incubator (SI-900R, Jeio Tech, Daejeon, Korea)에 넣어 28℃에서 24시간 방치하였다. 분리된 액체층을 filter paper를 사용하여 분획하고 고체층을 완전하게 녹인 후 남아있는 acetone을 질소 가스로 휘발하여 제거함으로써 tripalmitin (PPP) 함량이 높은 PSFO을 얻었고 이를 재구성 지질 합성에 이용하였다.
RSM 조건 선정을 위한 재구성 지질 합성
PSFO와 HOSO의 무게비율과 반응시간을 다르게 적용하였을 때 효소적 interesterification 반응으로 생성되는 재구성 지질의 유형을 알아보기 위하여 선행된 연구방법(Cho et al., 2004)의 일부를 변형하여 실험하였다. PSFO와 HOSO을 1 : 0.5 (4 : 2 g), 1 : 0.66 (3 : 2 g), 1 : 1 (2 : 2 g), 1 : 2 (1 : 2 g)의 무게비율로 blending한 후 각각을 뚜껑이 장착된 50 mL 삼각플라스크에 취하였다. 반응효소인 lipozyme® TLIM을 기질 총량의 20 weight % 비율로 정량하여 각각 1200, 1000, 800, 및 600 mg을 삼각플라스크에 넣어준 후 shaking water bath에서 55℃, 220 rpm의 조건으로 6, 12, 그리고 18시간 동안 효소적 interesterification 반응을 진행하였다. 반응이 종료된 후 각각을 PTFE syringe filter (25 mm, 0.5 μm Whatman, Maidstone, Kent, UK)를 이용하여 여과한 후 냉동 보관하였다. Reversed-phased HPLC을 이용한 TAG 조성 분석 결과, 1 : 2의 비율에서 6시간 반응을 진행하여 얻은 재구성 지질이 SUS-TAG의 모델에 적합하다고 판단하여 반응표면분석(Response surface methodology)에 이용할 재구성 지질 반응물을 얻기 위하여 같은 조건으로 scaled-up하여 반응하였다. 50 g의 PSFO와 100 g의 HOSO을 1 : 2의 무게비율로 blending 한 후 뚜껑이 장착된 삼각플라스크에 넣어준 후 반응효소인 lipozyme® TLIM을 기질 총량의 20 weight % 비율인 30 g을 첨가하여 동일하게 실험을 진행하였다.
반응표면분석법 실험 설계
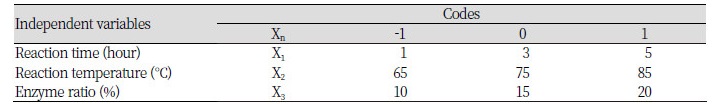
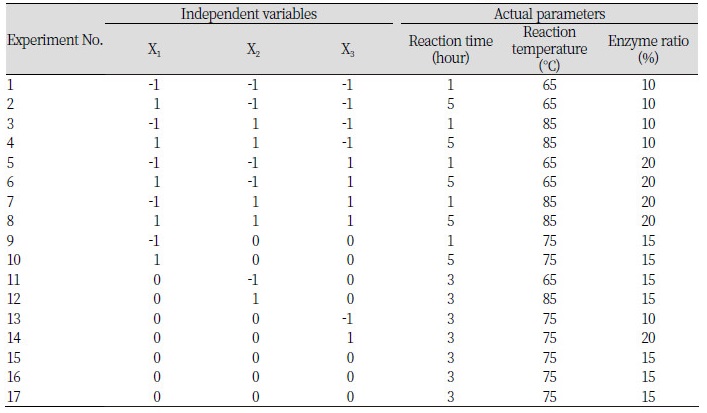
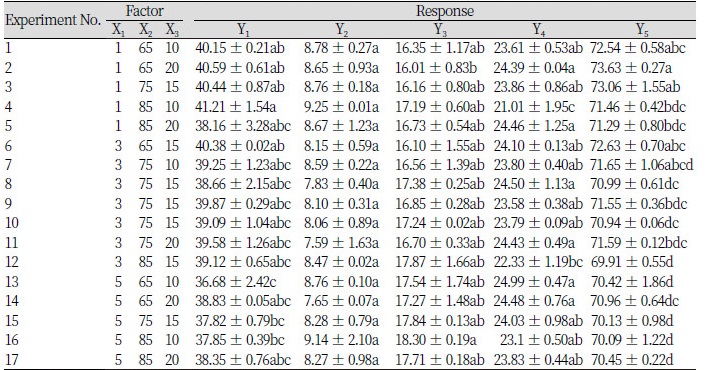
중심합성계획(Central composite face design, CCF)에 따른 반응표면분석법(Response surface methodology, RSM)을 이용하여 SUS-TAG 합성의 최적 조건과 TAG를 구성하는 지방산의 acyl migration 이동성을 관찰하기 위하여 선행된 연구의 일부를 변형하여 조건을 설정하였다(Shin et al., 2011). RSM은 Modde version 5.0 software (Umetrics, Umea, Sweden)을 이용하여 17개의 조건으로 실험을 설계하였고 각각의 조건에서 재구성 지질의 효소적 interesterification 반응을 진행하였다. 독립변수(Xn)로 반응시간(1, 3, 5 hours: X1), 반응온도(65, 75, 85℃: X2), 효소비율(10, 15, 20 weight %: X3)을 각각 3단계로 부호화하였고 이를 Table 1에 나타내었다. 종속변수(Yn)로는 SUU (Saturated–Unsaturated–Unsaturated, area %, Y1), SUS (Saturated–Unsaturated–Saturated, area %, Y2), SSU (Saturated–Saturated–Unsaturated, area %, Y3), UUU (Unsaturated–Unsaturated–Unsaturated, area %, Y4), sn-2 unsaturated fatty acid (area %, Y5)을 설정하였다. 17개의 조건에서 실험을 수행하였고 이를 Table 2에 나타내었다.
Reversed-phased HPLC를 이용한 TAG 분석
기질로 사용한 PSFO과 HOSO 그리고 효소적 합성으로 생성된 반응물인 재구성 지질들의 TAG 조성을 확인하기 위하여 reversed-phase high performance liquid chromatography (RP-HPLC, Younglin, Anyang, Korea)를 이용하여 분석하였다(Lee et al, 2002). Column은 Nova-pak® C18 column (60 Å, 3.9 mm × 150 mm, 4 μm, Waters, Milford, Ireland)을 사용하였고 detector는 Sedex 75 evaporative light scattering detector (ELSD, Dedere, Alfortville, France)를 사용하여 40℃, 2.2 bar의 조건으로 분석하였다. Pump는 SP930D dual pump (Younglin, Anyang, Korea)를 사용하였으며 분석 시료는 혼합용매(hexane : chloroform = 4 : 1, v/v)를 사용하여 1 μL/mL의 농도로 하여 20 μL를 injection 하였다. 이동상은 용매 A (acetonitrile)와 용매 B (iso-propanol : hexane = 2 : 1, v/v)를 유속 1 mL/min으로 설정하였다. 용매의 기울기 용리 조건으로 용매 A와 B를 80 : 20의 비율로 흘려주면서 45분까지 54 : 46의 비율로 변화시켜주고 15분간 유지하였으며 그 후 65분까지 80 : 20으로 변화시켜주고 이를 70분까지 유지하면서 분석을 완료하였다. 분석 결과는 chromatogram상의 TAG peak들을 partition number (PN) 계산식을 이용하여 peak area (%)로 나타내었다(Lee and Foglia, 2001).
PN = Total carbon number (CN) – 2 × Total number of double bonds (DB)
Ag-HPLC를 이용한 대칭형 TAG 분석
기질로 사용한 PSFO와 HOSO 그리고 효소적 interesterification 반응으로 생성된 재구성 지질들의 대칭형 TAG와 비대칭형 TAG 유형을 분석하기 위하여 Ag-HPLC (Younglin, Anyang, Korea)을 분석하였다(Hyun and Lee, 2013). Column은 Silver ion column (Chromspher 5 lipids 250 mm × 4.6 mm I.d., Varian, Netherlands)을 사용하였고 detector는 Sedex 75 evaporative light scattering detector (ELSD, Dedere, Alfortville, France)를 사용하여 40℃, 2.2 bar의 조건에서 분석하였다. 분석 시료는 혼합용매(hexane : chloroform = 4 : 1, v/v)를 사용하여 1 μL/mL의 농도로 만들어 20 μL를 injection 하였다. 이동상은 용매 A (hexane : iso-propanol : acetonitrile = 100 : 0.1 : 0.1, v/v/v)와 용매 B (hexane : iso-propanol : acetonitrile = 100 : 1 : 1, v/v/v)를 유속 1.5 mL/min으로 설정하여 흘려주었으며 기울기 용리 조건으로 용매 A와 B를 100 : 0으로 5분간 흘려주면서 50분까지 80 : 20으로 변화시켰다. 그 이후에 60분까지 50 : 50으로 흘려주면서 1분 동안 유지하였고 62분부터 70분까지 100 : 0으로 기울기를 변화시키면서 분석을 완료하였다.
GC를 이용한 fatty acid 조성 분석
기질로 사용한 PS, PSFO, HOSO 그리고 코코아 버터의 지방산 조성 및 함량을 확인하기 위하여 지방산을 methylation하여 fatty acid methyl esters (FAMEs)로 전환하였고 이를 gas chromatography (GC, Hewlett-Packard 6890, Avondale, PA, USA)를 이용하여 분석하였다(AOAC, 2012).
통계분석
HPLC 분석과 GC 분석의 결과는 2회 반복을 통하여 평균 ± 표준편차로 표기하였고, 결과의 유의적 차이 검증을 위하여 Statistical Analysis System (SAS) Computer Package version 9.4 software (SAS institute, Cary, North Carolina) 프로그램의 Duncan’s multiple range test를 통해 p < 0.05 수준으로 검증하였다(SAS, 2000).
Results and Discussion
지방산 조성 분석
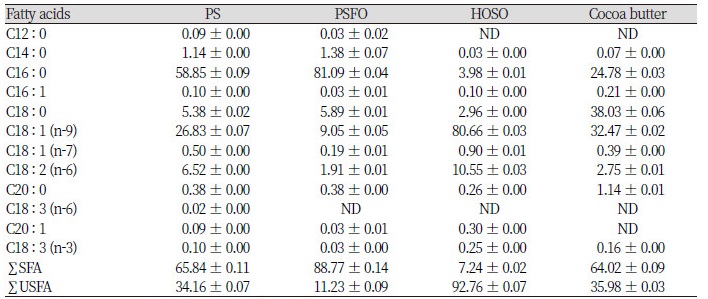
기질로 사용한 PS와 고융점 분획물인 PSFO 그리고 HOSO의 지방산 조성을 분석하고 최종 목표로 하는 코코아버터의 지방산 조성을 알아보기 위하여 GC 분석을 진행하였고 이들 결과를 Table 3에 나타내었다.
본 연구에서 사용된 PS에는 palmitic acid (C16 : 0), oleic acid (C18 : 1)가 각각 58.85, 26.83 area %로 검출되었으며 linoleic acid (C18 : 2)와 stearic acid (18 : 0)는 각각 6.52, 5.38 area %로 나타났다. 이에 대해 acetone을 이용한 분획을 거친 고융점을 가진 PSFO는 palmitic acid와 oleic acid가 각각 81.09, 9.05 area %로 검출되었으며 linoleic acid와 stearic acid는 각각 1.91, 5.89 area %로 나타났다. 이 결과는 Ghosh and Bhattacharyya (1997)의 선행연구인 acetone을 이용하여 분획한 PSFO의 지방산 조성이 palmitic acid 79.7 area %와 oleic acid 10.4 area %를 나타낸 결과와 유사하였다. 융점 차이로 인하여 PS의 TAG를 구성하는 palmitic acid와 stearic acid로 이루어진 고융점의 고체층이 oleic acid와 linoleic acid로 이루어진 저융점의 액체층과 분획되면서 PSFO는 palmitic acid의 밀도가 높은 지방산 조성을 갖게 되었다고 사료된다.
실험에 사용한 HOSO는 oleic acid가 80.66 area %, linoleic acid가 10.55 area %로 검출되었다. HOSO의 지방산 조성 결과는 Purdy (1986)가 선행 연구에서 제시한 oleic acid 81.6 area %와 linoleic acid 7.6 area %의 함량과 유사하였다.
Cocoa butter의 지방산 조성은 palmitic acid 24.78 area %, stearic acid 38.03 area %, oleic acid 32.47 area %로 나타났으며 이들 세 지방산의 총 함량은 95.28 area % 이었다. SUS-TAG 모델의 효소적 interesterification 반응에 사용한 기질인 PSFO와 HOSO은 각각 palmitic acid 81.09 area %와 oleic acid 80.66 area %를 함유하기 때문에 효소적 interesterification 반응으로 지방산의 위치가 재배치되는 위치 이동성 현상을 알아보는 데 있어 수월할 것이라 판단된다.
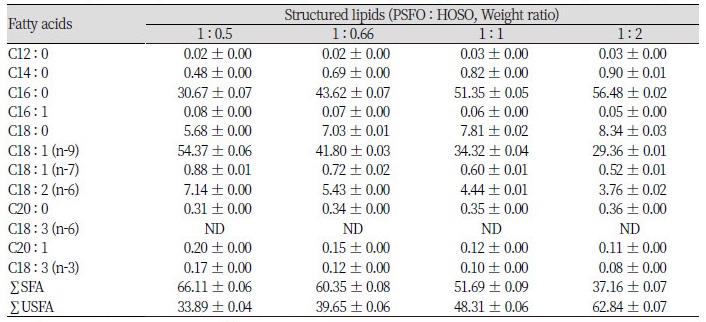
PSFO과 HOSO을 각각 1 : 0.5, 1 : 0.66, 1 : 1 및 1 : 2의 무게 비율로 blending하여 6시간 동안 lipozyme® TLIM을 이용해 효소적 interesterification 반응을 진행한 재구성 지질의 지방산 조성을 확인하기 위하여 GC 분석을 진행하였고 그 결과를 Table 4에 나타내었다. 기질을 blending한 각각의 비율에 따라 palmitic acid는 30.67 - 56.48 area %의 함량을 나타내었고, oleic acid는 29.36 - 54.37 area %의 함량을 나타내었으며, 두 지방산을 합한 총 함량은 85.04 - 87.67 area %로 나타났다. Stearic acid는 5.68 - 8.34 area %, linoleic acid는 3.76 - 7.14 area %로 나타나며 blending한 모든 비율조건에서 각각 10 area % 미만으로 존재하였다.
Reversed-phased HPLC를 이용한 TAG 조성 분석
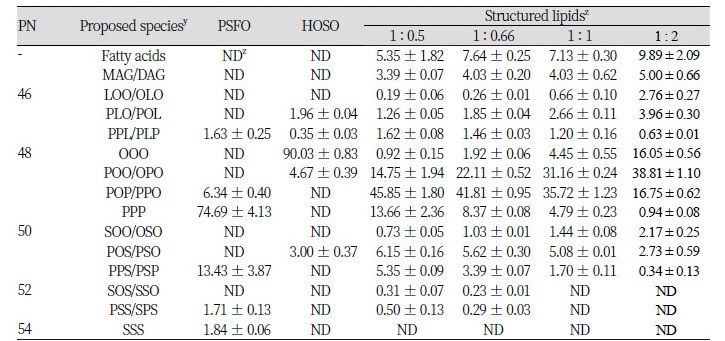
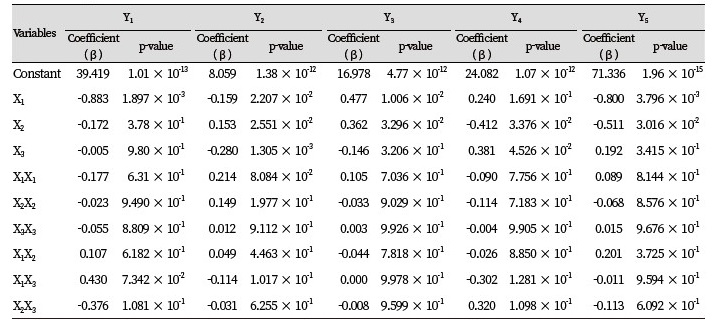
기질인 PSFO와 HOSO를 각각의 무게 비율로 blending하여 6시간 동안 효소적 interesterification 반응을 진행한 재구성 지질의 TAG 조성은 reversed-phased HPLC를 이용하여 분석하였고 PN을 계산하여 Table 5에 나타내었다. Reversed-phased HPLC로 분석한 기질들(PSFO과 HOSO)의 chromatogram 을 Fig. 1에 나타내었으며, 재구성 지질의 chromatogram 결과는 Fig. 2에 나타내었다.
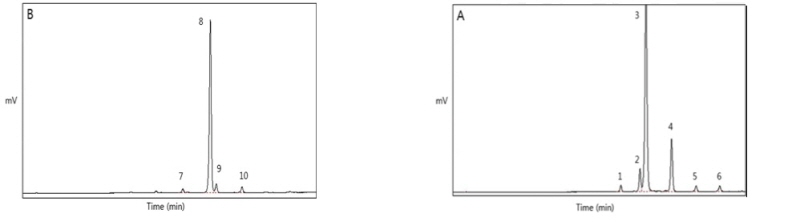
Fig. 1. Chromatogram of TAG species in substrates (A) PSFO and (B) HOSO analyzed by the reversed-phased HPLC. 1: PPL/PLP, 2: POP/PPO, 3: PPP, 4: PPS/PSP, 5: PSS/SPS, 6: SSS, 7: PLO/POL, 8: OOO, 9: POO/OPO, 10: POS/PSO. PSFO, palm stearin fraction oil; HOSO, high oleic sunflower oil; P, palmitic acid; S, stearic acid; O, oleic acid; L, linoleic acid.
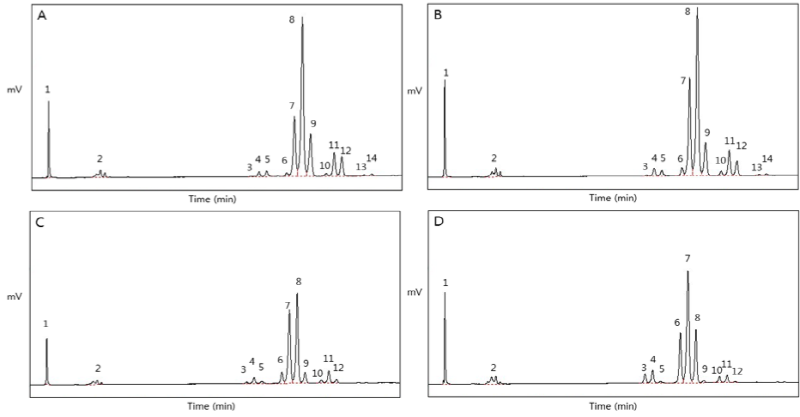
Fig. 2. Chromatogram of TAG species analyzed by reversed-phase HPLC in structured lipids synthesized with different weight ratios of substrates. Structured lipids were synthesized using 1 : 0.5 (A), 1 : 0.66 (B), 1 : 1 (C), and 1 : 2 (D) weight ratios of palm stearin fraction oil (PSFO) and high oleic sunflower oil (HOSO), respectively. 1: Fatty acid, 2: MAG/DAG, 3: LOO/OLO, 4: PLO/POL, 5: PPL/PLP, 6: OOO, 7: POO/OPO, 8: POP/PPO, 9: PPP, 10: SOO/OSO, 11: POS/PSO, 12: PPS/PSP, 13: SOS/SSO, 14: PSS/SPS. MAG, monoacylglycerol; DAG, diacylglycerol; P, palmitic acid; S, stearic acid; O, oleic acid; L, linoleic acid.
PSFO의 경우 PN 48이 81.03 area %로 구성되어 있었으며 그 중 74.69 area %의 PPP가 가장 많이 구성되어 있었다. 다음으로 PN 50을 갖는 PPS/PSP가 13.43 area %이었다. 이는 palm stearin의 분획과정에서 저융점의 oleic acid가 결합된 TAG가 acetone에 녹은 반면에 고융점인 palmitic acid와 stearic acid가 결합된 PPS/PSP가 결정화 되어 고체층에 남아있었기 때문이라고 사료되었다. 또한, 더 높은 고융점의 TAG를 갖는 PN 52와 PN 54도 각각 1.71과 1.84 area % 검출되었다. 유리지방산과 monoacylglycerol (MAG)과 diacylglycerol (DAG)은 검출되지 않은 것으로 보아 대부분의 지방산이 TAG 형태로 존재하는 것을 확인하였다.
HOSO의 경우에는 PN 48이 94.7 area %로 가장 많이 구성되어 있었으며 그 중에서 triolein (OOO)이 90.03 area %으로 가장 많았다. HOSO의 유리지방산과 MAG, DAG도 검출되지 않아 대부분의 지방산이 TAG 형태로 존재함을 확인하였다. 비율을 달리하여 효소적 interesterification 반응을 진행한 결과, 1 : 0.5의 비율에서 POP/PPO의 함량이 45.85 area %로 가장 많이 생성되었으며 POO/OPO가 14.75 area % 생성되었다. PSFO에서 가장 많이 검출되었던 PPP-TAG의 경우 13.66 area % 검출되었다. 1 : 0.66의 비율에서는 1 : 0.5 비율의 TAG 조성이 소폭 이동하며 POP/PPO가 41.81 area %, POO/OPO가 22.11 area % 검출되었으며 PPP는 8.37 area %로 감소하였다. 비율을 동일하게 한 1 : 1의 비율에서는 POP/PPO가 35.72 area %, POO/OPO가 31.16 area %로 비슷하게 검출되었으며 PPP는 4.79 area %, OOO는 4.45 area % 검출되었다. 1 : 2의 비율에서는 POO/OPO가 38.81 area %로 가장 많이 검출되었으며 POP/PPO는 16.75 area %로 나타났고 OOO는 16.05 area %, PPP는 0.94 area % 검출되었다. 비율을 다르게 한 4개의 반응에서 공통적으로 기존에 없었던 유리지방산과 MAG, DAG가 생성되었고 그 총량은 8.74 - 14.89 area %로 나타났으며 PN 48은 72.55 - 76.12 area %로 검출되었다. 이는 TLIM에 의한 interesterification 반응을 통해 TAG를 구성하고 있는 sn-1, 3위치의 지방산들이 일차적으로 DAG와 지방산으로 가수분해를 거친 후 이를 재구성하는 과정에서 MAG, DAG 그리고 지방산이 생성된 것으로 사료된다. 반응한 기질의 비가 2 배 차이가 날 경우에는 적은 양의 기질을 구성하고 있던 기존의 TAG 조성이 1 area % 이하로 나타난 것으로 보아 적은 양을 보유한 TAG가 interesterification 반응에 우선적으로 모두 반응하였다고 판단된다.
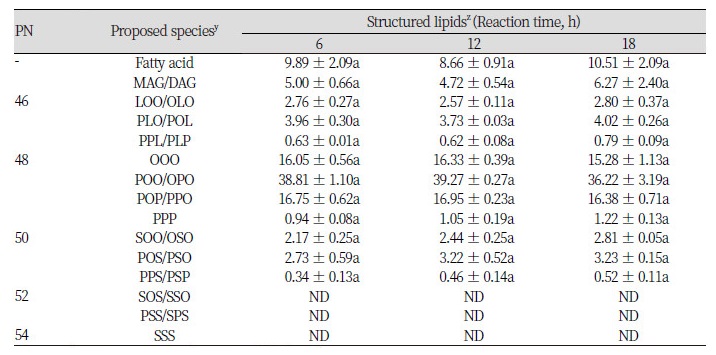
동일 비율에 대해서 반응시간을 달리하였을 때의 변화를 알아보고자 기질을 1 : 2의 무게비율로 blending한 후 6, 12 및 18시간에 대한 효소적 interesterification 반응을 진행하였고 TAG 조성의 reversed-phased HPLC 분석 결과를 Table 6에 나타내었으며 관련 chromatogram을 Fig. 3에 나타내었다.
Fig. 3. Chromatogram of TAG species analyzed by reversed-phase HPLC in structured lipids synthesized according to different reaction times. Reaction times: 6 hour (A), 12 hour (B), and 18 hour (C). Structured lipids were synthesized using 1 : 2 weight ratio of palm stearin fraction oil (PSFO) and high oleic sunflower oil (HOSO) as a substrate.. 1: Fatty acid, 2: MAG/DAG, 3: LOO/OLO, 4: PLO/POL, 5: PPL/PLP, 6: OOO, 7: POO/OPO, 8: POP/PPO, 9: PPP, 10: SOO/OSO, 11: POS/PSO, 12: PPS/PSP. MAG, monoacylglycerol; DAG, diacylglycerol; P, palmitic acid; S, stearic acid; O, oleic acid; L, linoleic acid.
1 : 2의 기질비율로 효소적 interesterification 수행한 반응물은 반응시간이 6 , 12 그리고 18시간까지 진행함에 따라 유리지방산, MAG, DAG 그리고 TAG의 조성들은 소폭 감소 및 증가하는 현상을 보였지만 유의적인 차이는 나타나지 않았다. 반응시간이 진행됨에 따라 효소활성이 감소하여 반응의 효과가 6시간 이후의 반응에서는 차이가 없다고 판단하여 RSM 합성반응의 기질로 6시간 반응을 거친 반응물을 기질로 이용하였다.
Ag-HPLC를 이용한 대칭형 TAG 조성 분석
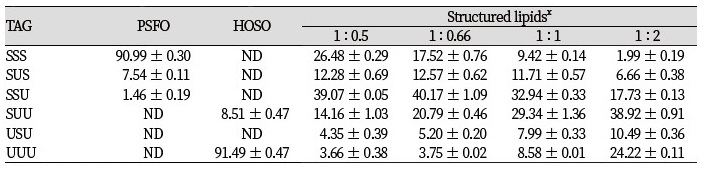
기질들(PSFO, HOSO)과 기질들을 1 : 0.5, 1 : 0.66, 1 : 1 및 1 : 2의 무게비율로 blending한 후 6시간 동안 효소적 interesterification 반응하여 합성한 재구성 지질들을 Ag-column이 장착된 HPLC로 분석하였고 그 결과를 Table 7에 나타내었다. 기질들에 대한 chromatogram과 재구성 지질에 대한 chromatogram을 각각 Fig. 4 와 Fig. 5에 나타내었다. Ag-HPLC는 포화지방산, 불포화지방산으로 구성된 TAG의 대칭형 TAG와 비대칭형 TAG의 분리가 가능하다. 반응 기질인 PSFO은 90.99 area %의 포화-포화-포화 TAG (SSS-TAG)가 검출되었고 7.54 area %의 SUS가 검출되었다. HOSO은 91.49 area %가 불포화-불포화-불포화 TAG (UUU-TAG) 로 이루어져 있었고 8.51 area %의 SUU가 검출되었다. Reversed-phase HPLC 분석 결과와 Ag-HPLC 분석 결과를 종합하여 보면 PSFO는 74.69 area %의 PPP와 15 area %의 PPS/PSP로 이루어진 90.99 area %의 SSS-TAG 유지로 판단된다. HOSO는 91.49 area % 이상이 triolein으로 구성된 UUU-TAG 유지로 판단된다.
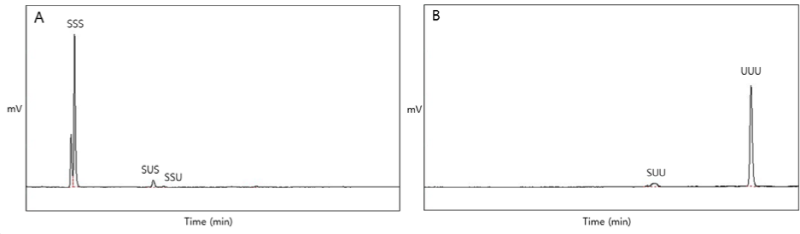
Fig. 4. Chromatograms of TAG types analyzed by the Ag-HPLC in substrates (A) PSFO and (B) HOSO. PSFO, palm stearin fraction oil; HOSO, high oleic sunflower oil; SSS, Saturated–Saturated–Saturated; SUS, Saturated–Unsaturated–Saturated; SSU, Saturated–Saturated–Unsaturated; SUU, Saturated–Unsaturated–Unsaturated; UUU, Unsaturated–Unsaturated–Unsaturated.
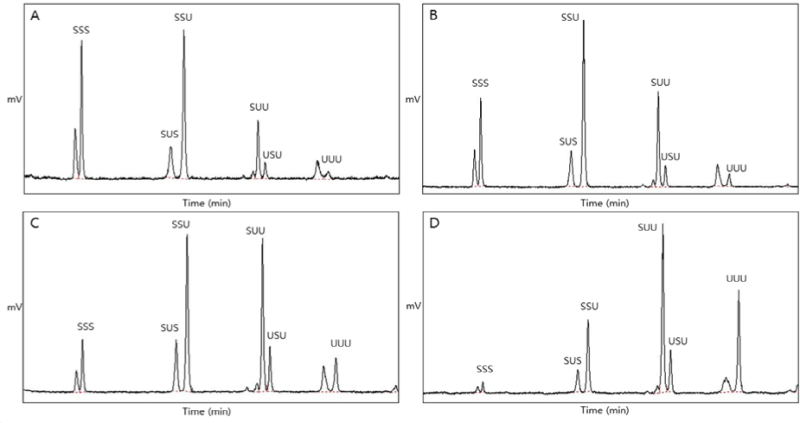
Fig. 5. Chromatograms of TAG types analyzed by the Ag-HPLC in structured lipids synthesized according to different weight ratios of substrates. Palm stearin fraction oil (PSFO) : High oleic sunflower oil (HOSO) ratios (w/w) = 1 : 0.5 (A), 1 : 0.66 (B) 1 : 1 (C), and 1 : 2 (D). SSS, Saturated–Saturated–Saturated; SUS, Saturated–Unsaturated–Saturated; SSU, Saturated–Saturated–Unsaturated; SUU, Saturated–Unsaturated–Unsaturated; USU, Unsaturated–Saturated–Unsaturated; UUU, Unsaturated–Unsaturated–Unsaturated.
재구성 지질의 합성을 위한 기질들의 무게비율을 다르게 하여 효소적 interesterification 반응을 진행한 0결과, 대칭형 TAG인 SUS와 USU의 총량은 16.63 - 19.7 area %로 검출되었으며 비대칭형 TAG인 SSU와 SUU는 53.23 - 62.28 area %로 검출되는 경향을 보였다. 대칭형 TAG보다 비대칭형 TAG의 함량이 3배 이상 검출되었는데 이는 효소작용이 TAG의 sn-1, 3 위치에 특이적으로 작용한 후 중간 생성물인 sn-1, 2 DAG가 우선적으로 생성되고 sn-1, 3 DAG로 변화하거나 이에 대해 효소작용이 일어나 비대칭형의 TAG가 생성된 것으로 사료된다.
코코아 버터의 주요 TAG 조성의 특징인 SUS 유지에 주목하여 보면 본 실험에서 기질의 반응비율을 1 : 0.5와 1 : 0.66으로 하여 효소 합성을 수행하였을 때 SUS 함량은 각각 12.28와 12.57 area %로 측정되었으며 반응비율을 1 : 1와 1 : 2로 하여 효소 합성을 진행했을 때는 11.71과 6.66 area %로 나타났다. PSFO의 기질비율이 HOSO보다 많을 때 SUS의 생성이 높아지는 경향을 보였다. 하지만 추가적인 공정을 거쳐 SUS 유지를 합성할 경우를 고려하여 sn-2 위치의 불포화지방산 함량이 최대일 때의 조건을 찾아보았다. 1 : 2의 반응비율에서 sn-2 위치의 불포화지방산을 가진 TAG 유지 함량은 69.8 area %로 관찰 되었으며, 1 : 1의 비율에서 49.63 area %, 1 : 0.66의 비율에서 37.11 area %, 1 : 0.5의 비율에서 30.1 area %로 검출되었다. 이를 통해 1 : 2의 무게비율로 생성된 재구성 지질을 선택하여 acyl migration의 이동성을 관찰하며, SUS-TAG의 함량을 높일 수 있는 조건을 찾기 위하여 반응표면분석을 이용하여 설정된 실험을 진행하였다.
SUU, SUS, SSU, UUU 및 sn-2 불포화 지방산의 함량 변화
중심합성계획의 실험설계에 따라 설정된 17개의 실험을 진행하여 얻은 종속변수인 SUU (area %, Y1), SUS (area %, Y2), SSU (area %, Y3), UUU (area %, Y4), sn-2 unsaturated fatty acid (area %, Y5)의 결과는 Table 8에 나타내었으며 2차원으로 표현한 등고선 곡선을 Fig. 6에 나타내었다.
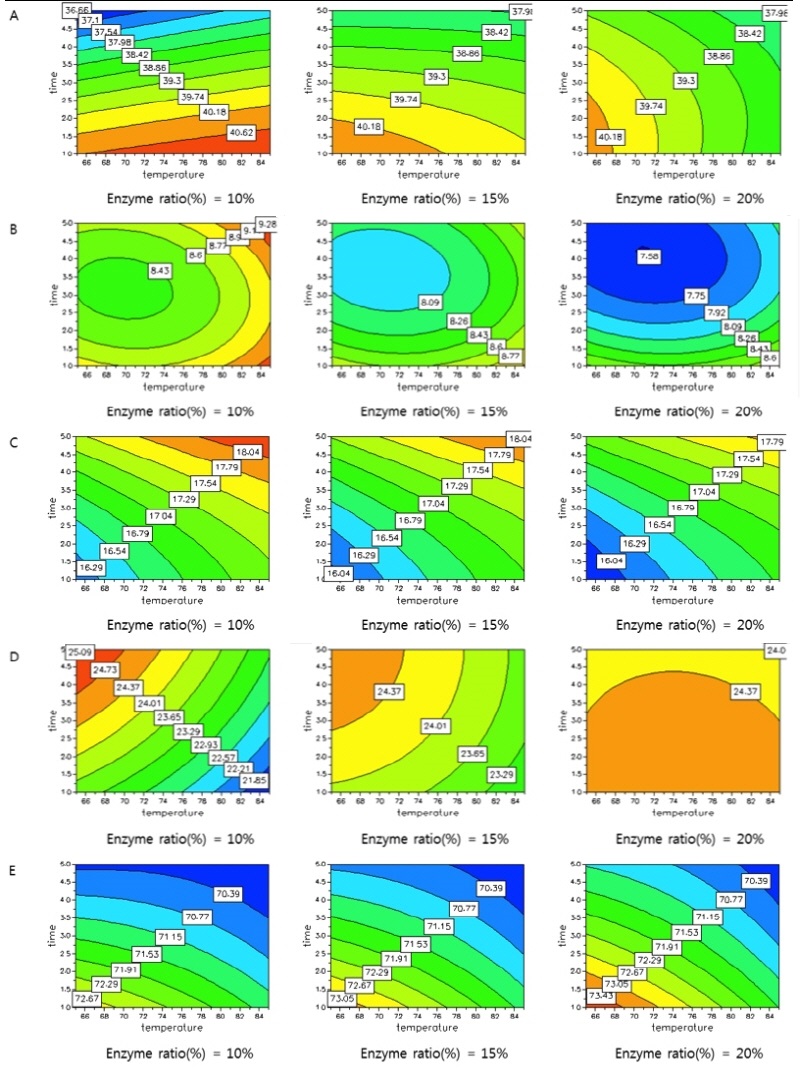
Fig. 6. Response contour plots. (A) Y1 = SUU area %, (B) Y2 = SUS area %, (C) Y3 = SSU area %, (D) Y4 = UUU area %, (E) Y5 = sn-2 unsaturated fatty acid area %. SUU, Saturated–Unsaturated–Unsaturated; SUS, Saturated–Unsaturated–Saturated; SSU, Saturated–Saturated–Unsaturated; UUU, Unsaturated–Unsaturated–Unsaturated.
Y1인 SUU의 경우 36.68 - 41.21 area %의 범위를 갖고 있었으며 효소비율이 10 weight %일 때 반응시간이 늘어남에 따라 SUU의 area %가 점차 감소하는 경향을 보였다. 효소비율이 15와 20 weight %에서는 반응온도와 시간이 증가할 때 SUU의 함량이 감소하는 반비례 관계를 나타냈다. 1시간, 85℃, 효소비율 10 weight %일 때 SUU가 41.21 area %로 가장 높게 나타났으며 5시간, 65℃, 효소비율 10 weight %일 때 36.68 area %로 가장 낮게 나타났다. Y2인 SUS의 경우 7.59 - 9.25 area %의 범위를 가지고 있었으며 1시간, 85℃, 효소비율 10 weight %의 조건에서 9.25 area %로 가장 높았고 3시간, 75℃, 효소비율 20 weight %의 조건에서 7.59 area %로 가장 낮게 나타났다. 반응온도가 높아질수록 SUS의 함량이 소량 증가하였지만 통계분석에서 유의적인 차이가 없는 것으로 나타났다. Y3인 SSU의 경우 16.01 - 18.3 area %를 나타냈으며 5시간, 85℃, 효소비율 10 weight %일 때 18.3 area %로 가장 높게 나타났고 1시간, 65℃, 효소비율 20 weight %일 때 16.01 area %로 가장 낮게 나타났다. 효소비율과 관계없이 반응시간과 반응온도가 증가할수록 SSU 함량이 증가하는 경향을 보였으나 최대값과 최소값 외에는 유의적인 차이가 나타나지 않았다.
한편, Y4인 UUU의 경우 21.01 - 24.99 area %의 범위를 갖고 있었으며 5시간, 65℃, 효소비율 10 weight %일 때 24.99 area %로 가장 높았으며 1시간, 85℃, 효소비율 10 weight %일 때 21.01 area %로 가장 낮은 함량을 보였다. 효소비율이 10과 15 weight %의 조건에서 고온에서 짧은 시간 반응하였을 때 함량이 감소하였고 효소비율이 10 weight %일 때 더 빠르게 감소하였다. 효소비율이 20 weight %일 때는 변화 양상이 뚜렷하지 않았다. 그리고 Y5인 sn-2 unsaturated fatty acid의 경우 69.91 - 73.63 area %의 범위를 나타내었고 1시간, 65℃, 효소비율 20 weight %의 조건에서 73.63 area %로 가장 높게 나타났으며 3시간, 85℃, 효소비율 15 weight %일 때 69.91 area %로 가장 낮게 나타났다. 효소비율과 관계없이 반응온도와 반응시간이 증가함에 따라 area %가 감소하는 경향을 보였다.
종속변수의 변화를 종합한 SUS-TAG 합성 모델의 최적화 조건은 Y2의 결과가 최대값을 나타내는 조건인 1시간, 85℃, 효소비율 10 weight % 이었다. 이후 추가적인 합성반응을 고려하여 Y1, Y2, 그리고 Y4가 최대값을 나타내고 Y2가 최소값을 나타낼 때를 의미하는 Y5의 최대값을 최적화 조건으로 결정하였다. 모델 최적화 조건은 1시간, 65℃ 효소비율 20 weight %일 때로 나타났다.
Central composite face design을 통한 반응 표면 분석
중심합성계획의 실험설계에 따라 설정된 17개의 실험을 진행하여 얻은 종속변수에 대한 회귀계수는 Table 9에 나타내었으며 이를 통해 종속변수에 대한 반응 표면 회귀식의 유의성을 판단하였다.
중심합성계획의 반응 표면 분석에서 ANOVA의 lack of fit이 0.05 이상을 나타낼 때 적합한 모형이라 판단하고 R2 (coefficient of determination)는 전체변화(total variation)에 대한 설명 변량(explained variation)의 비로써, 이 값이 모델의 적합도(degree of fit)를 나타내는 척도를 의미하는데 1에 근사할수록 적합한 모형이라고 판단한다(Lee and Lee, 2007). 본 실험의 종속변수(Yn)에서 Y1의 lack of fit은 0.622, R2는 0.897로 나타났고 Y2의 경우 lack of fit은 0.438, R2는 0.944로 나타났다. Y3의 lack of fit은 0.264, R2는 0.826이었고 Y4의 lack of fit은 0.526, R2는 0.857로 나타났다. 마지막으로 Y5의 lack of fit은 0.215, R2는 0.867로 관찰되었다. Joglekar and May (1987)에 따르면 R2값이 0.80 이상일 경우 모델이 적합하다고 여길 수 있다고 판단한다. 본 반응의 모든 종속변수에서 R2는 0.826 - 0.944로 나타났기에 적합한 모델을 얻었다고 판단된다. p-value의 값이 0.05 이하일 때 유의적인 영향이 존재하는데, Y1의 경우 일차항인 X1은 5 % 이내에서 유의적인 영향이 존재하였으나 다른 일차항에서는 유의적인 영향이 존재하지 않았다. Y2의 경우에는 X1, X2, X3의 모든 일차항에서 유의적인 영향이 존재하였다. Y3의 경우에는 X1, X2의 일차항에서 유의적인 영향이 존재하였고 X3에서는 유의적인 영향이 미치지 않았다. Y4의 경우에는 일차항 X2에서만 유의적인 영향이 존재하였다. Y5의 경우에는 X1, X2의 일차항에서 유의적인 영향이 존재하였고 X3에서는 유의적인 영향이 존재하지 않았다. 또한, 다섯 개의 종속변수에서 모두 이차항과 상호항의 유의적인 영향이 존재하지 않음을 확인하였다. 이를 통한 반응표면의 회귀식(Kim and Akoh, 2005)은 아래와 같다.
Y1 (SUU, area %) = 39.419 – 0.883X1 – 0.172X2 – 0.005X3 – 0.177X1X1 – 0.023X2X2 – 0.055X3X3 + 0.107X1X2 + 0.430X1X3 – 0.376X2X3
Y2 (SUS, area %) = 8.059 – 0.159X1 + 0.153X2 – 0.280X3 + 0.214X1X1 + 0.149X2X2 + 0.012X3X3 + 0.049X1X2 – 0.114X1X3 – 0.031X2X3
Y3 (SSU, area %) = 16.978 + 0.477X1 + 0.362X2 – 0.146X3 + 0.105X1X1– 0.033X2X2 + 0.003X3X3 – 0.044X1X2 + 0.0004X1X3 – 0.008X2X3
Y4 (UUU, area %) = 24.082 + 0.240X1 – 0.412X2 + 0.381X3 – 0.090X1X1 – 0.114X2X2 – 0.004X3X3 – 0.026X1X2 – 0.302X1X3 + 0.320X2X3
Y5 (sn-2 unsaturated fatty acid, area %) = 71.336 – 0.800X1 – 0.511X2 + 0.192X3 + 0.089X1X1 – 0.068X2X2 + 0.015X3X3 + 0.201X1X2 – 0.011X1X3 – 0.113X2X3
Conclusion
본 연구에서는 palm stearin을 fraction하여 얻은 고융점의 분획물인 PSFO과 HOSO을 blending하여 lipozyme® TLIM을 이용한 효소적 interesterification 반응을 통해 재구성 지질을 합성하였다. 생성된 재구성 지질을 중심합성계획을 이용한 반응표면분석의 실험조건의 기질로 사용하였고 독립변수로 반응시간, 반응온도, 반응효소를 3단계로 부호화하여 일련의 실험을 진행하였다. Acyl migration의 방향성을 관찰하며 포화-불포화-포화 대칭형 TAG 조성을 갖는 최적의 합성 모델 조건을 확립하였다. 중심합성계획에 따른 반응 표면 분석을 실행한 결과, lack of fit은 Y1 (SUU) = 0.622, Y2 (SUS) = 0.438, Y3 (SSU) = 0.264, Y4 (UUU) = 0.526, Y5 (sn-2 unsaturated fatty acid) = 0.215 이었으며 R2는 각각 0.897, 0.944, 0.826, 0.857 그리고 0.867로 나타나 적합한 모형임을 나타내었다. sn-2 unsaturated fatty acid (area %, Y5)는 TAG의 sn-1, 3 위치에 특이적으로 반응하는 효소의 특이적인 성질을 이용하여 지방산과의 효소적 acidolysis 반응이나 지방산 ethyl ester와의 효소적 interesterification 반응을 이용하여 추가적인 SUS-TAG 합성에 기여할 수 있을 것이라 판단된다. 이를 위한 sn-2 unsaturated fatty acid (area %, Y5)의 함량의 최대값을 나타내는 최적 합성 모델 조건은 반응시간(X1)은 1시간, 반응온도(X2)는 65℃, 효소비율(X3)은 20 weight %로 확인되었다.