Introduction
대추는 갈매나무과 대추나무속에 속하는 교목성 과수이며, 세계적으로는 생태형이 다른 중국계(Zizyphus jujuba Miller)와 인도계 대추(Z. mauritiana LAM)의 2종이 재배되고 있으며, 우리나라에서는 중국계 대추를 주로 재배하고 있다(Baek et al., 1969; Abbas et al., 1988; Choi, 1990).
탄저병은 다양한 식물을 기주로 하여 전 세계적으로 널리 분포하고 있는 병이며(Bailey and Jeger, 1992), 대추나무 탄저병은 고온 다습한 7 - 8월 사이에 빗물에 의해 전염되어 잎에 발생하며, 성숙기인 9월 하순에는 과실에 발생하여 심각한 피해를 유발한다. 중국계 대추(Z. jujuba Miller)에 탄저병을 일으키는 병원균은 Colletotrichum gloeosporioides (완전 세대: Glomerella cingulata)가 보고되어 있으며(Kim et al., 2004; Rockenbach et al., 2015), C. gloeosporioides은 사과, 고추, 포도 등과 같이 경제작물을 포함한 여러 식물에서 병을 발생시키는 주요 병원균 중 하나이다(Kim et al., 2015; Rockenbach et al., 2015). 대추에 발생하는 병에 관한 많은 연구가 진행되었으나(Grice, 1998; Zhang et al., 2005; Saran et al., 2007), 우리나라 대추와는 특성이 다른 인도계 대추에 관한 것이 대부분으로 우리나라에서 재배되는 중국계 대추에 관한 연구는 매우 미흡하다(Yan et al., 2015). 우리나라 대추 병 방제에 관한 연구는 많은 보고가 있으나(Bak and La, 1993; Jee et al., 1998; Lee et al., 2000; Lim et al., 2002), 대추 재배에 있어서 주요 병해 중의 하나인 대추나무 탄저병에 관한 연구는 거의 없는 실정이다(Han et al., 2009).
최근 대추의 기능성 성분 및 인체의 생리활성에 대한 연구결과가 보고되면서(Kim et al., 2011; Park et al., 2014b), 안전한 대추 과실생산에 관한 관심이 증가하고 있어서 병해 방제를 통한 친환경 농법을 활용한 생산 체계 구축이 요구되고 있다. 식물의 병을 방제하기 위하여 농약을 남용하게 되면, 약제에 대한 내성균이 출현하거나(Cho and Shin, 2004) 자연생태계를 파괴하고 환경을 오염시킬 뿐만 아니라 사람과 동물에 부정적 영향을 끼칠 수 있으므로(Kim, 2000) 친환경 병 방제에 관한 연구의 필요성이 대두되고 있다.
최근 친환경 농업에 대한 관심이 높아지면서 천연물에서 유래한 항균활성물질을 이용한 생물학적 방제(Jung et al., 2006; Lee et al., 2012; Shuping and Eloff, 2017)와 친환경 제제를 이용한 친환경 방제에 관한 연구(Lee et al., 2010; Kwon et al., 2011; Kim and Park, 2013; Kang et al., 2014)가 진행되고 있다. 친환경농업육성법에 따른 농촌진흥청 친환경유기농자재 목록고시를 보면, 사과 26종, 복숭아 14종, 포도는 19종이 등록된 것 등에 비하여 대추에 등록된 유기농자재는 7종으로 친환경 약제의 종류가 현저히 적으며, 등록된 자재가 대부분 페로몬 트랩으로 구성되어 있어 그 종류도 극히 단순한 편이다(농촌진흥청 고시 제2015-35호).
석회보르도액은 프랑스의 Millardet가 1887년에 포도 노균병 방제를 위하여 황산구리와 생석회를 혼합 제조하여 식물 진균병 방제에 성공한 이후 현재까지 광범위하게 사용되고 있는 중요한 보호살균제이며(RDA, 1995), 보르도액의 주성분인 구리는 폭넓은 항균활성을 가지고 있어 탄저병을 포함한 여러 식물병의 친환경 방제에 널리 사용되고 있다(Cetas and Leach, 1969; Washington et al., 1998; Ninot et al., 2002; Cazorla et al., 2006; Lee et al., 2009). 또한, 친환경 제제인 황토유황합제에 대한 관심이 높아져 인삼 등 일부 작물의 병해 방제에서 황토유황합제를 이용한 연구(Lim et al., 2015)가 진행되고 있으나, 극히 제한적이며 지금까지 황토유황합제의 대추 탄저병에 관한 연구는 전무하여 이에 대한 연구가 필요한 실정이다.
식물은 병원균의 침입으로부터 자신을 방어하기 위하여 병에 대한 방어기작을 발휘하며 저항성 관련 신호 전달 물질이 방어 반응을 유도한다. 이런 식물-병원균의 상호반응 발현과 식물의 병 저항성 기작에 관한 연구가 활발히 이루어지고 있다(Gianinazzi and Kassanis, 1974; Noh et al., 2005; Kim et al., 2008; Ahn et al., 2013). 안전 농산물 생산에 대한 관심이 증가함에 따라 친환경 제제뿐만 아니라 식물이 생산하는 2차 대사산물이나 활성물질을 활용한 방제방법이 주목받고 있으며, 기존 약제들에 대한 대체제로서 병 저항성을 유도하는 신호전달물질 처리가 제안되고 있다(Ahn et al., 2013).
따라서, 본 연구는 공시한 친환경 제제 및 병 저항성 유도물질에 의한 대추 탄저병균의 균사생장 억제 효과와 포트검정에서 병 발생에 대한 억제 효과를 조사하여, 대추 탄저병 방제를 위한 친환경 후보물질로서의 활용 가능성을 탐색하고 합리적이고 체계적으로 현장에서 활용될 수 있도록 최적 적용기준을 제시하고자 수행하였다.
Materials and Methods
대추 탄저병균 분리
본 실험에 사용된 공시균주는 경상북도 경산지역의 자인면, 진량읍, 압량면에 소재하는 대추재배포장에서 탄저병에 이병된 대추나무(공시품종: 복조) 가지에서 병원균을 분리하여 사용하였다. 채집한 가지는 70%의 에탄올과 1%의 차아염소산나트륨(NaOCl) 수용액에 1분간 침지하여 표면 소독한 후, 살균수로 3회 세척한 것을 PDA (potato dextrose agar) 배지에 치상하고 25℃에서 3일간 배양하여 병원균(C. gloeosporioides)을 분리하였으며, 공시균주는 4℃ 저온저장고에 보관하면서 사용하였다.
기내에서의 친환경 제제 및 신호
실험실 배양기의 PDA 배지 상에서 C. gloeosporioides을 배양한 후 균총을 균질기로 마쇄하고 새로운 PDA 50 mL에 마쇄된 균체를 섞어 petri dish에 분주한 뒤 1시간 동안 건조하였다. 시험에 사용된 약제는 증류수를 이용하여 포장에서 사용하는 기준농도와 고농도로 조절하여 각각 처리하였다. 멸균한 paper disc (Whatman No.1, Whatman Plc., Kent, UK)에 각각 50 μL/disc의 약제를 첨가하여 적신 다음 건조시키고 균체가 도말된 PDA배지 중앙에 놓고 25℃ 항온기에서 배양하였다. 약제 처리를 한 후 각각 24, 48, 72, 96 시간이 지난 다음 paper disc 주변의 균사생장억제환의 크기(mm)를 측정하여 항균활성을 조사하였다.
실험에 사용한 친환경 제제는 시판중인 석회보르도액(IC-66D, Hankooksamgong, Seoul, Korea)과 황토유황합제를 사용하였으며, 황토유황합제는 시중에 판매되는 황토유황합제 자가제조 키트(Jadam sulfur, Jadam organic farming, Daejeon, Korea)를 매뉴얼에 맞게 조제하여 사용하였으며, 석회보르도액은 40배액, 황토유황합제는 250배액을 기준농도로 처리하였다. 고농도에서의 대추 탄저병균 항균활성 검정에서는 보르도액과 황토유황합제를 희석하지 않은 원액과 2배액, 4배액을 사용하였다.
신호전달 물질로는 에테폰(ethephon), 과산화수소수(hydrogen peroxide: H2O2,), 자스몬산(methyl jasmonate: Me-JA), 살리실산(salicylic acid: SA)을 사용하였으며, 각각 33, 10, 0.5, 1 mM을 기준농도로 처리하였다. 고농도에서의 항균활성 검정에서는 에테폰, 과산화수소, 자스몬산, 살리실산을 기준농도의 2배량으로 처리하였다. 대조약제로는 친환경제의 항균활성을 비교하기 위해 합성약제인 만코제브(mancozeb, 1,000배액)를 공시하였다.
병원균 접종방법에 따른 병 발생 억제 효과 분석
공시약제의 예방적 효과를 검정하기 위하여 대추나무에서 채취한 잎과 과실에 공시약제를 살포한 후 24시간 유지한 다음 병원균을 접종하였다. C. gloeosporioides의 식물조직에서 감염 용이성을 동시에 확인하기 위해 균사체와 포자로 구분하여 상처와 무상처 접종으로 나누어 병원균을 접종하였다.
포자접종의 경우 병원균의 포자현탁액(포자농도: 106 spores/mL)을 잎에 처리하였으며, 상처접종은 공시약제를 처리하기 전에 바늘로 상처(5구멍/1잎)를 내고 상처 당 10 μL씩 pipette을 이용하여 점적접종하였다. 균총접종은 cork borer를 사용하여 균총부분이 대추 잎과 과실에 접촉하도록 접종하였으며, 포자접종의 경우와 같이 잎은 무상처와 상처접종으로, 과실은 유과기와 변색기로 나누어 접종하였다.
접종 후 5일이 지난 후 탄저병 병반의 직경(mm)을 측정하여 병 발생 억제효과를 조사하였으며, 본 실험에서 산출한 병 발생 억제율은 아래의 식을 이용하여 계산하였다.
병반진전억제율 = (무처리구 병반직경-처리구 병반직경)/무처리구 병반직경 × 100 (%)
탄저병
탄저병 방제효과 포트 검정
대추 탄저병 방제효과를 검정하기 위해서 경상북도 경산시 영남대학교 부속농장 온실에서 2015년 7월에 포트 재배되는 4년생 대추나무 잎에 공시약제를 살포하고 24시간동안 유지한 후, 병원균 포자현탁액(106 spores/mL)을 분무접종하였다. 접종 후 5일이 경과한 후 병 발생 억제율을 조사하였으며, 무상처접종에서는 단위면적당(1 cm2) 병반수를 조사하고 상처접종에서는 병반의 직경(mm)을 조사하여 대추 탄저병에 대한 방제효과를 검정하였다.
병 발생 억제율 = (무처리구 병반수-처리구 병반수)/무처리구 병반수 × 100(%)
통계처리
모든 실험은 3회씩 3번 반복하였으며, 통계 프로그램 SAS (SAS Institute Inc., Cary, NC, USA)을 이용하여 각 실험 결과에 대한 평균과 표준오차 등을 통계 분석하였다.
Results and Discussion
기내 향균활성 검정 결과
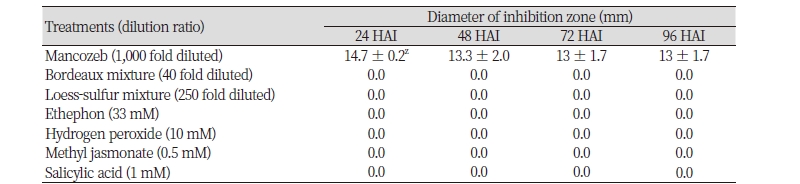
C. gloeosporioides에 의해 발생하여 대추 과실의 생육불량과 품질 저하를 유발하는 대추나무 탄저병 방제를 위한 약제를 선발하기 위하여 대추 재배에 이용되는 친환경 제제를 이용하여 기내 항균활성 검정을 하였다. 대추의 대표적인 친환경 제제인 보르도액과 황토유합제의 기준농도처리에서 C. gloeosporioides에 대한 항균활성을 조사한 결과, 대조약제인 만코제브(mancozeb, 1,000배액) 처리구에서는 직경 13 mm 이상의 균사생장억제존이 형성되었으나, 보르도액, 황토유황합제 등 친환경 제제 기준농도 처리구에서는 균사생장억제존이 나타나지 않아 대추 탄저병에 대한 억제효과를 전혀 보이지 않았다. 이는 기준농도의 친환경 제제 처리가 대추 탄저병균에 직접적인 항균활성을 나타내지 않는다는 것을 의미한다고 할 수 있다.
또한, 친환경 대체제로 사용된 에테폰(33 mM), 과산화수소(10 mM), 자스몬산(0.5 mM), 살리실산(1 mM)의 기준농도 처리에서도 균사생장억제존이 나타나지 않아, 친환경 제제 처리에서와 같이 대추 탄저병균에 대한 직접적인 항균활성을 보이지 않는 것으로 나타났다(Table 1).
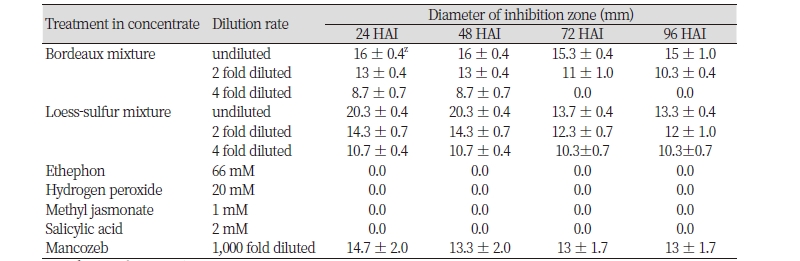
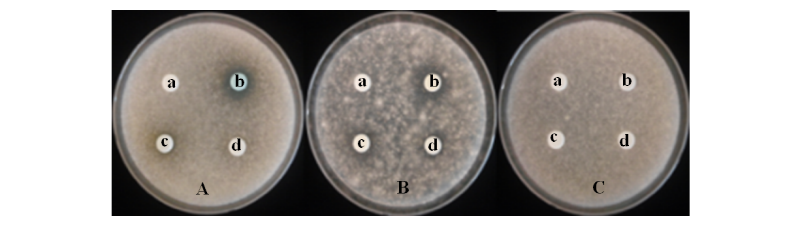
대추 재배에 이용되고 있는 친환경 제제인 보르도액과 황도유황합제의 고농도에서의 대추 탄저병균인 C. gloeosporioides에 대한 기내 항균활성을 조사하였다(Table 2, Fig. 1). 24시간이 경과한 후 보르도액은 16 mm, 황토유황합제는 20.3 mm의 균사생장억제존을 보여 대조약제인 만코제브(mancozeb, 1,000배액)보다 각각 109%와 138.1% 강한 항균활성을 보였다. 또한, 약효의 지속시간을 조사한 결과 접종 후 96시간이 지난 후에도 보르도액과 황토유황합제 처리구에서는 대조약제 처리와 비슷한 항균활성을 나타내는 것으로 조사되었다. 그러나 에테폰, 과산화수소, 자스몬산, 살리실산 등 친환경 대체제 처리구에서는 앞선 기준농도 실험에서와 같이 고농도에서도 균사생장억제존을 보이지 않아, 고농도에서도 대추나무 탄저병균에 대한 직접적인 항균활성을 나타내지 않는 것으로 조사되었다.
병원균 접종방법에 따른 병 발생 억제효과
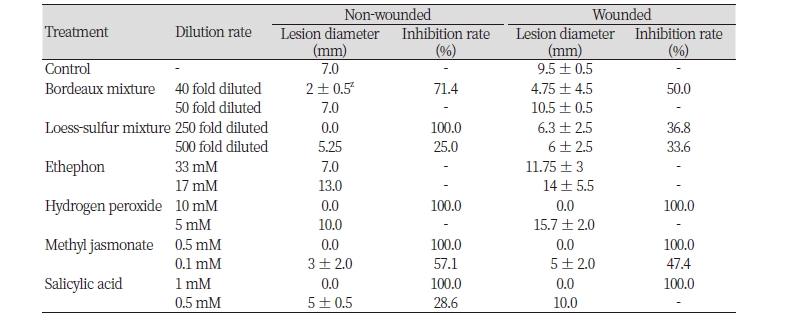
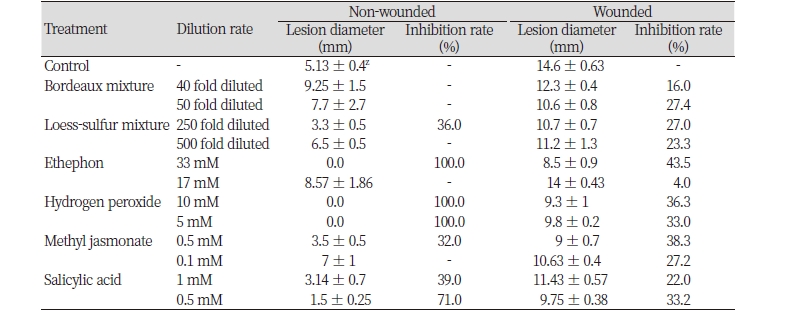
대추나무에서 잎에 C. gloeosporioides 포자현탁액을 접종한 후, 병 발생 억제효과를 검정하였다(Table 3). 친환경 제제 처리구에서는 보르도액 40배액 무상처 접종에서 71.4%의 병 발생 억제효과를 보였고, 상처접종에서는 50%의 억제효과를 보였다. 황토유황합제는 기준농도인 250배액 무상처 접종에서 100%의 높은 억제율를 보였으나, 상처 접종에서는 33.6%로 발병 억제효과가 낮게 나타났다. 무상처 접종이 상처접종에 비하여 병 발생 억제율이 높게 나온 것은 식물 조직에 상처가 존재하게 되면 탄저병 포자가 쉽게 침입하여 만연할 수 있게 되기 때문이라 생각된다.
유황은 토양의 산도조절(Kim et al., 2012; Park et al., 2013) 뿐만 아니라 친환경 병 방제(Yoon et al., 2010)에도 사용되고 있는데, 토마토에서 잿빛곰팡이병 병원균의 생장을 억제한다고 보고되어 있으며(Kwak et al., 2012a), 고추에서 탄저병 포자 발아와 균사생장을 억제한다고 보고되어 있다(Kwak et al., 2012b). 또한, 양파, 인삼, 박과채소 등 다양한 작물에서 친환경 유기농자재로서 사용되고 있다(Hwang et al., 2009; Yeo et al., 2013; Lim et al., 2015). 유황 자재 중 대표적인 석회유황합제는 살균력과 살충력을 가지고 있을 뿐만 아니라 가격이 저렴해 과수를 비롯한 원예작물의 병해충 방제에 사용되고 있다(Sung, 2013). 그러나 석회유황합제를 제조할 때 황을 용해하는 과정에 오랜 시간이 소요되고, 약해 발생 등의 단점이 있다. 최근에는 황을 간편하게 녹여 쉽게 제조할 수 있는 황토유황합제가 보급되고 있는 것으로 알려져 있다(Lim et al., 2015). 황토유황합제는 급성경구독성시험 뿐만 아니라 피부와 안점막의 자극성 실험에서도 모두 저자극을 보여 친환경 유기농자재로 사용하기에 적합한 것으로 보고되어 있으며(Paik et al., 2012), 토마토 흰가루병의 방제에 효과가 있다고 보고되어 있다(Shim et al., 2014). 또한, 석회보르도액과 더불어 병해충 방제용 친환경 유기농자재로 농촌진흥청에 목록공시가 되어있으며, 제조방법이 간편하고 비용도 저렴하여 자가제조로 널리 활용되고 있다. 다양한 식물 병 방제에 친환경 제제로 널리 이용되고 있는 보르도액과 황토유황합제는 대추 탄저병 방제에도 활용할 후 있다고 판단된다.
식물체의 병저항성 방어반응과 관련한 신호전달물질인 에테폰, 과산화수소, 자스몬산, 살리실산을 사용하여 대추 탄저병균 포자 접종에 의한 잎 탄저병 방제효과를 검정한 결과, 에테폰(33 mM) 처리구에서는 상처접종과 무상처접종 모두에서 발병 억제효과가 나타나지 않았다. 한편, 과산화수소(10 mM), 자스몬산(0.5 mM), 살리실산(1 mM) 처리구의 경우, 이들 물질을 처리한 후 탄저병균을 접종하였을 경우 탁월한 병 발생 억제효과를 얻었다. 다만, 저농도에서는 방제효과가 급격하게 저하된 것을 확인할 수 있었다. 이들 물질이 앞선 기내 항균활성 실험에서 보여주듯이, 이러한 결과는 대추 탄저병균의 생장을 직접적으로 억제하지는 않았기 때문에, 탄저병 발생을 낮은 농도에서 병 발생을 억제하기에는 한계가 있기 때문인 것으로 생각된다.
대추나무의 잎에 C. gloeosporioides을 균총 접종한 후 병 발생 억제효과를 검정하였다(Table 4). 이전 연구들에서 보르도액은 균사생장 억제보다 포자발아 억제효과가 우수하다고 보고되었는데(Ponmurugan et al., 2006; Everett and Timudo-Torrevilla, 2007), 본 연구에서도 보르도액 40배액을 처리하면 포자접종에 의한 병반의 발생이(Table 3) 균총접종에 의한 발생(Table 4)에 비하여 크게 억제되는 것으로 나타났다. 균사에 비하여 포자발아를 억제하는 효과가 우수한 보르도액을 병원균이 침입하기 전에 예방적으로 처리를 하면 탄저병 방제 효과를 높일 수 있다는 보고(Park et al., 2014b)와 일치하는 결과이다.
또한, 살균제로 널리 사용되고 있는 황은 침투이행성 살균제와는 달리 비침투성 물질로서 여러 차례 반복적으로 사용해도 방제효과가 높게 유지된다고 보고되어 있으며(McGrath and Johnston, 1986), 황의 항균활성은 대부분 병원균의 포자 발아나 발아관의 생장을 억제하거나 균사 생장을 억제하는 형태로 나타나는 것으로 보고되어 있다(Williams and Cooper, 2004).
친환경 대체제로 사용이 가능한 병해 저항성 반응 유도물질을 처리한 대추나무 잎에서는 에테폰(33 mM)과 과산화수소 무상처접종의 경우 방제효과가 높게 나타났으며 특히 과산화수소 무상처접종의 경우에는 처리농도와 관계없이 100%의 탁월한 병 발생 억제율을 보였다.
시험에 사용된 친환경 제제와 저항성 반응 신호전달물질은 C. gloeosporioides에 대한 직접적인 항균효과가 나타나지 않았음에도 불구하고, 대추나무 잎의 포자접종과 균총접종에서 대추나무 탄저병에 대한 억제 효과를 나타냈다. 이는 이들 물질이 대추 탄저병균에 대한 방어반응을 유도함으로써 나타나는 결과라 생각되며, 이에 대한 추후 연구가 더 필요할 것으로 생각된다.
대추나무에서 건전한 과실을 수확하여 유과기와 변색기로 구분하여 공시약제를 살포한 뒤 탄저병 포자접종과 균총접종을 실시하여 병 발생 억제효과를 조사하였다(Table 5, Fig. 2). 대추 과실에 탄저병균의 포자현탁액을 분무접종한 결과, 모든 처리구에서 병이 발생되지 않았다(자료 미제시).

Fig. 2. Anthracnose development of jujube fruits treated by environment-friendly materials and defense response signaling materials after agar block inoculation of pathogen. (A) Control. (B) Bordeaux mixture (40 fold). (C) Loess-sulfur mixture (250 fold). (D) Ethephon (33 mM). (E) Hydrogen peroxide (10 mM). (F) Methyl jasmonate (0.5 mM). (G) Salicylic acid (1 mM). YS, Young stage; RS, Ripening stage.
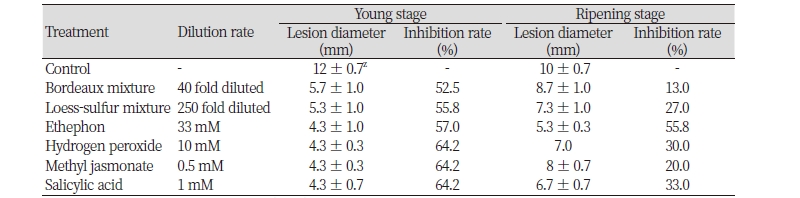
한편, 탄저병균의 균총을 접종한 경우에는 변색기 과실에 비하여 유과기에서 방제효과가 높게 나타나는 경향을 보였다. 보르도액을 처리한 유과기 과실에서는 52.5%의 양호한 방제효과를 보였으나, 변색기 과실에서는 13%로 낮게 나타났다. 황토유황합제에서도 역시 유과기 과실에서는 55.8%의 높은 방제효과를 보인 것에 비하여 변색기 과실에서는 27%로 방제효과가 현저하게 낮게 나타났다. 신호전달 물질을 처리한 실험에서도 유과기의 과실에서 변색기 과실에 비하여 방제효과가 높게 나타났다(Table 5). 에테폰 처리에서 유과기에 57%의 억제율을 보인 것에 비하여 변색기에는 55.8%로 조사되었다. 과산화수소, 자스몬산, 살리실산 처리에서 유과기에 64.2%로 높은 억제효과를 보인 것에 비하여 변색기에는 각각 30%, 20%, 33%로 매우 낮은 억제율을 보였다.
이처럼 친환경 제제인 보르도액, 황토유황합제와 친환경 대체제인 에테폰, 과산화수소, 자스몬산, 살리실산을 처리하였을 때, 대추나무 탄저병균을 유과기 과실에 접종한 것이 변색기 과실에 비하여 병반의 크기도 작고, 방제가도 높게 나타나는 경향을 보였다. 이는 고추에 있어서 탄저병균인 C. gloeosporioides에 대한 방제효과는 과피층이 두꺼울수록 병반 크기가 작고 병반 증가속도도 감소한다는 보고(Manandhar et al., 1995)와 여러 생육 단계의 고추과실에 탄저병균을 접종한 결과, 성숙한 고추과실에서 병반의 크기가 증가한다는 보고(Rajapakse and Ranasinghe, 2002)와 마찬가지로 본 시험에서도 유과기에 비해 상대적으로 성숙한 변색기 대추과실이 탄저병균에 상대적으로 높은 감수성을 나타냈다. 이상의 결과를 종합하면, 대추 과실 탄저병은 방제시기에 따른 방제효과의 차이가 크며, 효과적인 방제를 위해서는 변색기보다는 유과기에 방제를 하는 것이 효과적이라 판단된다.
탄저병 방제효과 포트 검정
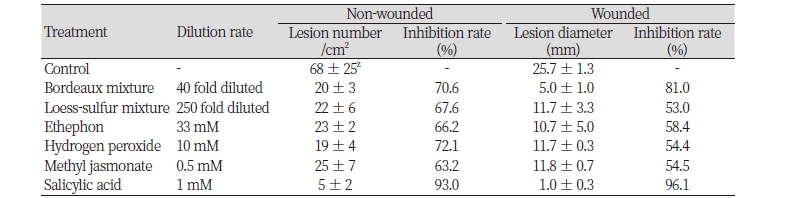
대추나무 수체에서 친환경 제제와 병 저항성 유도물질인 친환경 대체제의 탄저병 방제효과를 검정하기 위하여 포트에서 재배한 대추나무 잎에 이들 물질을 처리한 후 탄저병균을 포자 접종하여 병 발생 억제율을 조사하였다(Table 6, Fig. 3). 친환경 제제인 보르도액의 무상처와 상처 접종구에서 탄저병 발생은 각각 70.6%와 81%의 방제효과를 나타내었고, 황토유황합제는 무상처 접종에서 67.6%의 억제율을 보였으며 상처 접종에서는 53%의 억제율을 나타내었다. 이러한 결과로 볼 때에 시험에서 사용된 친환경 제제는 대추나무 잎에 탄저병이 발생하기 전에 처리했을 때 양호한 방제효과를 기대할 수 있으며, 특히 보르도액은 대추나무 잎에 상처가 있다 하더라도 탄저병에 대한 예방약제로서 양호한 병 발생억제 효과를 기대할 수 있을 것이라 생각된다.

Fig. 3. Anthracnose development of jujube plant leaves treated by environment-friendly materials and defense response signaling molecules. (A) Control, (B) Bordeaux mixture (40 fold), (C) Loess-sulfur mixture (250 fold), (D) Ethephon (33 mM), (E) Hydrogen peroxide (10 mM), (F) Methyl jasmonate (0.5 mM), (G) Salicylic acid (1 mM). NW, Non-wounded; W, Wounded.
또한, 보르도액은 구리화합물과 생석회가 혼합되어 있는데, 구리화합물은 이동이 어려워 부착된 부위에서만 방제효과를 나타낸다(Park et al., 2014a). 따라서 효과적인 병 발생 억제를 위해서는 보르도액의 균일한 처리가 필요하다고 생각된다.
유황은 강한 알칼리성을 띄고 있어 균체나 환부조직을 부식시켜 황이 균체 속으로 침입하기 쉽게 만들어 살균작용을 하는 것으로 보고되어 있으며(Kang et al., 2007), 병을 치료할 수는 없어도 포자 생성을 저해하여 병원체의 확산을 막는 역할을 한다고 알려져 있다. 황토유황합제는 유황을 포함하고 있어 살균효과가 높아 대추 탄저병을 방제하는 친환경 살균제로 활용성이 기대된다. 그러나 pH가 13으로 강한 알칼리성을 보여 신초나 꽃이 고사되는 약해를 일으키기도 하므로 산도교정이 필요하다고 보고되고 있다(Paik et al., 2012). 대추나무에 황토유황합제를 처리할 때 산도교정을 통하여 유황에 의한 약해 발생을 최소화할 필요가 있다고 생각된다.
포트 재배한 대추나무 잎에 친환경 대체제인 에테폰, 과산화수소, 자스몬산과 살리실산을 처리한 후 탄저병균을 접종하여 방제효과를 조사한 결과, 이들 처리구에서는 모두 탄저병 발생을 효과적으로 억제하였다. 특히, 살리실산 처리구에서는 무상처와 상처 접종에서 각각 93.0% 와 96.1%로 탁월한 방제효과를 확인할 수 있었다. 식물은 외부에서 침입한 병원균으로부터 자신을 방어하기 위하여 다양한 방어기작을 발현시킨다. 병원균이 침입한 후, 병 저항성 신호 전달 과정을 통하여 식물에 유도 저항성(induced resistance)이 발현된다. 신호전달 물질의 처리는 다양한 식물에서 병 발생을 억제하는 방어반응을 유도한다고 보고되어 있으며(Xu et al., 1994; Ryals et al., 1996), 특히, 에테폰, 과산산화수, 자스몬산, 살리실산 처리를 통한 식물 병 저항성 유도에 관하여 많이 보고되고 있다(Enyedi et al., 1992; Xu et al., 1994; Chen et al., 1996; Marrs, 1996; Wagner et al., 2002). 또한, 식물의 병 저항성 신호전달물질인 자스몬산 처리를 통한 유도 저항성으로 친환경 병 방제가 가능하다고 보고되어 있으며(Han et al., 2011), 기존 약제들에 대한 대체제로서 병 저항성을 유도하는 신호전달물질 처리가 제안되고 있다.
본 실험에 사용된 친환경 제제와 병 저항성 유도 신호전달물질은 앞선 기내 항균활성 실험(Table 1)에서 탄저병균에 대한 직접적인 항균효과를 보이지는 않았으나, 대추나무 수체 처리에서는 병 발생 억제효과가 양호한 것을 확인할 수 있었다(Table 6). 또한, 포트 검정에서도 양호한 방제효과를 나타내어 이들 물질을 대추나무 탄저병 방제용 후보물질로 선발하여 사용할 수 있을 것으로 생각된다. 그러나 실험 방법에 따라 다소 상이한 발병 억제효과를 보이고 있으므로, 실제 포장에서 친환경 제제와 신호전달물질들의 방제효과를 높이기 위해서는 이들 물질의 처리방법과 처리시기에 대한 추가 연구가 더 필요하다고 생각된다.
Conclusion
C. gloeosporioides에 의해 발생하는 대추나무 탄저병은 대추 재배에서 발병하는 중요한 병 중 하나이며, 대추 탄저병 친환경 방제를 위한 후보 물질을 선발하고자 연구를 수행하였다. 친환경 제제로는 석회보르도액, 황토유황합제를 사용하였으며, 신호전달 물질로는 병 저항성 유도물질로 널리 알려진 에테폰, 과산화수소, 자스몬산, 살리실산을 사용하였다.기내 항균활성 검정에서 기준농도의 친환경 제제와 신호전달물질은 대추나무 탄저병균에 대해 직접적인 항균활성을 보이지 않았다. 그러나 고농도에서 친환경 제제인 보르도액은 16 mm, 황토유황합제에서는 20.3 mm의 균사생장억제존을 나타내어 대조약제 보다 강한 항균활성을 보였으며, 신호전달물질은 고농도에서도 직접적인 항균활성을 나타내지 않았다. 대추나무 잎에 탄저병균을 접종한 결과, 친환경 제제는 기준농도에서 양호한 방제효과를 얻었으나 저농도에서는 방제효과를 기대할 수 없었으며, 신호전달물질은 높은 방제효과를 얻었다. 대추 과실 처리에서는 탄저병균을 접종한 유과기의 과실이 변색기 과실보다 높은 방제효과를 나타냈다. 시험에 사용된 친환경 제제와 병 저항성을 유도하는 신호전달 물질은 대추나무 탄저병균에 대하여 직접적인 항균효과가 나타나지는 않았으나, 실내접종과 포트 접종에서 양호한 방제효과를 나타내어 이들 물질을 대추나무 탄저병 방제용 친환경 소재로 선발하여 사용할 수 있을 것으로 여겨진다.