Introduction
식육가공식품은 아질산염(nitrite) 첨가 여부에 따라 염지 및 비염지 식육가공식품으로 분류된다. 염지 식육가공식품의 경우 아질산염을 이용한 염지 공정을 거치게 되고, 아질산염은 염지 식육가공식품에서 육색 및 풍미 발현, 지방산화 억제와 부패 및 병원성 미생물의 성장 억제 등의 역할을 한다(Sindelar et al., 2007; Sindelar and Milkowski, 2012; Lee et al., 2018). 현재 식육가공식품 산업에서 아질산염은 아질산 나트륨이나 아질산 칼륨 같은 합성 아질산 소재나 샐러리 파우더 같은 천연 아질산 소재가 이용되고 있다. 그러나 합성 아질산염은 가격이 저렴하고 이용이 간편하다는 장점이 있으나, 합성 식품첨가제에 대한 소비자의 부정적인 인식 증가로 인해 이를 대체할 수 있는 천연 소재의 개발 및 이용이 요구되고 있다(Sebranek and Bacus, 2007).
현재 산업에서 이용되는 천연 아질산 소재는 천연물이 내재하고 있는 질산을 질산 환원 미생물 및 효소를 이용하여 아질산으로 전변시키는 공정을 거쳐 생산 및 이용이 되고 있다(Sindelar et al., 2007). 따라서 아질산 소재로 이용 가능한 천연물은 질산을 함유하고 있어야 하며, 항균 및 항산화능 등의 기능성이 뛰어난 천연물도 질산을 함유하고 있지 않다면 천연 아질산 소재로 이용을 할 수 없다. 이러한 아질산 소재 개발의 한계를 해결하기 위해 새로운 염지 공정으로 플라즈마를 이용한 염지법이 대두되고 있다 (Lee et al., 2017a; Jo et al., 2018).
플라즈마는 물질의 제4 상태로 자유 라디칼이나 이온, 전자 등을 포함하고 있는 이온화된 가스를 말한다(Afshari and Hosseini, 2013). 플라즈마는 전기 방전을 통해 분자를 가속화시켜 분자가 전하를 띈 이온으로 분리되어 있는 상태로, 발생 조건에 따라 플라즈마의 종류가 나뉘게 된다(Afshari and Hosseini, 2013). 식품산업에서 플라즈마를 이용한 부분은 주로 플라즈마의 살균력을 이용하여 비 가열 살균법으로 이용 및 연구를 진행해 왔다(Jayasena et al., 2015). 그러나 최근 플라즈마를 식품에 처리 시 식품 내의 성분이 변화함에 따라 식품의 생리 기능성 증진 및 새로운 생리 기능성을 발현시키는 연구가 진행되고 있다. Jung et al. (2015a)의 연구에서 수용액에 플라즈마를 처리하였을 때, 공기 중의 활성 질소 종과 물 분자가 반응하여 수용액 내에 아질산 이온이 생성됨을 확인하였고, Rodríguez et al. (2017)은 캐슈 애플 주스에 저온 플라즈마 간접 처리 시, 주스 내의 비타민 C 함량, 총 페놀 및 플라보노이드 함량이 증가함에 따라 항산화 활성이 증진되는 결과를 보고하였다. 뿐만 아니라 Kim et al. (2014)에 따르면 나린진 수용액에 플라즈마를 처리하였을 때, 나린진이 저 분자 물질로 분해됨에 따라 나린진의 항산화 활성이 증진됨을 확인하였다. 이에 따라 Jung et al. (2017)은 자소엽 추출물에 플라즈마를 처리한 결과 추출물내 아질산 이온 생성과 함께 항균 활성이 증진됨을 확인하였으며, 플라즈마 처리를 통해 질산을 함유하지 않은 천연물도 아질산 소재로서 개발이 가능함을 제시하였다.
따라서 본 연구는 자소엽 추출물에 대기압 저온 플라즈마를 처리하여 아질산 소재를 제조하고, 제조된 자소엽 추출물을 식육 균질물에 첨가하여 플라즈마 처리된 자소엽 추출물이 식육 균질물의 염지 및 이화학적 특성에 미치는 영향을 알아보기 위해 실시되었다.
Materials and Methods
자소엽 추출물 제조 및 대기압 저온 플라즈마 간접 처리
본 실험에 이용된 자소엽(perilla frutescens var. acuta)은 경남 남해군 소재의 지역 농장에서 구매하였다. 자소엽 착즙액 제조를 위해 자소엽 잎 500 g과 35% (v : v) 에탄올 1.5 L를 함께 진공 믹서기(Hanssem Co., Seoul, Korea)를 이용하여 혼합하였다. 제조된 착즙액은 6,710 g에서 30분간 원심분리 하였으며, 상층액을 증류수와 혼합하여(50 : 50, v : v) 최종 3 L의 착즙액을 준비하였다. 제조된 자소엽 착즙액은 6 M 수산화 나트륨을 이용하여 pH를 9로 적정한 후 플라즈마 처리를 진행하였다.
플라즈마 소스는 dielectric-barrier discharge를 이용하였으며, electrode 및 ground case 냉각을 위한 냉각관을 구성하여 플라즈마 발생 중 수돗물을 순환시켜 플라즈마 소스를 냉각시켰다. 플라즈마 소스를 저주파의 파워서플라이에 연결하여 1.5 kW에서 대기상의 공기를 이용하여 플라즈마를 발생시켰으며, 생성된 플라즈마는 순환펌프(circulation pump)에 연결된 플라즈마 공급관을 통해 자소엽 착즙액의 pH가 6에 도달하는 시점까지 처리하였다. 플라즈마 처리된 자소엽 착즙액을 동결 건조하였으며, 자소엽 착즙액 분말의 아질산 이온 함량은 Jung et al. (2017)의 방법을 이용 분석하였고, 9,133 ppm의 아질산 이온을 함유하고 있는 것이 확인되었다.
식육 균질물 제조
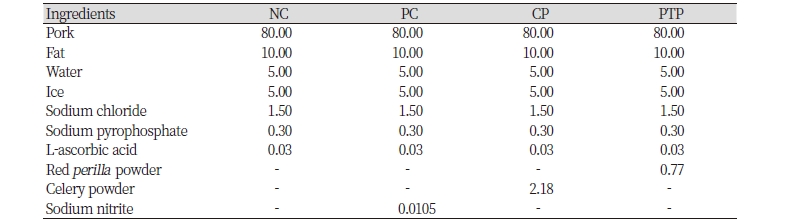
식육 균질물은 아질산을 첨가하지 않은 음성대조구(NC), 아질산 나트륨을 70 ppm 첨가한 양성대조구(PC), 샐러리 분말을 아질산 함량 기준 70 ppm 첨가한 군(CP), 플라즈마 처리한 자소엽 분말을 아질산 함량 기준 70 ppm 첨가한 군(PTP)으로 배합비는 Table 1과 같이 제조되었다. 이용된 샐러리 분말과 자소엽 분말의 아질산 함량은 각각 3,200 ppm, 9,133 ppm이였다. 제조된 식육 균질물은 심부 온도가 75℃가 되도록 가열한 후 냉각시켜 분석 전까지 영하 70℃에서 냉동 보관하였다.
pH 및 가열 감량
식육 균질물 1 g을 증류수 9 mL과 혼합하여 균질 하였다(T25 basic, IKA GmbH & Co. KG, Germany). 균질액은 Whatman No.4 여과지(Whatman, Maidstone, England)를 이용해 여과한 후 pH측정기(SevenEasy, Mettler-Toledo Inti Inc., Schwerzenbach, Switzerland)를 이용해 여과액의 pH를 측정하였다.
염지 육색소(Nitrosyl-hemochrome) 함량
식육 균질물의 nitrosyl-hemochrome 함량은 nitroso-pigment와 총 pigment의 함량을 측정하여 구하였다. Nitroso-pigment 함량을 구하기 위해 샘플(10 g)을 호일로 감싼 플라스크에 칭량하여, 아세톤(40 mL), 증류수(3 mL)을 첨가한 후 5분간 암실에서 교반 하였다. 혼합물은 여과지 Whatman No.4로 여과한 후 여과액을 540 nm에서 흡광도를 측정하였다. Nitroso-pigment의 함량은 흡광도(A1)에 290을 곱하여 계산하였다.
총 pigment 함량을 구하기 위해 시료(10 g)를 호일로 감싼 플라스크에 칭량하여, 아세톤(40 mL), 증류수(2 mL) 및 염산(1 mL)을 첨가한 후 1시간 동안 암실에서 교반 하였다. 혼합물은 여과지 Whatman No.4로 여과한 후 여과액을 흡광도 640 nm (A2)에서 측정하였다. 총 pigment의 양은 흡광도(A2)에 680을 곱하여 계산하였다.
Nitrosyl-hemochrome의 함량은 다음 식에 의해 계산되었다.
Nitrosyl-hemchrome 함량(%) = {Nitroso-pigment (ppm)/총 pigment (ppm)}*100
잔류 아질산 함량
식육 균질물의 잔류 아질산이온 함량 측정은 AOAC method 973.31 (AOAC, 1990)에 따라 측정하였다. 200 mL 메스 플라스크(volumetric flask)에 채취한 시료(10 g)와 온수(80℃) 150 mL을 충분히 섞어 넣는다. 그 후 0.5 M의 수산화나트륨 용액 10 mL과 120 g/L의 황산아연용액 10 mL 넣고 섞어 80℃의 shaking water bath에서 20분간 가열했다. 10분간 냉각 후 100 g/L의 초산 암모늄(100 mL/L 암모니아수로 pH를 9.0으로 조정)을 20 mL 넣고 증류수를 넣어 200 mL로 하였다. 용액을 혼합한 후 Whatman No.4 여과지를 이용해 여과시켰다. 여과액 20 mL를 25 mL 메스 플라스크에 넣고 염산 : 물(1 : 1) 용액에 녹인 30 mmol/L 설파닐아미드 용액 1 mL과 5 mmol/L 나프틸에틸렌디아민 용액 1 mL을 첨가한 후 증류수를 넣어 25 mL로 하였다. 발색을 위해 혼합액을 20분간 방치한 후 분광 광도계(DU®530, Beckman Instruments Inc., CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다.
육색
시료 30 g을 80℃의 water bath에서 30분간 익힌 후 10분간 냉각하였다. 가열한 식육 균질물의 육색은 색차계(CM_3500d, Minolta, Japan)를 사용하여 명도(L*), 적색도(a*)및 황색도(b*)를 측정했다. 결과값은 Spectra Magic Software (Minolta, Japan)로 자동 분석하였으며, 각 시료 표면의 다른 2곳을 측정하여 그 평균 값을 각 시료의 최종 결과값으로 하였다.
지질 산패도
지질 산패도는 Jung et al. (2016)의 방법에 따라 malondialdehyde를 측정하였다. 시료(3 g)에 증류수 6 mL과 7.2%의 2, 6-di-tret-butyl-4-methylpehnol 50 μL을 첨가하여 균질기(T25 basic, IKA GmbH & Co., KG, Germany)를 이용하여 균질 했다. 균질물 500 μL과 6 M NaOH 200 μL을 마이크로 튜브에 담고 60℃의 water bath에서 45분 가열하고 실온에서 냉각시켰다. 1 mL의 acetonitrile을 첨가한 후 13,000 × g로 10분간 원심 분리하여 상층액 1 mL를 0.2 μm PVDF 필터(Whatman)에 통과시킨 후 여과액을 수득하였다. malondialdehyde (MDA)는 Atlantis T3 C18 RP column (4.6 × 250 mm, 5 μm particles)을 사용하여 HPLC (ACME 9000; Younglin Instruments Inc., Daejeon, Korea)로 분석하였으며, 30 mM K2HPO4 (H3PO4를 이용해 pH 6.2로 조정)을 이동상으로 사용하였다. 시료 50 μL에 1.2 mL/min의 유속으로 이동상을 주입하였고, 컬럼의 온도는 35℃를 유지하고 UV/VIS 파장은 254 nm을 사용했다. Malondialdehyde의 표준 물질로는 1, 1, 3, 3-tetraethoxypropane solution (3.2 mM)을 사용하였고 malondialdehyde 농도는 mg MDA/kg으로 표시하였다.
통계분석
본 연구는 3반복으로 수행되었으며 분석 결과를 완전 임의 배치 법(randomized complete block design, batch as a block) 하에 일반선형모형(general linear model)을 이용하여 통계분석 하였다. 통계 분석의 주 효과는 각 처리 군으로 설정하였다. 분석 결과는 평균값(least-square mean) 및 평균값의 표준 오차(standard error of the least-square means)로 나타내었으며, 주 효과에 대한 유의성은 검정은 Tukey의 다중검정법을 이용하였다(p < 0.05). 통계 분석은 SAS 프로그램(version 9.3, SAS Institute Inc., Cary, NC, USA)을 사용하였다.
Results and Discussion
pH 및 가열 감량
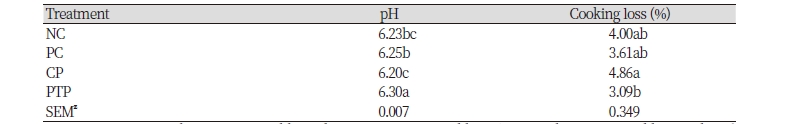
식육 균질물의 pH는 CP에서 6.20으로 가장 낮게 나타났고, PTP에서 6.30으로 가장 높게 나타났다(Table 2). 식육가공식품에 천연물 첨가 시 식육 균질물의 pH는 천연물의 pH에 영향을 받게 된다(Jung et al., 2004; Jung et al., 2007; Lee et al., 2015). Lee et al. (2015)의 연구에서 자소엽 열수 추출 분말을 쇠고기 패티에 첨가하였을 때, 자소엽 자체의 낮은 pH로 인해 자소엽 첨가 패티의 pH가 유의적으로 낮은 결과를 보였다. 그러나 본 연구에서는 이와 다른 결과가 나타났으며, 이는 자소엽 추출물 제조 시 추출물의 pH를 높이기 위해 이용된 수산화 나트륨의 영향으로 사료된다.
식육 균질물의 가열 감량은 CP에서 4.86%로 가장 높은 감량율을 보였고, PTP에서 3.09%로 유의적으로 낮은 감량율을 보였다(Table 2). 육제품의 가열 감량은 가열 시 단백질의 변성에 의해 단백질과 물 분자간의 결합력이 저하되어 발생되며, 그 외에도 식육의 pH 및 이온 강도에 의해 달라질 수 있다(Shin et al., 2017). pH는 식육에 있어 보수력에 중요한 영향을 미치는 요소로, 식육의 pH가 식육 근원섬유 단백질의 등전점(pH 5.2 - 5.4)에 가까워짐에 따라 단백질과 수분의 결합력이 약해지고 단백질 간의 결합력이 강해진다. 그로 인해 식육 내에 수분이 존재할 수 있는 공간이 감소하게 되고, 식육 내의 수분은 외부로 용출되어 식육의 보수력을 저하시키게 된다(Huff-Lonergan and Lonergan, 2005). 본 연구에서 처리군에 따라 식육 균질물의 pH가 유의적인 차이를 보였으며, PTP에서 가장 낮은 감량율을 보인 이유는 PTP의 pH가 다른 군에 비해 높아 PTP의 보수력을 증가시켰기 때문으로 사료된다.
염지 육색소 및 잔류 아질산 함량
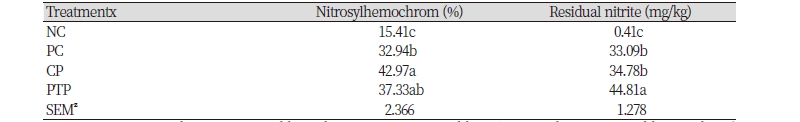
식육가공품에 첨가된 아질산은 oxymyoglobin (Fe2+)의 산화나 삼산화 이질소(N2O3) 생성 등의 과정을 거쳐 일산화 질소(NO)를 생성하게 된다(Sebranek, 2009). 생성된 일산화 질소는 마이오글로빈과 결합하여 nitrosomyglobin을 생성하고, 이 nitrosomyoglobin이 열처리에 의하여 염지 육색소인 nitrosyl-hemochrome을 생성하면서 염지 육색을 발현시키게 된다(Sebranek, 2009). 본 연구에서의 염지 육색소(nitrosyl-hemochrome) 함량은 아질산을 첨가한 군들이 NC에 비해 유의적으로 높게 나타났으며, 그 중 CP에서 42.97%로 가장 높았다(Table 3). PTP의 염지 육색소 함량은 37.33%로 CP 및 PC (32.94%)와 유의적인 차이를 보이지 않았다. 염지 육색소 함량은 생성된 일산화 질소 양에 영향을 받으며, 일산화 질소 생성량은 식육 균질물의 pH, 항산화제 이용 유무, 가공 및 가열 조건에 영향을 받게 된다(Sen and Baddoo, 1997). 아질산의 일산화 질소로의 환원은 pH가 낮을수록 가속화되며, 항산화 물질 첨가 시 항산화 물질이 환원제로서 역할을 하여 일산화 질소로의 환원을 증진 시키게 된다(Pegg and Shahidi, 2000). 따라서 본 연구에서 CP에서 pH가 가장 낮았기 때문에 염지 육색소 생성량이 가장 높은 것으로 사료되며, PTP의 경우 pH가 가장 높았음에도 불구하고 염지 육색소 함량이 CP와 차이가 없는 것은 자소엽 추출물에 포함되어 있는 폴리페놀 물질들이 환원제로서 작용하였기 때문인 것으로 사료된다.
첨가된 아질산은 식육가공품이 제조된 후 일부의 아질산은 마이오글로빈과 결합하여 염지 육색소를 생성할 뿐만 아니라 지방 및 단백질과 결합하게 되고, 잔류된 아질산은 육 가공품 저장 시 부패 및 병원성 미생물의 증식을 억제하는 역할을 한다(Honikel, 2008). 본 연구 결과 아질산 소재를 첨가한 군의 잔류 아질산 함량은 처리군에 따라 유의적인 차이를 보였고, PTP (44.81 mg/kg), CP (34.78 mg/kg), PC (33.09 mg/kg) 순으로 나타났다(Table 3). 잔류 아질산 함량 차이는 원료육의 종류, 육의 pH, 아질산 첨가량, 환원제 이용 여부, 가공 및 저장 시 온도에 의해 다르게 나타난다(Honikel, 2008). 본 연구의 결과 처리구 간의 유의적인 차이를 보인 이유로는 첨가된 아질산이 환원되어 생성된 일산화 질소가 마이오글로빈 및 유리철과 결합하여 각각 염지 육색소 생성 및 햄철 안정화를 통한 지질 산화 억제에 이용된 것으로 사료되며, PTP에서 유의적으로 높은 잔류량을 보인 것은 자소엽이 가지는 항산화 활성으로 인해 아질산의 지질 산화 억제 활성이 감소함에 따라 나타난 결과로 사료된다(Estévez and Cava, 2004; Jun et al., 2014).
육색
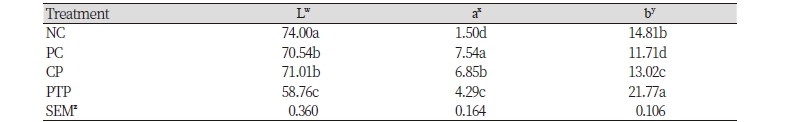
식육가공식품 제조 시 아질산 소재의 첨가는 아질산 소재를 첨가하지 않은 식품과 비교하여 염지 육색의 발현과 함께 적색도가 증가하고 명도 및 황색도가 감소한다(Jung et al., 2015b). 이와 동일하게 본 연구에서도 아질산 소재로 아질산 나트륨 및 샐러리 파우더를 첨가한 PC 및 CP에서 아질산 소재를 첨가하지 않은 NC와 비교하여 유의적으로 적색도가 증가하고 명도 및 황색도가 감소함이 나타났다(Table 4). 플라즈마 처리된 자소엽 추출물을 아질산 소재로 이용한 PTP의 경우 NC와 비교하여 명도가 감소하고 적색도가 증가하는 결과를 보였지만, 황색도가 높음이 나타났다. 또한 PC 및 CP와 비교하여 PTP의 명도 및 적색도가 유의적으로 낮고 황색도는 유의적으로 높음이 확인되었다. 기존 연구에 따르면 식육가공식품에 천연 첨가물 이용시 식육가공식품의 육색이 천연 첨가물 자체의 색에 크게 영향을 받음을 보고하고 있다(Ahn et al., 2007; Lee et al., 2015). 따라서 본 연구에서 자소엽 추출물 자체의 색으로 인해 가열 식육 균질물의 육색이 영향을 받는 결과가 나타났다. 하지만 자소엽 추출물을 우육 패티에 천연 첨가물로 이용한 기존 연구에서 패티의 적색도가 증가함을 보고하였다(Lee et al., 2015). 본 연구의 결과는 기존 연구 결과와 달랐는데, 이러한 결과는 저온 플라즈마 처리에 의해 자소엽 추출물 내 크로로필 및 안토시아닌과 같은 색소 물질이 분해되어 추출물의 변색이 일어나 식육가공식품에 첨가 시 육색에 미치는 영향이 다른 것으로 사료된다 (Lacombe et al., 2015; Lee et al., 2015; Sarangapani et al., 2017).
지질 산화
가열한 식육 균질물의 지질 산패는 NC에 비해 CP와 PTP에서 유의적으로 낮게 나타났다(Fig. 1). 또한 NC와 PC간의 유의적인 차이는 보이지 않았으며, PC와 CP 및 PTP간의 유의적인 차이 역시 나타나지 않았다. 식육 및 식육 가공품에서 지질 및 단백질 산화는 이들의 관능적 및 영양적 품질을 저하시키는 주요 원인이 된다. 이러한 산화는 가공 과정 및 저장 기간 중에 발생하며, 여러 종류의 자유 라디칼에 의해 발생하게 된다(Kanner, 1994). 자유 라디칼에 의해 발생한 화학적 산화는 식육 및 식육 가공품의 조직감 저하, 독성물질 및 악취를 생성하며, 육색소의 변질을 일으켜 관능적 품질을 저하시킴으로 인해 소비자 기호도 저하에 영향을 미치게 된다(Xiong, 2000). Lee et al. (2015) 및 Lee et al. (2017b) 에 따르면 자소엽 추출물을 쇠고기 패티에 첨가 및 돈 등심에 주입시, 패티 및 등심의 저장 중 지질 산패를 억제 하였다고 보고하였으며, 식물 추출물을 식육가공식품에 첨가 시에 식물 추출물에 함유 되어 있는 폴리페놀 및 플라보노이드의 항산화 효과로 인해 쇠고기 패티의 지질 산패를 억제했음을 확인 하였다(Hong et al., 2011; Jongherg et al., 2011). 따라서, 본 연구에 첨가된 자소엽 분말의 양이 샐러리 분말에 비해 적었음에도 처리구 간의 유의적인 차이가 나타나지 않았던 것은 자소엽 추출물이 강한 항산화 활성을 지닌 폴리페놀 및 플라보노이드를 다량 함유하고 있으며, 이들의 전자 공여능으로 인한 자유 라디칼 소거 활성 및 metal chelating 활성에 의해 지질 산패를 억제한 것으로 사료된다(Schlesier et al., 2002; Jun et al., 2014; Lee et al., 2015).
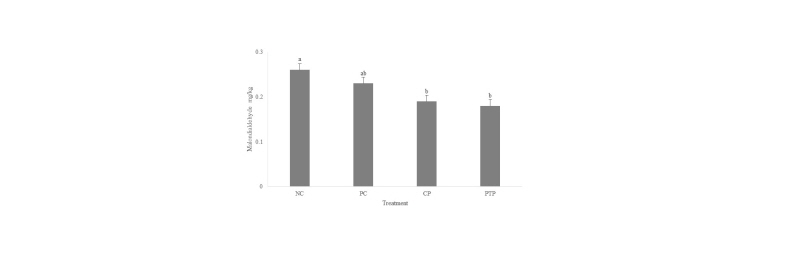
Fig. 1.Malondialdehyde content (mg/kg) of meat batter cured with sodium nitrite, celery powder, and powder of perilla frutescens var. acuta extract treated with atmospheric pressure plasma. NC, non-curing meat batter; PC, cured by sodium nitrite; CP, cured by celery powder; PTP, cured by powder of red perilla juice treated with atmospheric pressure plasma.
a - b: Different letters represent significant differences (p < 0.05).