Introduction
우리나라에서 재배되는 복숭아(Prunus persica L.)는 연화과정에서 조직이 급격히 물러지는 유형(melting type)으로 유통기간이 짧은 단점이 있어 이를 극복하기 위한 유통과정에서 신선도를 증진시킬 수 있는 기술 개발이 필요하다. 국내에서 유통되는 복숭아는 대부분 저온유통체계를 활용하지 않고 있어 유통과정에서 과육이 쉽게 물러져 부패를 촉진시키는 경우가 흔히 발생하므로 생산 시기에 많은 물량이 폐기되는 단점이 있으므로, 유통성 증진을 위한 우리 실정에 맞는 관리기술 개발이 요구된다.
키토산은 갑각류, 곤충의 외골격 및 곰팡이 세포벽의 구성성분인 키틴을 탈아세틸화 처리하여 제조한 ß-(1,4)-2-amino-2-deoxy-D-glucose로 천연 항균물질로서 독성이 없고 인체에 무해하여(Bautista-Bañosa et al., 2006) 미국 Food and Drug Administration (FDA)에서 식품 첨가제로 승인되었다(Knorr, 1986). 키토산은 불용성인 키틴과 달리 약산성에서 쉽게 용해되어 활용도가 높고(Shahidi et al., 1999; Pillai et al., 2009) 고분자의 양이온 다당류 중합체로(El-Ghaouth et al., 1991), 생체 적합성(Mi et al., 2002; Hsu et al., 2011), 무독성(Shi et al., 2006), 항균 활성(Rabea et al., 2009)을 보여 산업적으로 널리 활용되고 있다(Kumar, 2000; El-Hadrami et al., 2010; Cota-Arriola et al., 2013).
키토산의 항균성은 처리한 키토산이 미생물의 세포막과 결합하여 세포 내용물을 누출시키거나 키토산의 아민류가 미생물 세포를 감싸 포자 생장을 억제할 가능성이 제시된 바 있다(Goy et al., 2009). 키토산은 포도와 딸기의 Botrytis cinerea와 배의 흑반병을 야기하는 Alternaria kikuchiana Tanaka균과 Physalospora piricola Nose균의 포자 발아와 균사 생장을 억제한다고 하였다(Meng et al., 2010).
Du et al. (1997)도 ‘Hakuho’ 복숭아, ‘신고’ 배, ‘헤이워드’ 키위에 있어 수확 후 키토산 처리는 처리 농도가 높을수록 경도 유지에 효과적이었고 호흡 및 에틸렌 발생을 억제하여 숙기를 지연시키고 부패를 경감시켰다고 하였고 망고에서도 저장 중 과실 연화를 지연시켜 품질 유지에 효과적이라고 하였다(Zhu et al., 2008).
Meng et al. (2008)은 포도에 키토산 수확 전 및 수확 후 처리를 비교하였는데, 수확 전 처리 시 낮은 농도에서 부패 억제에 효과가 있다고 하였으며, Ahn et al. (2014)은 ‘설향’딸기에서 수확 전에 키토산과 칼슘을 혼용 처리하여 부패를 지연시킬 수 있다고 보고 하였다. 라즈베리에 대한 연구(Tezotto-Uliana et al., 2014)에서 수확 전 처리는 수확 및 저장 중 경도를 높게 유지시켰으나 수확 후 처리는 오히려 연화를 촉진하였으며 이에 대한 이유로 처리 후 건조 과정이 올바르지 않았을 것으로 추정하였고, Prashanth et al. (2016)도 처리한 키토산이 충분히 건조되지 않을 경우 오히려 부패를 증가시킬 가능성을 제기하였다.
오렌지에서 수확 전 키토산 처리는 과실 비대와 수확량을 높였는데 이는 키토산이 잎의 엽록소 함량을 증진시켰고 수확기에 당과 호르몬 함량을 높여 식물 생육에 도움을 주었기 때문이라고 고찰하였다(Ahmed et al., 2016). Modal et al. (2012)은 오크라에 대한 수확 전 키토산 처리가 수체 신장, 엽수 증가를 일으키며 과실 비대를 통해 수확량을 증가시킨다고 하였으며, 딸기에서도 수체의 영양생장은 물론 과실 비대를 촉진시켰다(Abdel-Mawgoud et al., 2010).
한편, 다양한 원예작물에 대한 칼슘의 저장성 증진 효과(Chung et al., 1993)는 널리 알려져 있으나, 칼슘은 세포 내로 이행이 어려워 반복적으로 처리한 경우에도 생체 내 농도 차이가 크지 않고 고농도 칼슘 살포는 오히려 피해를 일으키기도 한다(Manganaris et al., 2005). Hernández-Muñoz et al. (2008)은 키토산과 칼슘 혼용액을 딸기에 수확 후 처리한 결과, 호흡 및 감모율은 칼슘의 혼용 유무에 관계없이 키토산의 농도가 높을수록 감소하지만 경도를 유지하는 데는 칼슘 혼용 처리가 효과적이라고 하였다. 또한 망고에서 칼슘과 혼용하여 키토산을 처리한 결과, 품질 저하 없이 부패를 유의하게 억제하는 효과를 보여(Chauhan et al., 2014) 칼슘 혼용이 키토산의 효과를 높여줄 수 있는 가능성을 보여주었다.
국내 농산물에 대한 잔류농약 조사 강화로 인하여 보다 안전한 농약 대체 물질 발굴이 절실해지고 있으며 키토산은 검증된 효과적인 천연항균 물질로 본 연구에서는 키토산을 이용하여 복숭아에 대한 수확 전 처리가 품질과 저장성에 미치는 영향을 검토하고 아울러 수확기에 접근하여 관행 농약 사용을 대체할 수 있는 가능성을 찾고자 하였다.
Materials and Methods
식물 재료
복숭아 과실(Prunus persica L.)은 충남 예산의 충남농업기술원 연구포장에서 재배되는 ‘천중도백도’ 및 같은 지역의 개인 농가에서 재배되는 ‘백옥’, ‘장호원황도’를 이용하였다. 각각의 복숭아들은 관행적인 방법으로 재배하였으며 ‘천중도백도’는 2015년 8월 11일, ‘백옥’은 2017년 7월 19일, ‘장호원황도’는 2017년 9월 17일에 각각 수확하였다.
처리 용액 제조 및 살포
처리구에 사용되는 키토산(JS Logistics, Taebaek, Korea)은 탈아세틸화 75% 이상인 제품을 사용하였으며 실험용 2.0% 키토산은 초산(acetic acid)을 넣고 교반하며 탈이온수를 가하여 산 농도를 0.5%로 조절하였다. 살포용 약제는 이를 희석하여 키토산100 mg · L-1로 조절하였다. 칼슘제는 무수 염화칼슘(Samchun Pure Chemical Co., Ltd., Pyeongtaek, Korea)을 이용하여 탈이온수에 용해한 다음 최종 살포용 약제에 각각 염화칼슘 100, 300, 600 mg · L-1이 포함되도록 하였고 단독 염화칼슘 살포액은 3,000 mg · L-1의 농도로 준비하였다. 준비된 살포 용액에 계면활성제(Perjine, Green Biotech, Paju, Korea) 0.02%를 가하였다. 처리 시기는 관행적인 수확기를 기준으로 수확 4주전부터 1주 간격으로 총 3회로 수관 전체에 살포하고 마지막 살포 1주 후에 수확하였다.
저장
저장
‘천중도백도’는 당일 분석을 제외한 과실들을 4.5 kg 골판지 상자에 난좌를 넣고 포장한 후 20℃와 15℃에 저장고에 각각 저장하였고 습도는 95% 이상으로 유지하였다. 20℃ 저장의 경우 수확 후 15일까지, 수확 당일을 포함하여 5일 간격으로 조사하였다. 15℃ 저장의 경우 30일까지, 당일 및 저장 1일차를 포함하여 5일 간격으로 분석하였다.
‘백옥’은 농가에서 실제 사용되는 수확 후 관리 방법에 대한 효과를 검증하기 위해 당일 분석을 제외한 과실들은 관행적인 방법으로 그늘진 창고에 저장하였다. 온도는 일정하지 않으나 28 - 30℃ 내외였으며 습도는 약 50 - 60% 이상의 조건에서 5일간 저장하였다.
‘장호원황도’는 수확 당일에 처리별로 수확한 과실을 모두 무게를 조사하여 수확전 키토산 처리가 과실 생장에 미치는 영향을 조사하였다. 대조구의 과실은 83개, 처리구의 과실은 96개였다.
생육 조사 및 품질 분석
과중은 전자저울을 이용하여 과실 개별 무게를 측정하였으며 과형은 digimatic caliper (IP-67, Mitutoyo, Tokyo, Japan)를 이용하여 종경 및 횡경을 측정하였다. 과피색은 색도차계(CR-400, Minolta, Tokyo, Japan)를 이용하여 L*, a*, b* 및 h°로 나타냈다.
경도는 texture analyzer (TMS-Pro, FMC, Philadelphia, USA)을 이용하여 직경 8 mm 의 원형 probe를 장착하여 깊이 5 mm까지 침투시켜 최대 하중 값을 Newton으로 환산하여 표기하였다. 가용성 고형물 함량은 4겹의 cheese cloth를 이용하여 착즙하여 얻은 과즙을 굴절당도계(PR-32α, Atago, Tokyo, Japan)를 이용하여 측정했으며 산 함량은 과즙 5 mL에 탈이온수 35 mL를 가한 후 0.1 N NaOH로 pH 8.3으로 적정한 후 사과산으로 환산하였다.
호흡 및 에틸렌 조사
호흡 및 에틸렌 측정은 3.4 L의 밀폐 용기에 넣어 상온에서 2시간 방치 후, 용기 내부의 가스를 주사기로 1 mL 포집한 후 각각 FID 및 TCD가 장착된 gas chromatograph (GC-14B, Shimadzu, Kyoto, Japan)로 측정하였다. 과실 내부 가스 조사는 물에 넣은 과실에 진공 환경을 부여하여 내부 가스를 포집한 후 이 중1 mL를 취하여 TCD를 장착한 gas chromatography (GC-14D, Shimadzu, Kyoto, Japan)로 분석하였다.
부패 및 병해 평가
부패 및 병해 평가는 육안으로 관찰하여 발생 정도에 관계없이 발생 유무로 조사하여 백분율로 표시하였다.
통계분석
생육 조사만 실시한 ‘장호원황도’ 시험을 제외하고 모든 실험은 완전임의배치법으로 진행하였으며 실험 조사는 3반복으로 실시하였고, 통계분석은 SPSS Software package ver. 21.0 (SPSS Inc., Chicago, IL, USA)를 이용하여 Duncan 다중검정법으로 분석하였다.
Results and Discussion
과실 생장에 미치는 영향
‘천중도백도’의 과실 무게는 키토산 100 + 칼슘 100 mg · L-1처리구에서 가장 높은 310.0 g, 칼슘 3,000 mg · L-1 처리구에서 가장 낮은 252.5 g으로 조사되었다. 키토산 100 mg · L-1단독 처리구와 칼슘 300 mg · L-1 혼용구에서도 각각 309.0 g과 307.6 g으로 비교적 과중이 높았지만 칼슘 함량이 높을 경우 과실 비대 효과가 감소되었다(Fig. 1). 비록 처리한 키토산 농도는 다르지만 딸기(Abdel-Mawgoud et al., 2010), 오크라(Modal et al., 2012), 오렌지(Ahmed et al., 2016), 파프리카(Ghoame et al., 2010), 토마토(El-Tantawy, 2009)에서도 수확 전 처리로 과중이 증가하였다고 보고되었다. 딸기는 수확 전 칼슘 처리가 과중을 증가시켰다고 하였으나(Singh et al., 2007) 본 실험에서는 칼슘 단독처리에 의한 과중이 증가되지는 않았으며 키토산 단독 처리구에서도 과중이 증가한 결과를 고려할 때 키토산이 과중을 증가시키는 요인으로 판단된다. 키토산이 과중에 미치는 기작에 대해서는 명확하게 밝혀지지 않았지만 El-Tantawy (2009)는 토마토에서 수확 전 키토산 처리는 엽록소 a, b와 카로티노이드와 같은 광합성 관련 색소를 증가시켰고, 과실과 잎의 건물중이 증가하는 등 순광합성량이 증가하여 동화산물의 축적이 증가했을 가능성을 제기하였으나 오크라와 딸기에서는 과중은 증가하였지만 엽록소의 함량은 차이가 없어(El-Miniawy et al., 2013) 광합성 작용 이외의 요인도 관여했을 것으로 추정된다.
과중 증가는 과형 변화를 초래하여 과폭이 과고보다 증가하여 과형 지수는 무처리구의 0.95보다 낮은 0.91 - 0.92로 과실 형태는 편원형에 가까워졌다(Table 1). 오크라의 경우 키토산 처리 시기가 이른 경우, 과실 길이를 증가시켰으며(Modal et al., 2012), 수확 한달 전에 키토산을 처리 한 오렌지의 과형을 편원형으로 변화시켰다고 하여(Ahmed et al., 2016) 수확 전 키토산 처리는 후기 과실 생장을 변화시키는 것으로 판단된다.
‘백옥’ 품종은 농가에서 저온 저장을 하지 않는 상황을 고려하여 관행적인 그늘진 창고 안에 적재하여 저장하였다. 실외인 관계로 온도 및 습도는 자연상태에 두었는데 실험 중 한낮의 최고기온은 28 - 30℃, 상대습도는 50 - 60%의 수준이었다. 앞선‘천중도백도’와 달리 과실 경도는 수확 당일부터 키토산 100 + 칼슘 100 mg · L-1처리구에서 4.9 N으로 무처리구의 4.0 N보다 높았다 (Fig. 2). 저장 2일에는 키토산 100 + 칼슘 100 mg · L-1 처리구가 2.9 N인데 반해 무처리구는 1.2 N으로 급격하게 연화되었으며 저장 5일에도 키토산 100 + 칼슘 100 mg · L-1 처리구에서 1.7 N, 무처리구 0.7 N으로 처리구에서 높게 유지되었다. 가용성고형물의 경우 수확 당시에는 키토산100 + 칼슘 100 mg · L-1 처리구에서 11.5°Brix로 무처리구의 10.5° Brix보다 높았으나 저장 2일 이후에는 처리에 따른 차이가 나타나지 않았다(자료미제시). 수확 당시에는 과실의 비대 정도 혹은 개체간의 차이로 인해 당도차가 발생한 것으로 생각되며 이후의 품질에서는 처리에 따른 차이를 발견할 수 없었다.
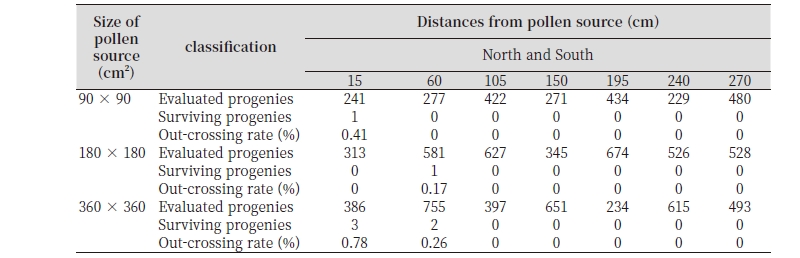
‘장호원황도’는 키토산 100 + 칼슘 100 mg · L-1혼용 처리구에서 과실의 비대 효과가 확연히 나타났다(Fig. 3). 무처리구의 경우 평균 과중이 283.2 g인데 반해 처리구의 평균 과중은 353.2 g으로 과중이 약 25% 증가하였고 최소 과중은 물론 최고 과중에서도 현저한 차이를 보여주었으며 300 g이상의 과실 비율도 대조구의 33.3%에 비하여 처리구는 81.9%로 현저한 차이를 보였다. 따라서 대과비율(300 - 450 g)도 처리구에서 2배 이상 증가하였다. ‘천중도백도’보다 과중 증가가 뚜렷한 결과는‘장호원황도’는 만생종으로 생장 3 기에 급속한 비대 생장이 발생하는 품종 특성에 기인한 것으로 생각된다.
과실 조직 내부의 가스를 분석한 결과, 처리구의 이산화탄소 함량은 무처리구보다 높았는데(Fig. 4) 키토산 100 + 칼슘 600 mg · L-1 처리구를 제외하고 칼슘의 농도가 높을수록 내부 이산화탄소 함량도 높은 경향이었다. 키토산 100 mg · L-1 단독 처리구도 1.8%로 대조구보다 높아 키토산 및 칼슘 처리가 과실 표면에 피막을 형성하여 가스 유출입을 통제하므로 내부 이산화탄소의 함량을 높이는 것으로 보인다. 잎에서도 키토산 피막이 엽육 세포 내 이산화탄소의 농도를 높여 광합성과 건물 생산에 유리하게 작용하였을 가능성도 배제할 수 없다(Kim and Lee, 2001). 과실 내부 조직의 이산화탄소 증가는 해당작용에서 fructose-6-phosphate의 fructose-1,6-bisphophate로의 전환을 억제시켜 결국 호흡을 억제하므로(Kerbel et al., 1990) 광합성 산물의 소모를 감소시키므로 과실중을 높여준 것으로 추정된다. 본 연구의 결과를 종합해 볼 때 수확 전 키토산 처리는 복숭아 과중을 증가시키며 내적 품질 증진에도 기여할 것으로 판단된다.
신선도 유지에 대한 영향
수확한 ‘천중도백도’를 상온 유통 조건과 유사한 20℃에서의 저장 중 품질 변화를 조사하였다. 수확 당일의 과실 경도는 키토산 100 + 칼슘 600 mg · L-1 처리구에서 가장 높은 24.9 N이었고 키토산 100 + 칼슘 100 mg · L-1 처리구가 가장 낮은 21.1 N이었으며 다른 처리구에서는 통계적으로 차이가 없었다(Table 2). 그러나 20℃에 저장한 이후에는 칼슘 3,000 mg · L-1와 키토산 100 + 칼슘 600 mg · L-1 처리구에서 경도가 높은 경향이었고 키토산 100 mg · L-1 단독 처리구에서 경도가 가장 낮았다. 저장 5일에는 칼슘 단독 및 혼용 처리구들이 통계적으로 유의하게 높았으며 특히 칼슘 농도가 높을수록 경도가 높게 유지되는 경향이었다. 키토산 100 mg · L-1 단독 처리구의 경우 저장 5일 및 10일에서 경도가 낮게 조사되어 키토산 처리에 의한 과실의 연화 억제 효과는 관찰되지 않았다.
키토산 및 칼슘 처리에 의한 신선도 유지 효과는 통계적으로 유의하게 관찰되지 않았으며 모든 처리구의 과실이 처리에 상관없이 저장 5일에 급격히 경도가 감소하였는데 저장 온도가 높아 키토산에 의한 대사작용 조절 효과가 떨어지기 때문으로 추정된다. Zhang and Watkins (2005)는 작물에 대한 이산화탄소 처리에 의한 경도 유지 효과도 온도에 따라 달라진다고 보고하였다.
대표적인 과실 품질 지표인 가용성 고형물 함량은 키토산 처리와 관계없이 칼슘 처리 농도가 높을수록 낮은 경향이었지만 저장 기간에 따른 감소율은 처리 간 차이가 크지 않았다(Table 2). 반면에 산 함량은 칼슘의 농도가 높을수록 높았으며 저장 기간 중에도 높게 유지되는 경향을 보였다.
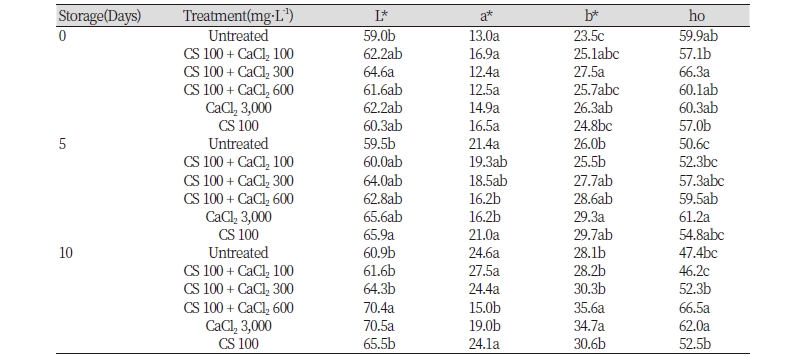
과피색은 수확 당시의 L*값은 무처리구에서 다소 낮았고 처리구에서 높은 경향이었으나 처리간 저장에 따른 변화는 크지 않았다(Table 3). 또한 과실 간 편차가 커 수확 당시의 a*값은 통계적인 유의차를 보이진 않았으나 저장 이후에는 키토산 100 + 칼슘 600 mg · L-1처리구와 칼슘 3,000 mg · L-1단독 처리구에서는 a*값 증가가 완만하였다. b*값도 과실간 편차가 커서 통계적으로 유의한 차이를 보이지 않았지만 저장 이후에는 a*값과 반대로 칼슘의 농도가 높은 처리구에서 높게 유지되었다. 과피의 hue angle은 수확 당일 칼슘 농도가 300 mg · L-1 이상의 처리구들이 전반적으로 높은 값을 보였다. 따라서 과피색 변화는 키토산 또는 칼슘처리로 크지 않았고 저장 중에는 이들 처리가 과피색 변화를 다소 지연시키는 것으로 판단된다. 특히 칼슘농도가 높을 때 더욱 뚜렷하였으며 무처리구, 키토산 100 + 칼슘 100 mg · L-1과 키토산 단독처리구는 저장에 따른 색도 변화가 유사하여 이들 처리는 과실 후숙에 대한 영향이 없는 것으로 보인다. Bhaskara Reddy et al. (2000)은 딸기에서 키토산 처리 농도가 높거나 반복적으로 처리했을 시 성숙을 지연시킨다고 하였으나 본 실험에서 사용된 농도는 기존의 보고보다 낮은 농도로 처리하여 성숙을 지연시키지 않은 것으로 판단되므로 수확 전 처리 시 농도를 조절한다면 숙기 지연을 예방할 수 있을 것으로 판단된다.
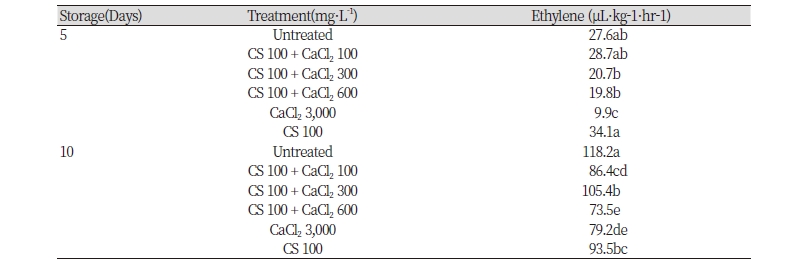
에틸렌 발생량은 칼슘 농도가 높을수록 낮은 경향이었는데 특히 과중이 가장 낮았던 키토산 100 + 칼슘 600 mg · L-1처리구와 칼슘 3,000 mg · L-1 단독 처리구에서 저장 5일후부터 에틸렌 발생량이 뚜렷하게 낮았다(Table 4).
부패는 저장기간이 길어질수록 증가하였는데 무처리구 과실은 부패율도 높았고 과실 전체가 균사에 덮일 정도로 부패 진행 정도가 심하였던 반면 키토산 처리 과실은 부패 부위가 매우 제한적인 경향이었다(자료 미제시). 또한 부패과 발생이 저장초기에만 국한된 경우도 있어 수확 및 선별과정에서 받은 물리적 손상이 부패를 일으키는 중요한 변수가 될 것으로 추정되었으며 본 연구에서는 조사한 과실수가 적어 자료를 제시하지 않았다.
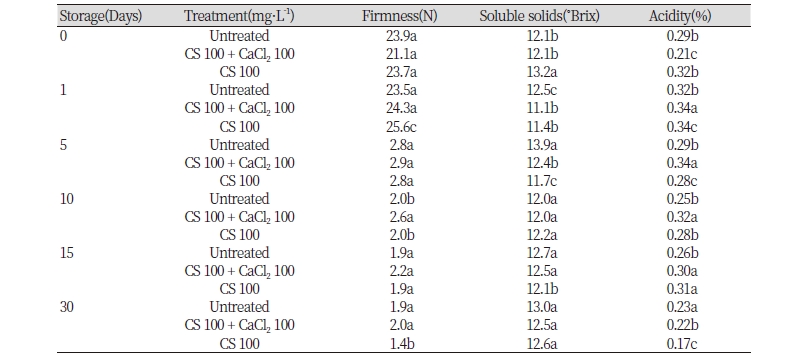
유통기간 증진을 위하여 저장 온도 15℃에서의 품질 변화를 조사하였다. 앞선 20℃ 저장 실험에서 효과적이었던 키토산 100 + 칼슘 100 mg · L-1처리구는 15℃ 저장 조건에서도 경도의 차이를 뚜렷하게 보였다(Table 5). 본 실험에서도 칼슘 혼용구들이 저장 10일에 연화를 유의하게 억제시켜 주었으며 특히 과실의 비대 효과가 뚜렷했던 키토산 100 + 칼슘 100 mg · L-1 처리구는 키토산 단독처리구와 달리 경도를 높게 유지시켜 주어 혼용된 칼슘이 과실의 경도를 유지하는데 기여하여 기존의 연구와 유사한 결과였다(Hernández-Muñoz et al., 2008; Chauhan et al., 2014). 특히 연화가 심하였던 저장 10일에는 키토산 100 + 칼슘 100 mg · L-1 혼용 처리구에서 유의하게 경도가 높게 조사되었다. 저장 15일에는 통계적인 차이가 없었지만 키토산 100 + 칼슘 100 mg · L-1혼용 처리구에서 경도가 높은 경향이었다. 저장 30일에는 무처리구와 유사한 수준으로 키토산 살포 효과는 관찰되지 않았지만 전체적인 과실 외관은 우수하게 유지되었다.
과실 표면의 코팅 처리는 내부 이산화탄소의 함량을 높여 성숙을 지연시키는데(Banks, 1985) 수확 후 높은 이산화탄소 조건은 과실의 품질 유지에 도움이 되며(Deily and Rizzi, 1981), 딸기의 경우 부패, 호흡과 에틸렌 생성을 억제하였으며(Ke et al., 1991) 경도를 높이거나 경도 저하를 완화시킨다고 보고되었다(Smith and Skog, 1992; Watkins et al., 1999). 키토산을 살포할 경우 과실 표면에 피막이 형성되어 가스 유출입을 제어하므로 (Bai et al., 1988; Elsabee and Abdou, 2013) 과실 내부조직의 산소, 이산화탄소, 에틸렌의 조성을 변화시키고(Hagemaier, 2005; Meng et al., 2008), 내부조직에 집적된 이산화탄소 및 산소의 감소는 과실 경도를 유지시키고 신선도 유지에 효과적이라고 하였다(El-Ghaouth et al., 1992). 복숭아에 대한 수확 후 처리는 2% 이상의 키토산 농도에서 경도 유지와 성숙 지연이 관찰되었으며(Du et al., 1997), Ahn et al. (2014)은 딸기에서 수확 전 키토산 + 칼슘을 처리한 과실을 수확 후 고농도의 이산화탄소 환경에 노출시킬 때 ethanol insoluble solids (EIS) 결합형 칼슘이 증진되어 연화 억제 효과를 확인한 바 있다. 높은 이산화탄소 농도가 칼슘의 내부 이행과 세포벽 결합형 칼슘 농도를 증가시켜 과실의 경도를 높여준다고 하였는데(Wang et al., 2014), 혼용한 칼슘은 경도 증진에 기여할 것으로 추정되며 유사한 결과가 배에서 키토산 처리로 유발된 이산화탄소 축적이 성숙을 지연시키고(Du et al., 1997), 키위 및 라즈베리에서도 키토산 처리는 일정 기간 동안 경도를 유지시킨다고 보고되었다(Tezotto-Uliana et al., 2014; Lee et al., 2015).
가용성 고형물 함량은 저장 기간 동안 무처리구에서 다소 높은 경향이었지만 일정한 변화는 관찰되지 않았다(Table 5). 산 함량은 가용성 고형물과는 반대로 무처리구의 경우 저장 이후 빠르게 감소되었지만 키토산 단독 및 칼슘 혼용처리에서는 산함량 감소가 지연되는 경향이었다. 따라서 당산비는 대조구에 비해 전반적으로 낮았다(Table 5).
과실의 색차는 처리에 따른 유의한 변화는 나타나지 않았다(자료 미제시). L*값의 경우 저장 이후에도 거의 변화가 없었으며 처리간 차이도 관찰되지 않았다. a*값의 경우 저장 5일 이후에 무처리구에 비해 키토산 처리구들이 증가폭이 다소 완만하였으나 15일 이후에는 처리간 차이가 없었다. b*값은 저장 일수가 길어질수록 모든 처리구에서 소폭 증가하였으며 키토산 100 + 칼슘 100 mg · L-1혼용구가 무처리구에 비해 다소 높은 경향이었으나 통계적인 유의차는 없었다. Hue angle 은 저장 일수가 길어질수록 감소하였으며 처리 간에 일정한 통계적인 차이는 나타나지 않았다. 또한 저장 이후 호흡률은 일관된 결과를 나타내지 않았지만(자료 미제시) 에틸렌 생성량은 저장 5일에는 칼슘처리에 관계없이 키토산 처리에서 유의하게 낮았다. 저장 10일에는 통계적인 차이를 나타내지는 않았지만 처리구에서 낮은 경향을 보였다. 복숭아는 전형적인 클라이맥터릭형 과실로 성숙이 시작됨에 따라 에틸렌 생합성 증가 및 내생 에틸렌에 대한 감응성이 민감하게 변화하여 호흡률 상승과 함께 과실의 성숙과 노화를 촉진한다고 알려져 있다(Rasori et al., 2002). 또한 복숭아의 연화는 에틸렌에 의존적이며(Brummell et al., 2004), 내부의 낮은 산소 및 높은 이산화탄소의 조성은 에틸렌 생합성을 억제한다고 보고되었다(Li and Yu, 2001).
본 실험 결과에서 키토산 및 칼슘 처리구들은 수확기에 내부 이산화탄소를 높였으며 저장 중 에틸렌 생성을 저하시키고 과실의 연화가 지연되어 기존의 보고와 일치하였다(Bhaskara Reddy et al., 2000). 다만, 전술한 20℃ 저장에서는 이러한 차이가 불명확했는데 과실의 대사작용이 온도의 영향을 크게 받는 점을 고려한다면 20℃에서 성숙도 빨라져 에틸렌 생성 억제 효과가 분석 간격일인 저장 5일차 이전에 발생했을 것으로 추측되었다. 과실 부패는 처리에 관계없이 20℃에서 더욱 빠르고 많이 발생한 반면 15℃에 저장한 과실에서는 처리와 저장 기간에 관계없이 간헐적으로 관찰되어(자료미제시) 처리간 차이보다는 수확과 수확 후 처리 과정에서 발생한 물리적 손상의 영향을 받은 것으로 추정되었다.
본 연구 결과를 종합적으로 살펴볼 때 복숭아 신선도 유지를 위한 수확 전 키토산 살포는 상온 유통하는 우리나라의 환경에서는 과실 경도를 유지시키고 부패를 지연시키므로 매우 유용한 재배적 수단으로 판단된다.
Conclusion
수확 전 키토산 살포처리가 복숭아 과실의 품질과 신선도 유지에 미치는 영향을 알아보기 위하여 본 실험을 수행하였다. 키토산 살포는 수확기 복숭아 과실의 과중을 증가시키고 과형을 변화시켰다. 키토산-칼슘 혼용구는 과실의 연화를 지연시켜 신선도를 유지하는데 기여하였으나 저장 온도에 따라 지속성이 달리 나타났다. 과실의 내부 품질은 키토산보다는 칼슘 농도에 의해 영향을 받았으며 칼슘의 농도가 높을수록 과실의 성숙이 지연되었다. 이상의 결과를 고려할 때 수확 전 키토산 처리는 복숭아 과실의 수확량과 신선도 유지를 향상시킬 수 있는 재배적 방법으로 판단된다.