Introduction
활성산소에는 hydroxyl radical (OH·), superoxide radical (O2-), hydrogen peroxide (H2O2) 등이 있으며 체내에서 생성되어 세포 신호 전단 및 각종 감염으로부터 세포를 보호하는 작용을 하지만 과량의 활성산소는 생체를 구성하는 분자인 단백질, 지질 및 핵산 등과 반응하여 손상을 유발하여 다양한 질환의 원인으로 알려지고 있다(Bajpai et al., 2017). 이러한 활성산소를 억제하기 위한 물질에는 항산화 효소인 catalase, superoxide dismutase (SOD), glutathione peroxidase 등과 합성 산화방지제인 butylated hydroxy anisole (BHA)와 butylated hydroxytoluene (BHT) 등이 있다. 식품과 화장품 등의 산화 방지 목적으로 주로 합성 산화방지제를 사용했으나 독성을 가지고 있는 것이 문제가 되어 최근에는 안전한 항산화제를 탐색하고자 천연물의 기능성 연구가 활발히 진행되고 있다(Lee et al., 2003).
돌외(Gynostemma pentaphyllum)는 박과에 속하는 다년생 덩굴 식물로 주로 산이나 숲 속에서 자라며 국내에는 제주 등 남쪽 지방의 섬에 분포한다. 잎은 길이 4 - 8 cm, 폭 2 - 3 cm로 5개의 작은 잎으로 구성되어 있다. 잎의 주성분은 gypenoside, chlorogenic acid, flavonoids 등으로 항산화, 항염증 및 심혈관계 질환에 효과가 있으며 예로부터 차의 원료로 사용되어 왔다(Jeong et al., 2011; amec et al., 2016). 선행연구 결과로는 항당뇨효과(Huyen et al., 2012), 돌외 잎 70% 에탄올 추출물은 콜라겐 형성 촉진에 의한 주름개선 효능(Yim et al., 2014), 열처리된 돌외 잎의 에탄올 추출물의 암세포 억제 효과가 보고되었다(Piao et al., 2014). 또한 돌외 에탄올 추출물 및 분획물의 항산화능과 세포보호효과가 보고되어 있다(Kim et al., 2017). 하지만 추출방법을 달리하여 항산화능을 연구한 결과는 보고되어 있지 않다. 이에 본 연구에서는 돌외 잎의 60, 70% 에탄올 환류냉각 추출물, 60% 에탄올 초음파 추출물을 가지고 실험을 진행하여 각 추출조건에서 나타나는 항산화 활성을 탐색함으로써 건강 기능성 식품 연구의 기초자료로 제공하고자 하였다.
Materials and Methods
실험재료
본 실험에 사용한 돌외 잎은 (주)한라산소주(Hallasan Soju, Jeju, Korea)에서 제공받아 추출물을 제조하였다. 돌외 잎을 0.5 mm 크기 미만으로 분쇄하였으며, 환류냉각 추출물은 각각 60, 70% 에탄올을 시료 중량의 30배를 첨가하여 80℃ 온도에서 90분간 추출한 후 여과하였으며 동일 과정을 3회 반복하였다. 초음파 추출물은 60% 에탄올을 시료 중량의 30배를 첨가하였으며 초음파 추출기(Power sonic 520, Hwashin Technology Co., Seoul, Korea)를 사용하여 90분간 추출 후 여과하였고 다음의 과정을 3회 반복하였다. 여과된 추출물은 감압농축기(Hel-VAP Precision, Heidolph, Germany)를 사용하여 농축하였고 이후 동결건조하여 실험을 진행하였다.
총 페놀 및 플라보노이드 함량 측정
돌외 잎 추출물의 폴리페놀 함량은 Ko et al. (2017)의 방법을 사용하여 측정하였다. 추출물 20 μL에 증류수 700 μL를 첨가한 후 Folin-Ciocalteu 시약 100 μL를 넣어 섞어준 뒤 상온에서 2시간동안 방치하고 20% sodium carbonate를 100 μL씩 혼합하여 1시간동안 반응시켰다. 흡광도는 i-Mark microplate reader (168-1135, Bio-Rad, Hercules, USA)로 750 nm에서 측정하였다. 추출물의 흡광도는 gallic acid로 작성된 standard curve를 이용하여 GAE (gallic acid equivalent)로 나타내었다.
플라보노이드 함량은 Kim et al. (2012)의 방법을 참고하여 측정하였다. 추출물 100 μL에 ethanol 300 μL, 10% aluminum nitrate 20 μL, 1 M potassium acetate 20 μL와 증류수 560 μL를 가하여 혼합한 후 1시간동안 반응시켰다. 이후 microplate reader를 사용하여 415 nm에서 흡광도를 측정하였다. 추출물의 흡광도는 quercetin을 이용하여 작성된 standard curve를 이용하여 QE (quercetin equivalent)로 나타내었다.
1,1-diphenyl-2-picrylhydrazyl (DPPH) radical 소거능 측정
돌외 잎 추출물의 DPPH radical 소거능은 Blois (1958)의 방법을 변형하여 측정하였다. 추출물 40 μL에 0.15 mM DPPH 160 μL를 더하여 혼합한 뒤 암실에서 30분간 방치하였다. 추출물의 흡광도는 microplate reader를 사용해 490 nm에서 측정하였다. DPPH radical scavenging activity (%) = [1 - (Abs of the sample - Abs of the blank) / Abs of the control] × 100으로 나타내었다.
Trolox equivalent antioxidant capacity (TEAC) 측정
2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical 소거능 측정은 Zulueta et al. (2009)의 방법을 변형해서 측정하였다. 7 mM ABTS와 2.45 mM potassium persulfate를 혼합시킨 후 암실에서 하루 동안 방치시켜 생성된 ABTS radical은 실험하기 전 734 nm 파장에서 optical density 값이 0.70 ± 0.02가 되도록 한 후 본 실험에 사용하였다. ABTS 1 mL에 추출물 50 μL를 가하여 5분간 반응시키고 UV-spectrometer (UV-1800, Shimadzu, Japan)를 이용해 734 nm에서 흡광도를 측정하였다. Trolox를 사용해 standard curve를 작성하고 추출물 1 g당 trolox 농도(mM trolox equivalent [TE]/g)로 나타내었다.
Ferric reducing antioxidant power (FRAP) 측정
FRAP은 Benzie and Strain (1996)법을 참고하여 측정하였다. FRAP working solution은 0.3 M sodium acetate buffer (pH 3.6), 20 mM FeCl3, 10 mM 2,4,6-tripyridyls-triazine (TPTZ)를 10 : 1 : 1의 비율로 혼합한 후 37℃에서 30분간 반응시켜 사용하였다. 추출물 50 μL에 FRAP working solution 150 μL를 가하며 37℃에서 15분간 반응시켰다. 이후 microplate reader를 사용해 595 nm에서 흡광도를 측정하였다. FeSO4를 사용해 standard curve를 작성하고 추출물 1 g당 FeSO4 환원력(mM FeSO4/g)으로 나타내었다.
Oxygen radical absorbance capacity (ORAC) 측정
돌외 잎 추출물의 ORAC 지수 분석은 Hwang et al. (2013)의 방법을 변형하여 측정하였다. Black 96-well plate에 추출물 50 μL와 78 nM fluorescein 용액 150 μL를 첨가 후 37℃에서 10분간 반응하였다. 이후 반응액에 221 mM 2,2'-azobis(2-aminopropane) dihydrochloride (AAPH)를 첨가하였으며 fluorescence microplate reader를 이용하여 excitation 485 nm emission 535 nm에서 1분 간격으로 1시간동안 형광도를 측정하였다. Trolox를 표준시약으로 사용하였으며 각 추출물과 표준시약의 area under the curve (AUC) 값을 작성하였다. ORAC 지수는 trolox로 작성된 표준검량곡선에 따라 1 g당 trolox 농도(mM TE/g)로 나타내었다.
Phenolic acid 정량 분석
돌외 잎 추출물의 phenolic acid 정량은 high-performance liquid chromatography (HPLC-DAD, Shimadzu, Japan)를 사용하여 분석하였다. Column은 YMC-Triart C18 column (250 × 4.6 mm I.D. 5 μM Hybrid silica-based ODS, YMC, Korea)를 사용하였고 이동상은 용매 A와 B로 A상은 trifluoroacetic acid가 0.1% 함유된 증류수, B상은 trifluoroacetic acid가 0.1% 함유된 메탄올을 사용하였다. 용매조건은 A: 90%, B: 10%로 시작하여 10 min에 A: 80%, B: 20%, 20 min에 A: 75%, B: 25%, 30 min에 A: 72.5%, B: 27.5%, 45 min에 A: 60%, B: 40%, 50 min에 A: 40%, B: 60%, 55 min에 A: 0%, B: 100%, 62 min에 A: 90%, B: 10%로 하여 분석하였다. 유속은 1 mL/min으로 하였고 column의 온도는 40℃로 고정하여 분석하였으며 검출파장은 260 nm를 사용하였다. 각 standard는 methanol에 녹여 6.25, 12.5, 25, 50, 100, 200 μg/mL로 만들어 검량선을 작성하여 정량하였다.
통계분석
본 연구는 3회 반복 실험하였고 실험 결과는 average ± standard deviation으로 나타내었고, 각 실험군의 통계처리는 SPSS (Statistical Package for the Social Sciences, ver 18.0, SPSS Inc., Chicago, USA)를 사용하여 분산분석을 실시하였다. 유의적 차이가 있는 항목에는 Tukey의 다중범위검정(Tukey Multiple Range Test, TMRT)을 사용하여 통계학적 유의성을 분석하였다(p < 0.05).
Results and Discussion
총 페놀 및 플라보노이드 함량
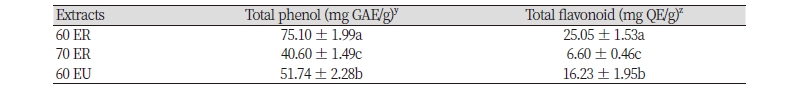
돌외 잎 추출물의 총 페놀 및 플라보노이드 함량은 Table 1과 같다. 동일 용매조건에서 환류냉각 추출물(75.10 ± 1.99 mg)은 초음파 추출물(51.74 ± 2.28 mg)보다 더 높은 페놀 함량을 나타내었다. 플라보노이드 함량 또한 총 페놀 함량과 유사한 경향으로 환류냉각 추출물(25.05 ± 1.53 mg)이 초음파 추출물(16.23 ± 1.95 mg)보다 높았다. 이는 Kang and Lee (2013)가 보고한 바와 같이 고온에서 용질이 추출됨에 따라 poly phenol의 구조가 고분자에서 저분자로 전환되었기 때문에 고온에서 추출하는 환류냉각 추출물의 폴리페놀 함량이 더 높게 나타난 것으로 생각된다. 또한 환류냉각 추출물 간 비교에서는 60% 에탄올 추출물에서 70% 에탄올 추출물(40.60 ± 1.49 mg)보다 더 높은 페놀 함량이 측정되었다. 플라보노이드 함량도 60% 에탄올(25.05 ± 1.53 mg)에서 70% 에탄올 추출물(6.60 ± 0.46 mg)보다 더 높은 경향을 보였다. 이는 Cho et al. (2005)의 연구결과인 복분자 60% 에탄올 추출물은 70% 에탄올 추출물보다 페놀함량이 더 높게 측정되었다는 부분과 비슷한 결과를 보였다.
항산화 능력 측정
돌외 잎 추출물의 DPPH radical 소거활성은 Fig. 1에 나타내었다. 각 추출물은 농도가 높아짐에 따라 DPPH radical 소거활성이 증가하였다. 동일 용매조건에서 환류냉각 추출물은 초음파 추출물과 비교하여 모든 실험농도에서 더 높은 DPPH radical 소거활성을 보였다. 환류냉각 추출물의 DPPH 소거활성은 60% 에탄올 추출물에서 70% 에탄올 추출물보다 더 높게 측정되었다. 이는 60% 에탄올 추출물의 페놀 또는 플라보노이드 함량이 70% 에탄올 추출물보다 높은 결과로부터 기인된 것으로 생각된다.
돌외 잎 추출물의 TEAC, FRAP, ORAC 값의 결과는 Table 2와 같다. 동일 용매조건에서 환류냉각 추출물과 초음파 추출물의 TEAC 값은 각각 121.22 ± 4.33, 90.71 ± 2.19 mM TE/g으로 환류냉각 추출물의 ABTS 라디칼 소거능이 더 우수한 결과를 보였다. 환류냉각 추출물 간 TEAC 값은 유의적인 차이를 보이지는 않았으나 60% 에탄올 추출물(121.22 ± 4.33 mM TE/g)에서 70% 에탄올 추출물(113.36 ± 2.10 mM TE/g)보다 다소 높은 값을 보였다.
동일 용매조건에서 환류냉각 추출물의 FRAP 값은 116.80 ± 4.21 mM FeSO4/g으로 초음파 추출물의 58.60 ± 4.20 mM FeSO4/g 값보다 약 2배 더 높게 나타났다. 환류냉각 추출물의 FRAP 값은 60, 70% 에탄올 추출물에서 각각 116.80 ± 4.21, 67.57 ± 1.56 mM FeSO4/g으로 60% 에탄올 추출물에서 FRAP 값은 더 높았다.
동일 용매 조건에서 환류냉각 추출물과 초음파 추출물의 ORAC 지수는 각각 979.32 ± 144.65, 757.18 ± 50.85 mM TE/g으로 환류냉각 추출물의 ORAC 지수가 더 높게 측정되었다. 환류 냉각 추출물의 ORAC 지수는 60% 에탄올 추출물(979.32 ± 144.65 mM TE/g)이 70% 에탄올 추출물(241.80 ± 55.16 mM TE/g)보다 약 3배 이상 더 높은 경향을 보였다. Table 2에서 보고한 모든 실험결과는 60% 환류냉각 에탄올 추출물에서 항산화능이 더 우수한 결과를 보였다. TEAC 및 FRAP 값은 항산화제의 전자 전달 능력을 비교 측정하는 실험방법이며 ORAC는 항산화제의 수소 공여 능력을 측정하여 항산화 능력을 비교하는 실험 방법으로 이들 모두 총 페놀성 화합물 및 플라보노이드 함량이 높을수록 증가하는 경향을 나타낸다(Wojdyło et al., 2007).
Table 2에서 보고한 모든 실험결과는 60% 환류냉각 에탄올 추출물에서 항산화능이 더 우수한 결과를 보였다. 이는 다양한 식물 추출물에서의 총 페놀 함량과 항산화 활성은 서로 비례관계가 성립한다는 Katalinic et al. (2006)의 연구결과처럼 페놀 및 플라보노이드 함량이 가장 높게 측정된 60% 에탄올 환류냉각 추출물이 70% 에탄올 초음파 추출물보다 더 높은 항산화 활성(TEAC, FRAP)을 보였다. 이는 돌외 잎 성분 중 함유되어 있는 폴리 페놀 성분 및 플라보노이드 성분이 항산화 작용을 나타내는 활성 물질로 예상할 수 있다.
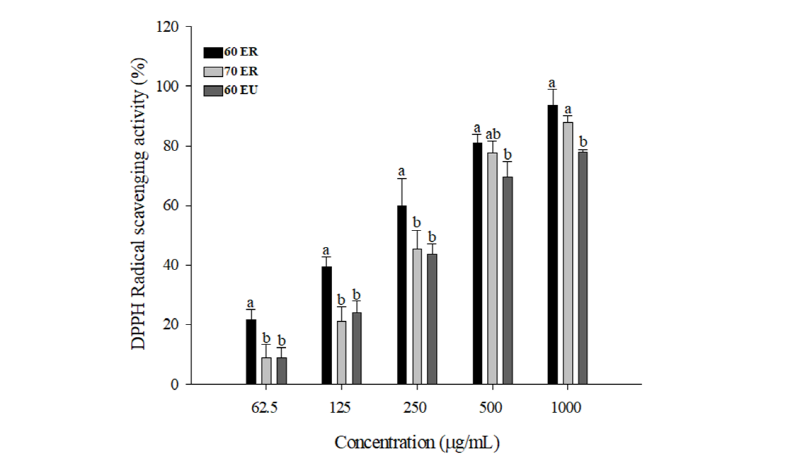
Fig. 1. DPPH (1,1-diphenyl-2-picrylhydrazyl) radical scavenging activity of Gynostemma pentaphyllum Makino leaf extracts. 60 ER, 60% ethanol reflux extract; 70 ER, 70% ethanol reflux extract; 60 EU, 60% ethanol ultrasonic extract. a, b: Means with different superscript are significantly different at p < 0.05 by Tukey’s multiple range tests.
Phenolic acid 정량 분석
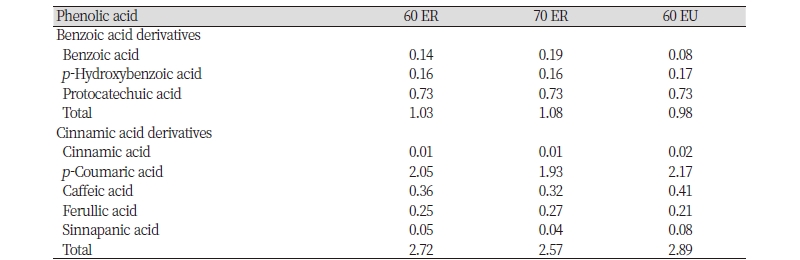
Phenlolic acid류는 기본 구조가 benzoic acid로 이루어진 benzoic, p-hydroxybenzoic, protcatecuic acid 및 cinnamic acid로 이루어진 cinnamic, coumaric, caffeic acid 등이 있으며 이들 화합물을 HPLC를 사용하여 정량 분석한 결과는 Table 3과 같다. 모든 추출물에서 benzoic acid류는 protocatechuic acid가 가장 높은 함량을 보였으며 cinnamic acid류는 p-coumaric acid가 가장 높은 함량을 보였다. 동일 용매조건에서 환류냉각 추출물과 초음파 추출물의 benzoic acid류의 함량은 각각 1.03, 0.98 mg/g이 확인되었으며 특히 benzoic acid는 환류냉각 추출물에서 초음파 추출물보다 0.06 mg/g 더 높은 함량이 분석되었다. 환류냉각 추출물에서는 60, 70% 에탄올 추출물 각각 1.03, 1.08 mg/g으로 나타났다. 동일용매 조건에서 초음파 추출물과 환류냉각 추출물의 cinnamic acid류의 함량은 2.89, 2.72 mg/g이 검출되었으며 초음파 추출물에서 cinnamic acid, p-coumaric acid, caffeic acid, sinnapanic acid가 더 높은 함량을 보였다. 이는 환류냉각 추출시 고온으로 인하여 페놀성 히드록시 그룹의 불안정성에 의한 함량감소가 나타난 것으로 사료된다(Song et al., 2012). 환류냉각 추출물에서는 60% 에탄올 추출물이 70% 에탄올 추출물보다 더 많은 함량을 보였다.
Conclusion
돌외 잎 추출조건별 항산화 활성을 비교한 결과 에탄올 농도를 다르게 한 환류냉각 추출물에서는 60% 에탄올 추출물이 70% 에탄올 추출물보다 더 높은 페놀 및 플라보노이드 함량이 나타났으며 항산화 활성 또한 더 높은 결과를 보였다. 동일 용매조건인 60% 에탄올 추출물에서 추출방법을 다르게 하였을 때 환류냉각 추출물이 초음파 추출물보다 총 페놀 및 플라보노이드 함량이 더 높게 나타났으며 TEAC, ORAC 및 FRAP 측정결과 더 우수한 항산화 활성을 보였다. 하지만 HPLC를 통한 phenolic acid류 분석결과 동일 용매조건에서 초음파 추출물이 환류냉각 추출물보다 더 높은 함량이 검출되어 비색법을 사용한 총 페놀함량 분석과는 다른 경향을 보였다. 이는 phenolic acid류 뿐만 아니라 플라보노이드 성분들도 항산화 작용에 기인한 것으로 보여 정확한 규명을 위해서는 추가적인 연구가 진행될 필요가 있을 것으로 생각된다.