Introduction
지의류는 조류(algae, photobionts)와 곰팡이(fungi, mycobionts)가 공생하는 독립된 생물체로 세계적으로 약 14,000종이 분포하고 있으며 오래 전부터 약용, 식용, 장식용 재료로서 여러 나라에서 널리 이용되고 있다(Hur et al., 2003). 지의류에서 생성되는 1차, 2차 대사산물들은 약리적 작용이 뛰어난 것으로 알려져 있고, 대표적으로 usnic acid와 같은 성분들은 항균작용이 매우 우수한 천연물질로 밝혀졌다(Gabriele and Anthony, 1999, Guzow et al., 2019). 또한, 지의류 형성 곰팡이가 분비하는 2차 대사산물인 sodium usnate는 토마토 궤양병원균, iecanoric, psoromic, usnic acid는 담배모자이크 바이러스에 항균활성을 가지는 것으로 알려져 있다(Ingolfsdottir et al., 1998, Mayurika et al., 2011, Guillermo et al., 2018, Schinkovitz et al., 2018). 지의류는 매우 광범위한 서식지에서 발견되며 이들은 건조한 사막지역, 해안지역에서부터 산림지역 심지어 극지방의 혹독한 기후조건에서도 살아남을 수 있다. 실제로 350종 이상의 지의류들이 남극지방에서 발견되며, 자연 생태계에서 매우 중요한 역할을 담당하고 있다(Huneck et al., 1984). Tundra와 북극에서 자생하는 Cladinas, Cladonias, Cetrarias, Thamnolia Vermicularis, Peltigera, Boyoria, Usnea 등의 지의류는 순록의 겨울 동안 총 먹이 30 - 60%를 공급하고, 산성에 의한 바위 풍화 기능과 함께 토양 생성 및 토양비옥도에 많은 영향을 준다(Mason and Hale, 1983). 최근에는 주로 향수(Daniel and Aphael, 2009)나 항생제 제조 및 의약(Piovano et al., 2002)으로 이용하고 있으며 SO2, NO2와 ozone에 특이적으로 민감하기 때문에 대기오염 모니터링에 이용하거나 산림의 연대 측정과 같은 환경 및 생태 지표로 이용되고 있다(Russo et al., 2008; Mayurika et al., 2011, Guillermo et al., 2018). 이 밖에도 Umbilicaria속 지의류의 한 종인 석이버섯은 일본에서 튀김으로 식용되고, 중국 운남성 지역에서는 고급 차의 원료 또는 약재로 이용되고 있어(Li et al., 2008) 지의류로부터 다양한 생리활성물질 탐색 연구가 진행되고 있다. 남극의 극저온, 건조, 자외선 노출 같은 극한의 자연환경에 적응하여 살고 있는 생물체는 자신만의 독특한 대사방법을 발전시키며 진화해왔다. 이들 생물체에서 확보한 대사물질은 힘겨운 생존경쟁의 산물이므로 새로운 생리활성 효과가 있다. 극한의 환경에서 생물체로 하여금 생장과 증식을 가능하게 하는 물질대사 관련 효소는 구조의 안정성이 높고 저온에서도 활성이 높아 아직까지 알려지지 않은 새로운 화학반응을 촉매할 수 있기 때문에 무한한 잠재력을 가지고 있다. 이에 극한 지역 생물체 배양 기술과 유용 생물 소재(저온 활성 효소, 항산화, 항당뇨, 항동결, 항노화 물질 등)의 스크리닝을 이용하여, 남극의 이끼류, 지의류, 현화식물에서 천연물을 지속해서 탐색하고 있다. 천연생리활성물질은 유기합성 화합물에 비하여 개발비용이 낮고 그 효과가 선택적이며, 환경상의 안전성이 높기 때문에 새로운 약제 개발에 있어서 유용한 수단으로 제시되고 있다. 또한 지의류로부터 다양한 천연활성 물질을 탐색하는 것은 새로운 화합물의 합성을 위한 풍부한 lead compound를 제공한다는 면에서도 좋은 재료라고 생각되어 지고 있다. 본 연구에서는 남극에서 채취한 지의류 추출물로부터 항균활성물질을 분리하여 화학구조를 동정하고 생물자원으로의 이용 가능성을 검토하고자 한다.
Materials and Methods
공시 지의류
공시 지의류 Stereocaulon alpinum와 Sphaerophorus globosus는 순천대학교 지의류은행에서 분양 받아 사용하였다(Fig. 1).
시약 및 기기
활성물질의 추출 및 용매분획에 사용한 n-hexane, chloroform, EtOAc, MeOH, n-BuOH등의 용매는 국내 삼전순약(18 L, Sanmchun pure chemical Co., Ltd., Seoul, Korea) 제품을 정제하지 않고 사용하였다. Nuclear magnetic resonance (NMR)용 용매는 CD3OD (Merck, Darmstadt, Germany), DMSO-d6 (Sigma-Aldrich, St. Louis, USA) 및 CDCl3(Sigma-Aldrich, St. Louis, USA)를 사용하였으며, HPLC 용매로 사용한 MeOH은 공업용을 정제하여 사용하였다. Flash column chromatography용 silica gel (70 - 230 mesh)과 분석용 silica gel thin layer chromatography (TLC, Kiesel gel 60F254 (0.25 mm), Merck, Darmstadt, Germany)를 사용하였다. 발색 시약은 10% H2SO4 및 vaniline-H2SO4를 사용하였다. High performance liquid chromatography (HPLC)는 LC900 series (JASCO, Tokyo, Japan)/UV detector, medium press liquid chromatography (MPLC)는 Combi Flash (Isco, Nebraska, USA), fraction collector (model 704, Varian, Palo Alto, USA), electron ionization mass spectrometry (EI-MS)는 Hitachi M-80A (Hitachi, Tokyo, Japan), NMR spectrometer는 JNM-AL400 (400 MHz/100 MHz, JEOL Ltd., Tokyo, Japan)을 사용하였다. NMR의 internal standard는 tetra methyl silane (TMS)를 사용하였으며, chemical shift는 ppm (δ)으로 나타내었다.
항균활성 검정
항균활성 검정에 사용한 사과 점무늬낙엽병균(Alternaria mali), 참나무 역병균(Verticillum dahliae), 벼 깨씨무늬병균(Cochliobolus miyabeanus), 딸기 탄저병균(Colletotrichum gloeosporioides)은 한국생명공학연구원 미생물자원센터의 곰팡이, 효모분야에서 분양 받아 사용하였다.
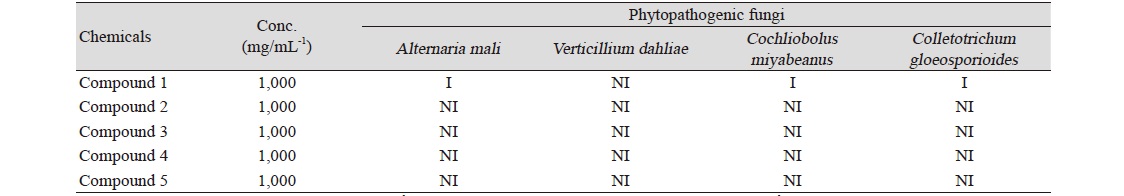
지의류에서 분리한 5가지 화합물을 4종의 공시 식물병원균에 대하여 In vitro 항균 활성 검정을 실시하였다. 각 식물병원균은 PDA (potato dextrose agar) 배지를 이용하여 25℃ incubator에서 3일간 배양하고 PDB (potato dextrose broth) 배지에 넣어 25℃ shaking incubator에서 3일 배양 후 배양된 식물병원균을 blender를 이용하여 마쇄 후 고체배지의 0.1% 농도로 접종하였다. 접종된 고체배지에 지의류에서 분리한 물질을 각 1,000 ppm으로 조제하여 paper disk에 흡착시킨 후 고체배지상에 치상하고 3일 동안 incubator에서 배양한 후 저해 활성을 측정하였다.
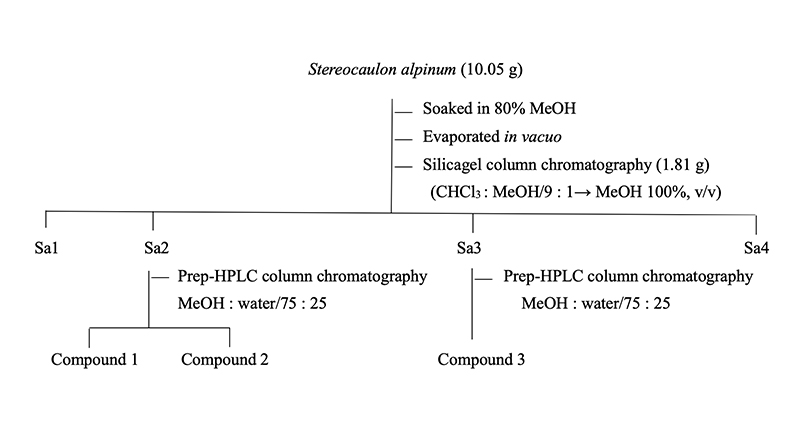
Stereocaulon alpinum으로부터 물질 분리
Stereocaulon alpinum 10.05 g을 3배량의 80% aq. MeOH에 침지하여 실온에서 72시간 추출하였으며, 추출액은 Whatman NO. 4 여과지(Whatman, Maidstone, UK)로 여과 후 감압 농축기로 40℃에서 농축하여 1.81 g의 MeOH 분획물을 얻었다. 이 분획물을 CHCl3 : MeOH (9 : 1, v/v) 용매조건으로 silica gel column chromatography를 실시 후 TLC 분석에 의해 4개의 분획물로 나누었다. 분획물 중 Sa2, Sa3을 prep-HPLC MeOH :H2O(75 : 25, v/v, UV 254 nm) 이동상 용매조건하에서 물질 분리를 실시하였으며 fraction collector를 이용하여 300 drops씩 분취하여 compound 1 (15 mg), compound 2 (10 mg), compound 3 (10 mg)을 분리하였다(Scheme 1).
Sphaerophorus globosus으로부터 물질 분리
Sphaerophorus globosus 10.11 g을 3배량의 80% aq. MeOH에 72시간 실온에서 침지한 후 여과하였다. 추출액은 Whatman NO. 4 여지로 여과 후 감압 농축기로 40℃에서 농축하여 1.52 g의 MeOH 추출물을 얻었으며, 이 추출물을 CHCl3 : MeOH (9 : 1, v/v) 용매조건으로 silica gel column chromatography를 실시한 후 TLC 분석에 의해 4개의 분획물로 나누었다. 4개의 분획물 중 Sg2을 prep-HPLC MeOH :H2O(75 : 25, v/v, UV 254 nm) 이동상 용매조건하에서 물질 분리를 실시하였으며 fraction collector를 이용하여 300 drops씩 분취하여 compound 4 (10 mg)와 compound 5 (8 mg)를 분리하였다(Scheme 2).
Results and Discussion
항균활성
지의류에서 분리한 5개의 화합물을 In vitro 활성을 실시한 결과 compound 1에서 참나무 역병균을 제외한 사과 점무늬낙엽병균, 벼 깨씨무늬병균, 딸기 탄저병균에서 저해 활성을 나타내었다. Compound 2, 3, 4, 5는 모든 공시균에 대한 저해 활성이 나타나지 않았다(Table 1).
구조결정
Compound 1
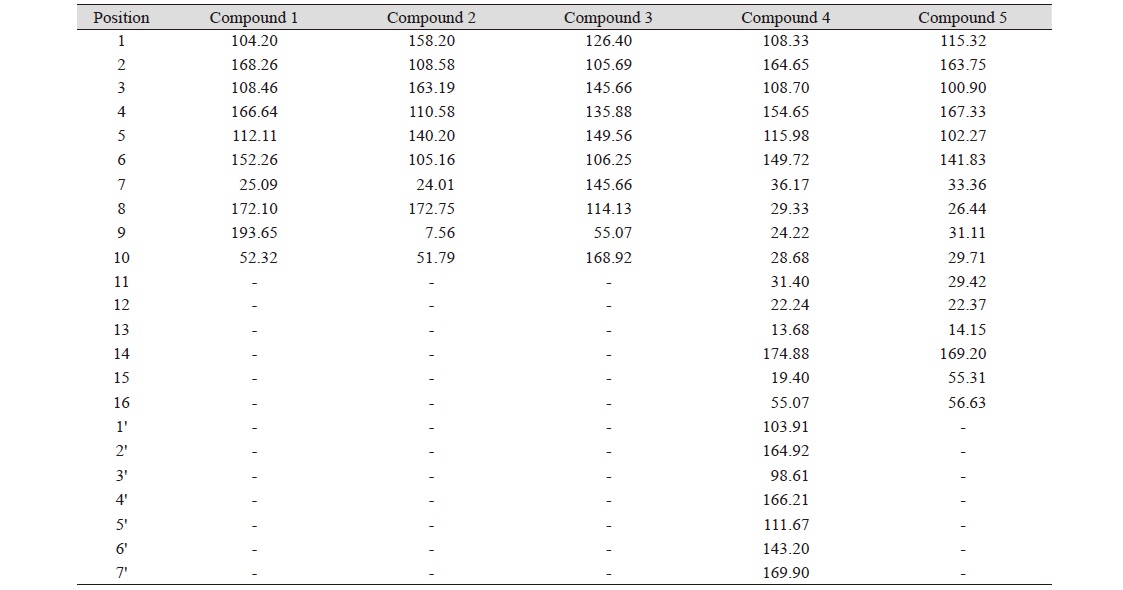
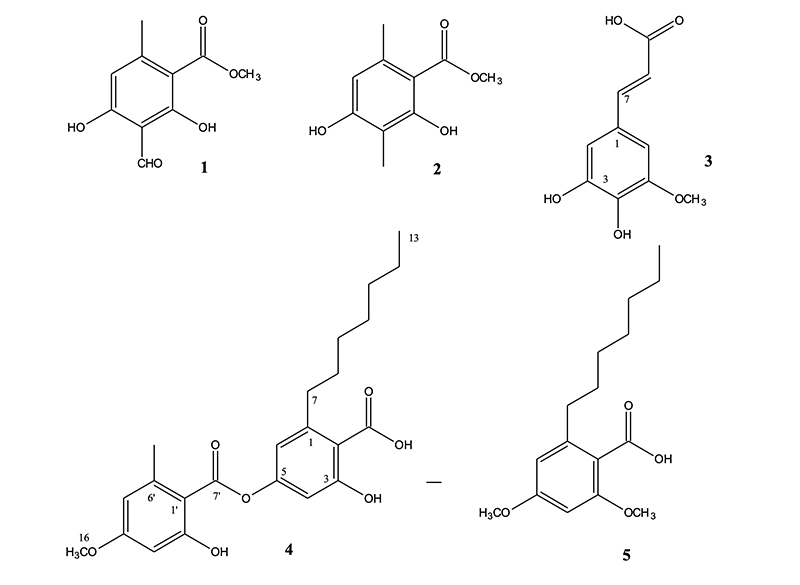
Compound 1의 EI-MS spectrum 분석 결과 (M + 1)+ 211, (M - 1)+ 209 m/z로 관찰되어 분자량이 210임을 확인하였다. 1H-NMR spectrum 분석 결과, 2.49 ppm (3H, s)에서 aromatic ring에 결합되어 있는 methyl group의 proton peak가 나타났고 3.94 ppm (3H, s)에서 methoxy group의 proton peak가 관찰되었으며, 10.30 ppm (1H, s)에서 aldehyde proton peak가 확인되었다(Table 2). 이를 근거로 문헌값(Hiserodt et al., 2000)과 비교하여 compound 1의 화학구조를 분자식 C10H10O5 (mol weight [M.W]: 210)인 methyl hematommate로 결정하였다.
Table 2. 1H-NMR spectral data of compound 1 - 5.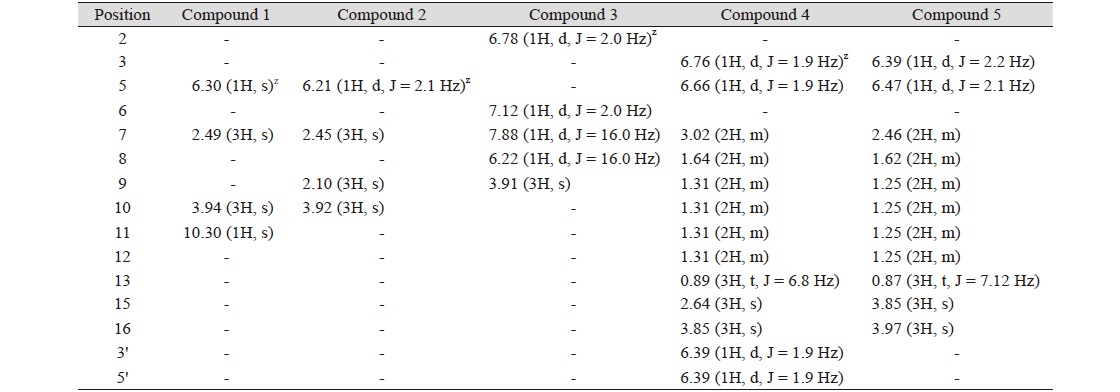
|
|
s, singlet; d, doublet; t, triplet; m, multiplet. z Proton signal multiplicity and Coupling constant (J = Hz) are parentheses. |
Compound 2
Compound 2는 노란색의 결정 형태로 분리되었으며 EI-MS spectrum 측정 결과 (M + 1)+197, (M - 1)+ 195 m/z로 관찰되어 분자량이 196임을 확인하였다. 1H-NMR spectrum 분석 결과 2.45 (3H, s), 2.10 ppm (3H, s) aromatic ring에 결합되어 있는 methyl group의 proton peak가 확인되었고 3.92 ppm (3H, s)에서 methoxy group의 proton peak가 관찰되었으며, 6.21 ppm (1H, s)에서 aromatic proton peak를 확인하였다(Table 3). 13C-NMR spectrum 분석결과 172.75 ppm (C-8)에서 carbonyl carbon peak를 확인하였고 163.19 (C-4), 158.2 (C-2), 140.2 (C-6), 110.58 (C-5), 108.58 (C-3), 105.16 ppm (C-1)에서 benzene ring에 기인하는 carbon peak가 관찰 되었으며 51.79 ppm (C-10)에서 methoxy group의 carbon peak 가 관찰되었다. 또한 24.01 (C-7), 7.56 ppm (C-9)에서 methyl group의 carbon peak를 확인하였다. 이를 근거로 문헌값(Schinkovitz et al., 2018)과 비교하여 compound 2의 화학구조를 분자식C10H12O4 (M.W: 196)인 methyl β-orsellinate로 결정하였다.
Compound 3
Compound 3의 1H-NMR spectrum 분석결과 6.78 (1H, d, J = 2.0 Hz), 7.12 ppm (1H, d, J = 2.0)에서 상호간에 meta위치를 하고 있는 aromatic proton peak를 확인하였고, 6.22 (1H, d, J = 15.7 Hz), 7.88 ppm (1H, d, J = 15.7 Hz)에서 상호간에 trans 결합한 2개의 olefinic methine proton이 관찰되었다. 또한 3.91 ppm (3H, s)에서 methoxy group의 proton peak를 확인하였다. 이를 바탕으로 compound 3의 화학구조를 5-hydroxyferulic acid (C10H10O5 [M.W: 210])로 결정하였다.
Compound 4
Compound 4의 화학구조는 1H-NMR과 13C-NMR spectra를 해석하여 결정하였다. 1H-NMR spectrum 분석 결과 3.85 ppm (3H, s)에서 methoxy group의 proton peak, 6.39 (2H), 6.76 (1H, d, J = 1.9 Hz), 6.66 ppm (1H, d, J = 1.9 Hz)에서 aromatic proton peak가 관찰되었다. 그리고 0.89 (3H, t, J = 6.8 Hz)에서 methyl group의 proton peak, 2.64 (3H, s)에서 benzene ring에 결합한 methyl group의 methyl group의 proton peak, 3.02 ppm (2H, m)에서 benzene ring에 결합한 methylene peak가 관찰되었다. 1.31 ppm (8H, m)에서 4개의 인접한 methylene의 peak, 1.64 (2H, m)에서 methylene peak를 확인하였다. 13C-NMR spectrum 분석결과 55.07 ppm (C-16)에서 methoxy group의 carbon peak, 169.9 ppm (C-7)과 174.88 ppm (C-14)에서 ester group의 carbonyl carbon peak가 관찰되었다. 164.65 ppm (C-2), 164.92 ppm (C-2'), 154.65 ppm (C-4)에서 산소에 인접한 benzene ring의 carbon peak가 관찰되었고 98.61 (C-3'), 103.91 (C-1'), 108.33 (C-1), 108.70 (C-3), 111.67 (C-5'), 115.98 (C-5), 143.20 (C-6'), 149.72 ppm (C-6)에서 benzene ring에 기인하는 carbon peak와 22.24 (C-12), 24.22 (C-9), 28.68 (C-10), 29.33 (C-8), 31.40 ppm (C-11), 36.17 ppm (C-7)에서 6개의 methylene carbon peak, 13.68 ppm (C-13)에서 methyl기를 확인하였다. 이를 근거로 문헌값(Elix et al., 1994)과 비교하여 compound 4를 sphaerophorin (C23H28O7 [M.W: 416])으로 결정하였다.
Compound 5
Compound 5의 화학구조를 해석하기 위하여 NMR spectrum을 분석한 결과 compound 5의 구조는 compound 4를 부분 구조로 갖고 있을 것으로 예상되었다. 1H-NMR spectrum 분석 결과 3.97 (3H, s), 3.85 ppm (3H, s)에서 methoxy group의 proton peak, 6.39 (1H, d, J = 1.9 Hz), 6.47 ppm (1H, d, J = 1.9 Hz)에서 상호간의 meta coupling하고 있는 aromatic proton peak가 관찰되었다. 0.87 ppm (3H, J = 7.12 Hz)에서 methylene group과 결합된 methyl group의 proton peak, 1.25 ppm (10H, m)에서 5개의 methylene proton의 peak가 중복되어 관측되었다. 또한 2.46 ppm (2H, m)에서 benzene ring에 결합한 methylene proton peak를 확인하였다. 이를 근거로 compound 5를 2-heptyl-4,6-dimethoxybenzoic acid (C16H24O4 [M.W: 280])으로 동정하였다.
본 연구에서 분리하여 구조가 동정된 화합물(Fig. 2)들은 몇 종의 다른 지의류에서도 분리된 바 있으나 본 연구에서 사용한 지의류에서는 처음 분리되었으며, 같은 생합성 경로로 합성되었을 것으로 추측된다. 분리된 화합물들의 화학 구조상 공통점이 많고 다양한 활성이 보고되어 있으나 기대에 미치는 항균활성을 보이지는 않았다. 또한 이들 화합물들은 자연생태계에서 풍부하지 않은 지의류에서 분리가 되고 있기 때문에 활성검정에 필요한 충분한 양의 확보가 어렵다는 한계가 있다. 그렇지만 이 화합물들은 비교적 화학합성이 용이할 것으로 보아 향후 이들 화합물 및 다양한 유도체들을 합성하여 구조-활성관계의 검정이 필요하다고 판단된다.
Conclusion
지의류는 조류와 곰팡이가 공생하는 독립된 생물체 복합 유기체로 지의류에서 생성되는 1차, 2차 대사산물들은 항생물질, 항종양 활성, 항변이원성 활성, 식물 생장 저해 활성 등 다양한 약리적 작용이 뛰어난 것으로 알려져 있다. 본 연구에서는 남극 지의류인 Stereocaulon alpinum과 Sphaerophorus globosus 추출물로부터 5종의 2차 대사산물을 분리하여 화학구조를 동정하고, 식물병원균 Alternaria mali, Cochliobolus miyabeanus, Colletotrium gloeosporioides, Verticillum dahliae 대한 저해활성을 검토하였다. 분리한 화합물들의 화학구조는 EI-MS와 NMR spectral data를 분석하여 methyl hematommate, methyl β-orsellinate, 5-hydroxyferulic acid, sphaerophorin, 그리고 2-heptyl-4,6-dimethoxybenzoic acid로 동정하였다.