Introduction
Prebiotics란 인간을 포함한 동물의 장내에 존재하는 유용한 미생물의 성장이나 활성을 선택적으로 촉진시켜 숙주에 유익한 효과를 주는 난소화성 식품첨가물을 일컫는 말로서 fructo-oligosaccharide, galacto-oligosaccharide, isomalto-oligosaccharide, xylo-oligosaccharide, chitin-oligosaccharide 등의 oligosaccharide와 dextrin, inulin, gum 등의 식이섬유가 대표적이다(Gibson and Roberfroid, 1995; Manning and Gibson, 2004). 이들은 주로 bifidobacteria의 성장을 촉진하여 bifidogenic 요인으로 불리워지고 있다(Maxwell et al., 2004; Rada et al., 2008). Prebiotics는 항암작용(Burns and Rowland, 2004), 항균작용(Quigley and Quera, 2006; Eamonn, 2011), Hypolipidemic (Grizard et al., 2001; Habib et al., 2011), 정장작용, 염증성 질환의 에방 및 포도당 변조를 일으키는 활동을 하며(Brunser and Gotteland, 2010), 장내 식품 안에 들어있는 칼슘과 무기질의 흡수를 증가시켜 항골다공증 활동을 하기도 한다(Gonzalez et al., 2011).
Prebiotics는 소화관 상부에서 분해되거나 흡수되지 않으며, 대장의 장내 환경을 개선하고 대장 내 유익한 세균의 선택적 먹이가 되어 증식을 촉진시켜야 하며 인간의 건강 증진에 도움을 줄 수 있어야 한다.
Bifidobacteria는 사람과 동물의 장내에 존재하며 숙주의 건강에 여러 가지 유익한 효과를 나타낸다는 사실이 학계에 보고되면서 발효유 생산에 주된 균주로 자리 잡게 되었다. Bifidobacteria는 일반 유산균과는 달리 담즙에 비교적 높은 저항력을 가지고 있어 장내에서 생존이 가능하며 유기산과 short chain fatty acid (SCFA)를 생성시켜 장의 pH를 낮추어 산에 민감한 유해균으로 알려져 있는 E. coli, Clostridium perfringens 등과 같은 유해균을 억제시킴으로써 유해균에 의해 생성되는 ammonia, amine 등이 장관에서 흡수되는 속도를 저하시킨다(Ahn et al., 1997). 또한 Park et al. (1998)은 장내에서 박테리아성 암을 생성하는 효소 활성을 방해한다고 보고하였다. Schiffrin et al. (1995)은 L. acidophillus나 Bifidobacterium bifidum을 이용한 발효유를 사람이 섭취하면 특별한 림프세포의 변화 없이 대장균 포식활동이 증가되는 것을 발견하였고, Marin et al. (1997)은 macrophage 세포주를 이용한 in vitro 실험에서 비피더스 균주들이 tumor necrosis factor-α 및 interleukin-6과 같은 cytokine 생산을 증진 시켜주고, Fukushima et al. (1998)은 유아들에게 bifidobacteria를 우유와 함께 투여하였을 때 변에서 IgA 함량이 유의적으로 증가하였음을 발견하였다. 또한 bifidobacteria는 bile salt hydrolase를 분비하여 담즙산의 재흡수를 낮추고 변으로의 콜레스테롤 배설을 증가시킴으로써 혈액의 콜레스테롤 농도를 감소시키며(Noriega et al., 2006), 간에서의 중성지방 합성을 낮추어 혈액 내 중성지방함량을 감소시켜 혈액 내 지방수준을 개선시키는 효과가 있는 것으로 알려져 있다 (Gomes and Malcata, 1999).
인체에 존재하는 bifidobacteria의 균수 변동이 스트레스나 질병, 암, 노화 등과 밀접하게 관련되어 있다는 연구결과가 보고됨에 따라 bifidobacteria의 건강증진 기여 효과가 학계의 주목을 받게 되었다. 특히 bifidobacteria가 생산하는 다당류의 항암 활성이 보고되면서 이들이 고기능성 식품소재로 주목받고 있으나, 이들을 식품산업에 이용하는데 있어서 bifidobacteria의 장내 정착률이 낮다는 문제점이 있다. 이를 극복하기 위한 방안으로 bifidobacteria가 성장할 수 있는 영양분의 공급, 즉 bifidobacteria를 증식시킬 수 있는 prebiotics를 섭취하여 장내에 존재하는 bifidobacteria의 증식을 증가시키는 연구가 행해지고 있다. 또한 이러한 bifidobacteria의 증식을 증가시키려는 연구와 더불어 bifidobacteria의 성장속도를 높이는 bifidobacteria 성장촉진물질에 대한 연구가 활발히 진행되어 왔으며, 그로 인해 효모 추출물, 케이신 분해물, 유당에서 유래된 lactulose, peptide류, β-ethly-N-acetyl-D-glucosaminide, 당근, 추출액 등 여러가지 bifidobacteria 성장촉진물질이 알려지게 되었다(Nagendra et al., 1995). 이들 bifidobacteria 성장촉진물질은 질소를 함유하는 탄수화물(dialyzable, nitrogen-containing carbohydrate)로서 가열 및 냉동에 안정한 특성이 있다.
따라서 본 연구는 bifidobacteria 성장촉진물질로 알려진 주박에서 획득한 BE0623가 bifidobacteria의 성장 효과 즉, prebiotics 로써 기능을 할 수 있는지 여부를 알아보기 위해 수행하였다.
Materals and Method
시약
Loperamide, NaCl, NaOH, phenolphthalein, pepton, 에탄올은 Sigma Chemical Co. (St. Louis, MO, USA)에서 구입하였으며, 혈청지질 분석용 kit는 Bio Clinical System (Anyang, Korea)에서 구입하였다.
Microorganisms
Bifidobacteria (Bifidobacterium lactis BB12 및 Bifidobacterium longum BB536)는 동결건조 된 상업용 bifidobacteria를 Chr-Hansen (Hoersholm, Denmark)와 Morinaga (Kanagawa-Pref, Japan)로부터 구입하여 사용하였다.
배지
BS agar (Bifidobacterium lactis-selective agar)는 BBL (Sparks Maryland, USA), BL agar와 BCP agar는 Difco (MD, USA)로부터 구입하였으며, bifidobacteria 증식 확인을 위한 탈지분유는 시중에 판매하는 상업용 제품(Namyang Dairy Products Co., Ltd., Gongju, Korea)을 구입하여 사용하였다.
Bifidobacteria 성장촉진물질 (BE0623)의 증식 효과
Bifidobacteria 성장촉진물질(BE0623)의 생산을 위한 중간 원료인 주박은 Yaegaki (Himeji, Japan)에서 구입하였고 제조방법은 다음과 같다. 쌀을 물에 담가 100℃에서 40분간 가온하고, 30℃로 냉각한 후 효모를 접종하였다. 30℃에서 약 20일간 발효시키고 원심분리 및 여과공정을 거쳐 수용성성분을 빼낸다. 그 후 95℃ 90초간 가열살균하여 효모를 불활성화하고 농축하였다. 상기 농축액을 증류수에 녹여 수용성 부분만 회수한 후 이를 스프레이 건조하여 사용하였다. BE0623에 존재하는 비피도박테리아 성장촉진물질의 규명 및 효능물질의 bifidobacteria 성장촉진 메커니즘을 밝히기 위해 BE0623의 정제를 실시하였다. BE0623의 정제를 위한 컬럼의 충진은 분자량 1,000이상의 펩타이드, 단백질, 폴리페놀 등의 정제에 적합한 흡착제인 스틸렌지비닐벤젠계 합성흡착제(Diaion HP20, Samreung, Daegu, Korea)를 사용하였으며, 상기 수지를 유리컬럼(5 × 60 cm)에 충진하고 충진물 내 기포를 제거한 후 용해한 BE0623 용액을 통과시켜 흡착시키고 자연 통과된 분획 1을 얻었다. 분획 1을 회수한 수지를 다시 증류수로 세척하여 분획 2를 얻었으며 끝으로 0.1N NaOH로 수지를 세척하여 분획 3을 획득하였다. 이렇게 획득한 각 분획물의 bifidobacteria 성장촉진 효능 여부를 확인하기 위해 13% 탈지분유배지에 BE0623 또는 각각의 분획물(2.85% 또는 5.7%)을 첨가한 후(대조군; 무첨가군) 105°C에서 5분간 가압멸균하고 38℃로 냉각 후 freeze dry 형태의 Bifidobacterium lactis (BB12) 0.002% (w/v)를 접종하였으며, 일정시간 발효 후 발효 중 생산되는 산도를 적정하여 bifidobacteria의 증식정도를 비교하였다. 또한 분획물의 상호작용을 확인하기 위해 각 분획의 조합 (분획1 + 2, 분획1 + 3, 분획2 + 3 및 분획1 + 2 + 3)을 탈지분유배지에 첨가한 후 bifidobacteria를 배양하여 일정시간 발효 후의 적정산도를 측정하였다. BE0623의 증식효과를 확인하기 위해 bifidobateria 증식이 미미한 탈지분유를 기본 베이스로 배양을 실시하였으며, 증식 효과는 bifidobacteria가 증식하는 과정에서 생산하는 산도 및 pH의 측정, 생균수 측정, 현미경 관찰을 통한 균주 확인, bifidobacteria 증식에 따라 생성되는 바이오 필름 확인 등으로 규명하였다.
Bifidobacteria의 증식 확인
Bifidobacteria의 증식 확인은 13% (W/V)의 탈지분유배지에 0.4% E0623을 용해한 후 105℃에서 5분간 가압 멸균하여 38℃로 냉각한 후 0.002% (w/v) bifidobacteria를 접종하고 24시간 배양하였으며, 배양 시작부터 6시간 간격으로 시료를 채취하였다. 채취한 시료는 10℃이하로 냉각하고 0.1 N-NaOH 용액으로 적정하여 발효 중 생성된 산도를 구하였으며, 해당 시간의 pH도 측정하였다. Bifidobacteria의 생균수 확인을 위해 BL agar에서 72시간(배양온도: 37℃) 혐기 배양을 실시하였다.
현미경 관찰
13% (w/v)의 탈지분유 배지에 0.1% BE0623을 용해한 후 105℃에서 5분간 가압 멸균하였다. 대조군으로 BE0623을 첨가하지 않은 배지를 사용하였으며, 멸균된 배지를 38 - 41℃로 냉각한 후 0.002% (w/v) Bifidobacterium lactis (BB12)를 접종하였다. 배양 초기부터 8시간 간격으로 배양 24시간까지 현미경 촬영(600배, Carl zeiss microscopy Co., Jena, Germany)을 실시하였다.
상업용 bifidobacteria 성장촉진물질과의 비교
현재 상업용으로 사용되고 있는 bifidobacteria 증식 인자에 대한 BE0623의 효능을 알아보기 위해 대두 펩타이드(하이뉴트), 케이신 펩타이드(CE90GMM), 훼이펩타이드(LE80GF-US)를 비교 물질로 선정하였으며, 이들은 Fuji Oil Co., LTD. (Osaka, Japan), DMV (Amersfoort, Netherlands)로부터 구입하였다. 13% (w/v) 탈지분유배지에 0.4% BE0623 또는 상업용 bifidobacteria 성장촉진물질을 용해한 후 105℃에서 5분간 가압 멸균하였으며, BE0623 또는 시판용 bifidobacteria 성장촉진물질 무첨가 배지를 대조군으로 하였다. 멸균된 배지를 38℃로 냉각한 후 0.002% (w/v) Bifidobacterium lactis (BB12)를 접종하였다. 배양 0시간부터 6시간 간격으로 시료를 채취한 후 10°C이하로 냉각하고 0.1N-NaOH로 적정하여 발효 중 생성된 산도를 구하였으며, 해당 시간의 pH도 측정하였다. Bifidobacteria의 생균수 확인을 위해 BL agar에서 72시간 (배양온도: 37℃) 혐기 배양을 실시하였으며 배양 시간 별 결과로 성장촉진 효과를 비교하였다.
Bifidobacteria 성장촉진물질
BE0623에 존재하는 bifidobacteria 성장촉진물질의 규명 및 효능 물질의 bifidobacteria 성장촉진 메커니즘을 밝히기 위해 BE0623의 성분 분리를 실시하였다. BE0623의 분리에 사용된 컬럼은 분자량 1,000 dalton 이상의 펩타이드, 단백질, 폴리페놀 등의 분리에 적합한 흡착제인 스틸렌지비닐벤젠계 합성흡착제(Diaion HP20, Samreung, Daegu, Korea)를 사용하였으며, 상기 수지를 유리컬럼(5 × 60 cm)에 충전하고 충전물 내 기포를 제거한 후 용해한 BE0623 용액을 통과시켜 흡착시키고 자연 통과된 분획 1을 얻었다. 분획 1을 회수한 수지를 다시 증류수로 세척하여 분획 2를 얻었으며 끝으로 0.1 N NaOH로 수지를 세척하여 분획 3을 획득하였다. 이렇게 획득한 각 분획물의 bifidobacteria 성장촉진 효능 여부를 확인하기 위해 13% 탈지분유배지에 BE0623 또는 각각의 분획물(2.85% 또는 5.7%)을 첨가한 후 (대조군; 무첨가군) 105℃에서 5분간 가압멸균하고 38℃로 냉각 후 동결건조 형태의 Bifidobacterium lactis (BB12) 0.002% (w/v)를 접종하였으며, 일정시간 발효 후 발효 중 생산되는 산도를 적정하여 bifidobacteria의 증식을 비교하였다. 또한 분획물의 상호작용을 확인하기 위해 각 분획의 조합(분획1 + 2, 분획1 + 3, 분획2 + 3 및 분획1 + 2 + 3)을 탈지분유 배지에 첨가한 후 bifidobacteria를 배양하여 일정시간 발효 후 적정 산도를 측정하였다.
Results and Discussion
BE0623의 Bifidobacteria 증식 효과
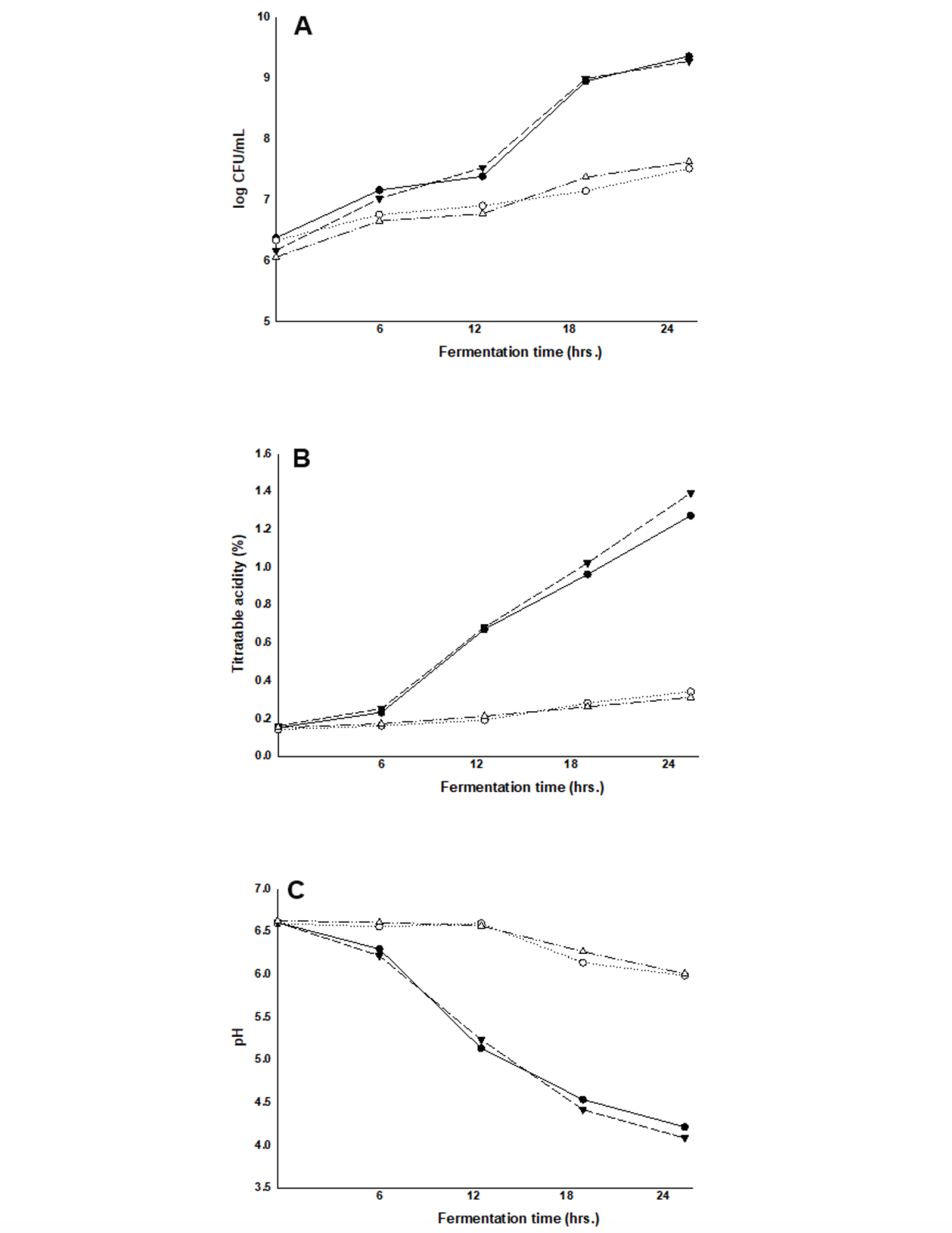
BE0623이 bifidobacteria 증식에 미치는 효과를 알아보기 위해 BE0623을 첨가한 탈지분유 배지에 2종의 bifidobacteria (Bifido bacterium lactis, Bifidobacterium longum)을 접종한 후 bifidobacteria 증식과정에서의 생균수, 적정산도 및 pH를 측정하여 BE0623의 bifidobacteria 성장촉진효과를 확인하였다. Bifidobacteria는 hetero fermentation을 하는 균종으로 발효 시 유산과 초산을 약 2:3의 비율로 생산하므로 발효 시간에 따른 발효유의 산도와 pH를 측정하여 상대적인 균의 증식 정도를 알 수 있으며, bifidobacteria의 생균수를 측정하여 산도와의 상관관계를 확인하였다. 두 균주의 발효시간에 따른 생균수, 산도, pH 측정 결과는 Fig. 1에 나타난 바와 같다. 발효 시작 시점에서 Bifidobacterium lactis (BB12)의 초기 균수는 대조군은 2.12 × 106 colony forming unit (CFU)·mL-1, BE0623 0.4% 첨가군은 2.32 × 106 CFU·mL-1이었으며, Bifidobacterium longum (BB536)의 경우 대조군은 1.13 × 106 CFU·mL-1, BE0623 0.4% 첨가군은 1.45 × 106 CFU·mL-1로 초기 bifidobacteria의 생균수는 유사한 수준이었다. 발효 12시간 경과 후의 생균수는 Bifidobacterium lactis (BB12)의 경우 BE0623 대조군은 7.87 × 106 CFU·mL-1, BE0623 0.4% 첨가군은 2.39 × 107 CFU·mL-1로 약 3배의 균수 차이가 나타났으며, Bifidobacterium longum (BB536)의 경우 BE0623 대조군은 5.80 × 106 CFU·mL-1, BE0623 0.4% 첨가군은 3.32 × 107 CFU·mL-1로 약 5.7배의 균수 차이가 나타났다. 발효 종료시점인 24시간 경과 후 생균수는 Bifidobacterium lactis (BB12)의 경우 BE0623 대조군은 3.21 × 107 CFU·mL-1, BE0623 0.4% 첨가군은 2.25 × 109 CFU·mL-1로 약 70배의 균수 차이가 나타났으며, Bifidobacterium longum (BB536)의 경우 BE0623 대조군은 4.12 × 107 CFU·mL-1, BE0623 0.4% 첨가군은 1.86 × 109 CFU·mL-1로 약 45배의 균수 차이가 나타났다. 이는 BE0623이 발효 과정 중 bifidobacteria에 대해 뛰어난 성장촉진 효과를 갖고 있음을 보여주었다. 또한 발효 중 적정산도는 발효 12시간에서 Bifidobacterium lactis (BB12)의 경우 BE0623 대조군은 0.19%, BE0623 0.4% 첨가군은 0.67%로 약 3.5배의 산도 차이가 나타났으며, Bifidobacterium longum (BB536)의 경우 BE0623 대조군은 0.21%, BE0623 0.4% 첨가군은 0.68%로 약 3.2배의 산도 차이를 나타내었다. 발효종료시점인 24시간 경과 후 Bifidobacterium lactis (BB12)의 경우 BE0623 대조군은 0.34%, BE0623 0.4% 첨가군은 1.27%로 약 3.7배의 산도 차이를 나타내었으며, Bifidobacterium longum (BB536)의 경우 BE0623 대조군은 0.31%, BE0623 0.4% 첨가군은 1.39%로 약 4.48배의 산도 차이를 나타내었다. pH는 적정산도와 반비례하였고, 산도와 pH의 결과로 유추해 볼 때, BE0623을 처리한 발효유의 유산 생성량이 BE0623을 처리하지 않은 발효유에 비해 대폭 증가하는 경향을 보였다. 이와 같이 BE0623가 Bifidobacterium lactis (BB12)와 Bifidobacterium longum (BB536)의 성장에 뛰어난 촉진 효과가 있음을 알 수 있었다. 한편 효모 추출물, 케이신 분해물, 유당에서 유래된 lactulose, peptide류, β-ethly-N-acetyl-D-glucosaminide, 당근 추출액 등 여러 가지 bifidobacteria 성장촉진물질이 보고되었다(Nagendra et al., 1995). 이들 bifidobacteria 성장촉진물질은 질소를 함유하는 탄수화물(nitrogen-containing carbohydrate) 로서 가열 및 냉동에 안정한 특성이 있다.
현미경 관찰에 의한 bifidobacteria 증식 효과 규명
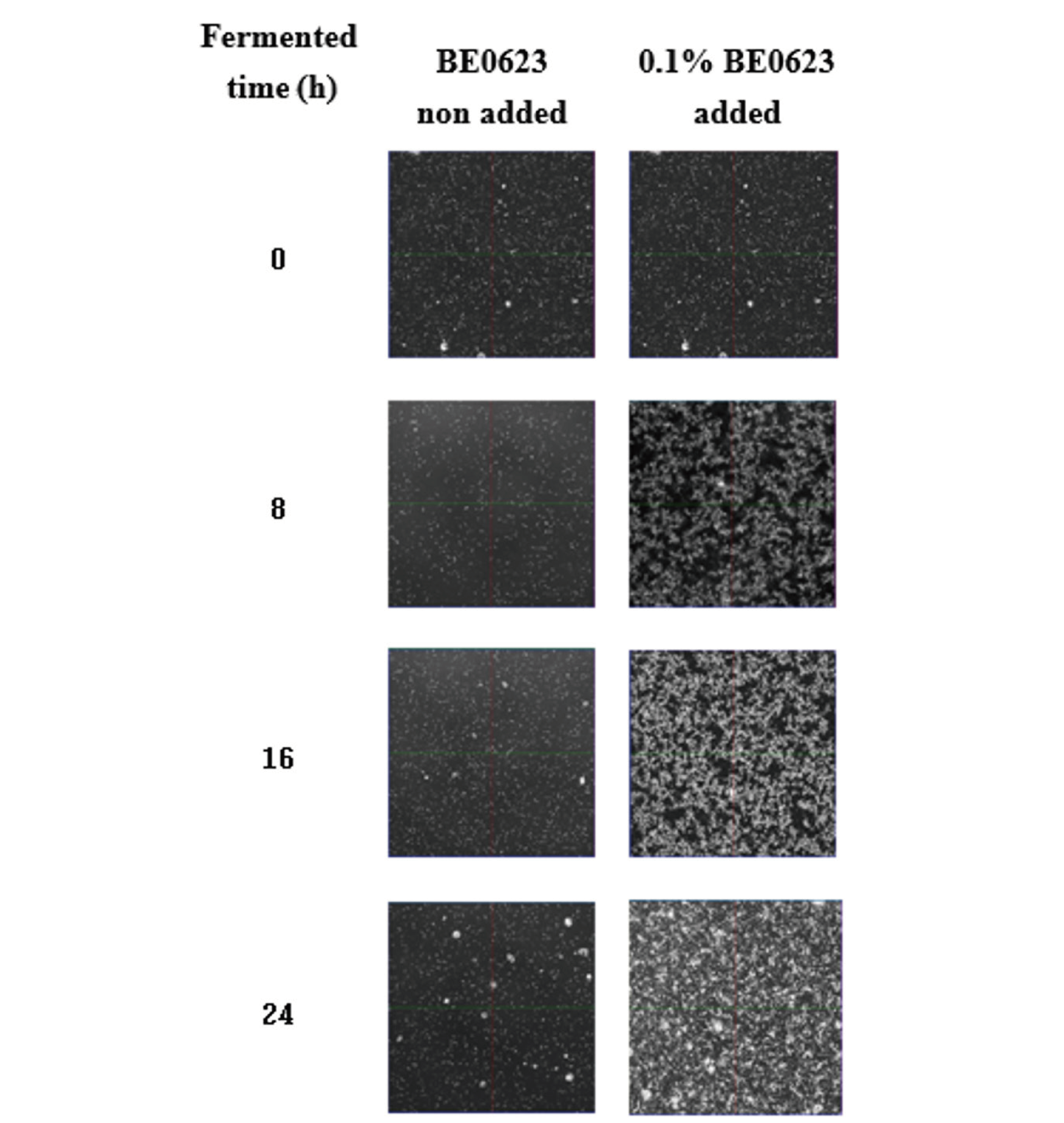
BE0623의 bifidobacteria 성장촉진효과를 시각적으로 확인하기 위해 레이져 스케닝 현미경인 LSM 780로 촬영을 실시하였다. BE0623을 첨가한 탈지분유 배지에 Bifidobacterium lactis (BB12)를 접종한 후 발효 0, 4, 8, 12, 16, 20 및 24시간에 현미경 촬영을 시행하여 균의 증식 여부를 육안으로 확인하였으며, 발효 시간에 따른 결과는 Fig. 2에 나타내었다. Fig. 2에 나타난 하얀 부분은 Bifidobacterium lactis (BB12)의 균체로서 BE0623의 bifidobacteria 성장촉진효과를 검정한 결과 배양 8시간 후부터 BE0623첨가 배지에서 Bifidobacterium lactis (BB12)의 급격한 증식을 확인할 수 있었다. 반면 BE0623을 첨가하지 않은 대조군에서는 배양 24시간까지 bifidobacteria 증식의 급격한 변화는 관찰할 수 없었으며, 이러한 결과는 앞에서 살펴본 발효 중 생균수 및 산도 측정을 통한 bifidobacteria 증식 효과 결과와 일치하였다.
바이오필름 형성을 통한 bifidobacteria 증식 효과 규명
미생물 연구에 있어서 미생물이 단독으로 존재하는 경우와 집단으로 존재하는 경우 미생물이 갖는 의의는 크게 다르다고 할 수 있다. 종래의 미생물 증식에 대한 관찰은 2차원적인 평면으로 개개의 세포수가 증감하는 것을 확인하는 수준이었으나, 최근 기술의 발달로 인해 미생물의 증식이 3차원인 입체적으로 일어난다는 것을 현미경 촬영을 통해 확인할 수 있었다. 개개의 미생물은 집단으로 형성되어 서로 communication을 하므로 개개 이상의 능력 혹은 미생물 제어능을 갖게 되는데 여기서 communication을 하는 미생물 집단의 형성을 바이오 필름이라 부른다. 즉 바이오 필름은 넓은 의미로 외부 세포막 사이를 둘러싼 표면에 존재하는 관련된 미생물의 집합체라고 정의할 수 있으며(Costerton et al., 1994), bacterial biofilm은 미생물이 생존하기 위해 표면 또는 미생물 간에 접착하고 있는 형태를 의미한다. 본 연구에서는 BE0623에 의한 bifidobacteria의 증식 과정을 연속적으로 관찰함으로서 배양 후기에 바이오 필름으로 여겨지는 미생물 층이 형성되는지 여부를 관찰하였다. Bifidobacteria의 바이오 필름 형성은 균이 갖는 영향력을 대폭적으로 높일 것으로 기대되어 bifidobacteria 유용성을 검정하는데 있어서 아주 중요한 요인이라 생각된다. Fig. 3은 BE0623에 의한 Bifidobacterium lactis (BB12)의 바이오 필름 형성과정을 나타낸 것으로 시간 경과와 함께 균체의 증식 및 배양 후반에 Bifidobacterium lactis (BB12)의 미생물 층이 구름처럼 형성되는 것을 확인할 수 있다. 이로부터 BE0623의 bifidobacteria 증식 효능을 다시 한 번 확인할 수 있었으며, 바이오 필름 형성을 통해 bifidobacteria의 영향력이 더욱 증가될 것으로 생각된다. 예를 들어 bifidobacteria가 집단 증식을 일으켜 바이오 필름을 형성했을 경우, 형성된 바이오 필름은 bifidobacteria 개개의 세포보다 외부 인자로부터의 공격을 잘 막을 수 있다는 것을 예측할 수 있다. 이러한 측면에서 볼 때, bifidobacteria나 유산균 등 유용한 미생물을 증식시켜 인간에 대해 유용한 건강증진 효과를 부여하는 미생물 기능성 연구에 있어서 미생물의 바이오 필름 형성 및 바이오 필름 억제는 매우 중요한 요소라고 생각된다.
상업용 bifidobacteria 성장촉진물질과 BE0623의 효능 비교
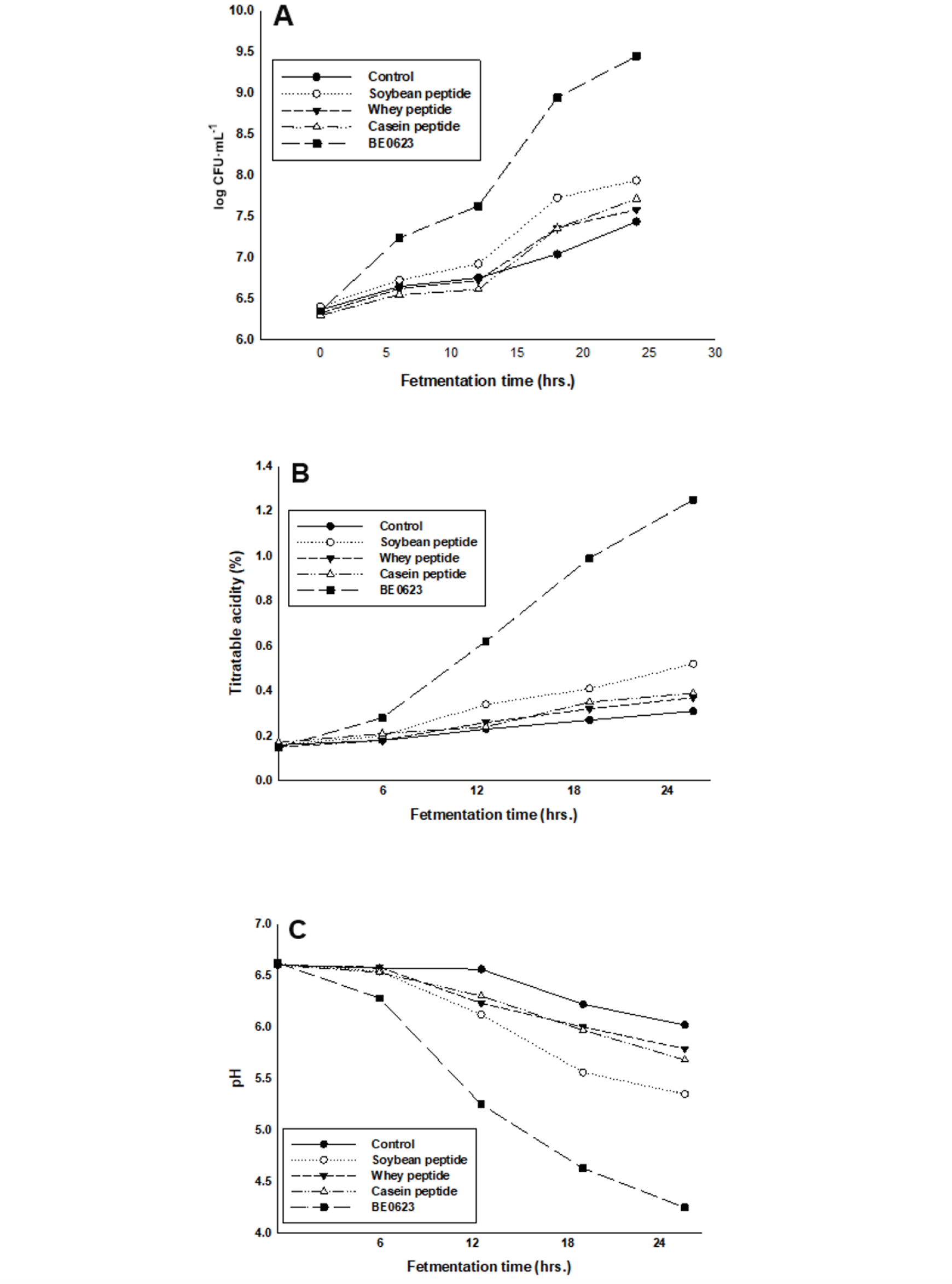
시판 bifidobacteria 성장촉진물질과 BE0623이 bifidobacteria 성장촉진효과의 차이가 있는지 알아보기 위해 산업게에서 사용하는 대두 펩타이드, 케이신 펩타이드, 훼이 펩타이드 등의 증식제와 BE0623간의 비교실험을 시행하였다. BE0623과 3종의 peptides를 각각 탈지분유 배지에 첨가한 후 bifidobacteria의 발효시간에 따른 산 생성량을 적정하였으며, 해당 시간의 bifidobacteria의 생균수, 산도 및 pH를 측정하였다. BE0623과 peptides 중 무첨가 발효유를 대조군으로 하였다. 각 물질의 발효시간에 따른 생균수, 산도 및 pH 변화는 Fig. 4에 나타낸 바와 같다. 대두 펩타이드, 케이신 펩타이드, 훼이 펩타이드 및 대조군, BE0623 첨가군의 초기 bifidobacteria의 생균수는 2.01 × 106 - 2.5 × 106 CFU·mL-1으로 유사한 수준이었다. 발효 12시간 경과 후 생균수는 대두 펩타이드 8.43 × 106 CFU·mL-1, 케이신 펩타이드 4.12 × 106 CFU·mL-1, 훼이 펩타이드 5.31 × 106 CFU·mL-1로 대조군 5.71 × 106 CFU·mL-1 대비 유의적인 증가는 보이지 않았다. BE0623 첨가군의 경우 4.24 × 107 CFU·mL-1로서 대조군 대비 약 7.4배의 균수 차이를 나타내었다. 발효 종점인 24시간에서의 생균수는 대두 펩타이드 8.72 × 107 CFU·mL-1, 케이신 펩타이드 5.21 × 107 CFU·mL-1, 훼이 펩타이드 3.84 × 107 CFU·mL-1로 대조군 2.74 × 107 CFU·mL-1 대비 각각 약 3.1, 1.9, 1.4배로 소폭의 균수 증가를 나타낸 반면 BE0623 첨가군은 2.81 × 109 CFU·mL-1로서 대조군 대비 약 102배의 균수 차이를 나타내었다. 또한 발효 중 적정산도는 발효 12시간에서 대두 펩타이드 0.34%, 케이신 펩타이드 0.24%, 훼이 펩타이드 0.26%로 대조군 0.23% 대비 유의적인 증가는 보이지 않았다. 발효 종점인 24시간에서의 적정 산도는 대두 펩타이드 0.52%, 케이신 펩타이드 0.39%, 훼이 펩타이드 0.37% 로 대조군 0.31% 대비 유의적인 산도 증가를 나타내지 않았으나 BE0623 첨가군은 1.25 %로서 대조군 대비 약 4배의 산도 차이를 나타내었다. pH의 경우는 각각의 실험군에서 적정산도와 반비례의 수치를 나타내었다. 이상의 결과로 볼 때 BE0623가 시판되는 증식제인 대두 펩타이드, 케이신 펩타이드, 훼이 펩타이드 보다 뛰어난 bifidobacteria 증식 촉진 효과를 갖고 있음을 알 수 있었다. 한편 비수용성 섬유소는 콜레스테롤 대사 작용을 촉진시키고(Chau et al., 2004; Lin et al,. 2011; Zacherl et al., 2011; Zhang et al., 2011) 장의 박테리아(Bacterodes, Bifidobacterium lactis, Eubacterium) 증식과 발효 효과 및 대변 량을 증가시켜 장 통과시간을 단축시키는 생리적 기능을 한다고 보고하였다(Takahashi et al., 1993).
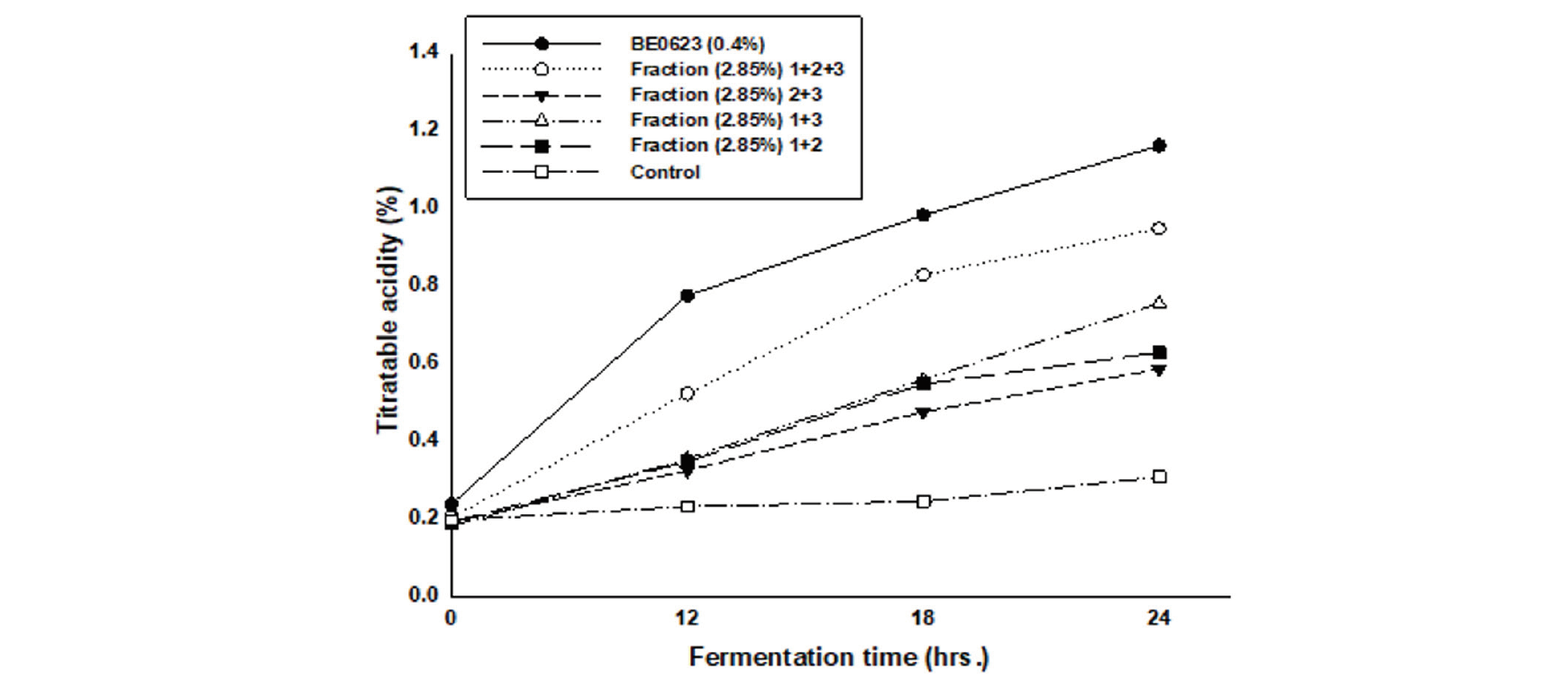
BE0623 분획의 Bifidobacteria 성장촉진 효과
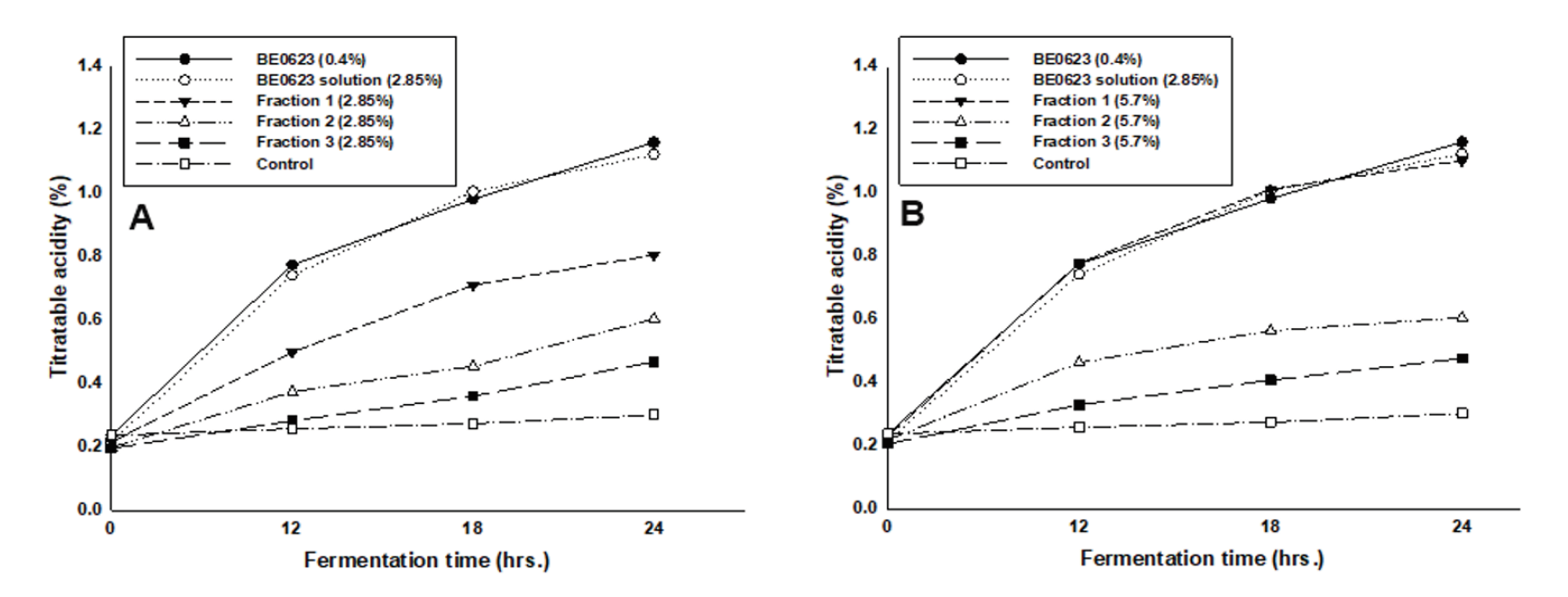
BE0623은 청주 제조 중 생성되는 부산물인 주박으로 다양한 성분이 혼합된 복합체이다. 따라서 BE0623의 성분 중 어떤 성분이 bifidobacteria의 성장을 촉진시키는 역할을 하며, 어떤 메커니즘으로 성장촉진작용을 하는지 밝히기 위해 BE0623를 분리하였다. 분리된 분획 1, 2, 3을 획득하였으며, 분획 1은 미네랄, 비타민, 기타 분자량 1,000 dalton 이하의 물질, 분획 2는 분자량 1,000 dalton 이상의 수용성 단백질, 분획 3은 당 등을 포함하는 분자량 1,000 dalton 이상의 불용성 물질로 예상된다. 획득한 분획 1, 2, 3의 bifidobacteria 증식 효능은 아래 Fig. 5에 나타낸 바와 같다. 각 분획에 BE0623 용액과 동일한 효능을 가진 유효성분이 함유되어 있다는 가정 하에 2.85%에 해당되는 BE0623용액(0.4% BE0623과 동일 수준)과 각 분획을 첨가한 배지에서 bifidobacteria를 배양한 후 발효 중 균이 생산하는 산을 적정하였다. Fig. 6에서 알 수 있듯이 각 분획물의 bifidobacteria 증식 효능은 BE0623 용액보다 떨어졌으나 24시간 발효 후 대조군의 산도가 발효 초기의 1.28배 증가한 것에 비해 분획 1, 2, 3은 각각 3.73, 3.05, 2.40배 증가하여 대조군에 비해서는 높은 증식 효능을 보이고 있다. 분획물 중 가장 우수한 효능을 나타내는 것은 분획 1로 분자량 1,000 dalton 이하의 저분자 물질이 bifidobacteria 증식에 보다 뛰어난 것으로 판단된다. 분획물의 농도에 따른 bifidobacteria 증식 효과를 밝히기 위해 분획물의 농도를 2배 증가시켜 bifidobacteria를 배양한 후 미생물이 생산하는 산도를 측정하였다. 아래 Fig. 5에 나타낸 바와 같이 첨가하는 분획물의 농도를 2배로 증가했을 때 분획 1, 2, 3의 초기 산도 대비 24시간 발효 후 산도는 각각 4.85, 2.78, 2.32배 증가하였으며 2.85% 분획을 첨가했을 때의 3.73, 3.05, 2.40배와 비교 시 분획 1만 증식 효과가 증가할 뿐 분획 2, 3은 뚜렷한 변화를 보이지 않았다. 따라서 분획 1에 bifidobacteria 증식에 영향을 미치는 물질이 보다 많이 함유되어 있음을 알 수 있었다. 또한 각 분획물 단일의 효과뿐 아니라 분획물 간의 상호작용을 알아보기 위해 각 분획을 조합 (분획1 + 2 + 3, 분획2 + 3, 분획1 + 3 및 분획1 + 2)한 배양액에 bifidobacteria를 접종한 후 증식을 관찰한 결과는 Fig. 6에 나타내었다. 분획물을 단일 첨가했을 경우에 비해 모든 조합의 경우 bifidobacteria가 증가하였으며, 분획 1, 2, 3 모두를 첨가했을 때 증식 효과가 가장 우수하였다. 또한 분획 1, 2, 3중 어느 하나가 첨가되지 않았을 경우 증식 효과가 감소하는 경향이 나타남을 확인할 수 있었으며 이로부터 분획 1뿐 아니라 분획 2 및 분획 3에도 bifidobacteria의 증식을 촉진하는 물질이 함유되어 있음을 알 수 있었다. 상기 결과로부터 BE0623에는 bifidobacteria 성장 촉진에 관여하는 다양한 물질이 함유되어 있는 것으로 판단되며, 그 성분은 아미노산, 당, 미네랄의 복합물일 것이라고 짐작되나 이를 규명하기 위해서는 좀 더 상세한 분석이 요구된다.
Conclusion
Bifidobacteria 성장촉진물질인 BE0623의 첨가는 발효유에서 bifidobacteria 생균수가 대조군에 비해 약 45 - 75배로 대폭 증가하였으며, 유산과 초산으로 인해 적정 산도가 증가되고 pH가 낮아졌다. 또한 현미경 관찰에서는 BE0623을 첨가한 발효유에서 뚜렷한 bifidobacteria 증식 효과가 나타났다. Bifidobacteria의 생균수도 무첨가 대조군에 비해 약 102배 증가하였으며, 시판되는 성장촉진물질보다 높게 증가하였다. BE0623의 분리를 통해 획득한 분획들의 bifidobacteria 증식 효능은 모든 분획물에서 나타났다. 분획물들 간의 시너지 효과는 각 분획을 조합하여 bifidobacteria를 배양한 결과는 단일 분획물을 첨가했을 때 보다 bifidobacteria의 증식 정도가 높았다. 분획물 중 어느 하나라도 무첨가 되었을 경우 증식 효과는 감소하였다. 이러한 결과는 모든 분획물에 bifidobacteria의 성장을 촉진하는 물질이 함유되어 있음을 알 수 있었다.