Introduction
영유아기에는 일생 중 신체적 성장과 뇌의 발달이 가장 활발하고 높은 성장률을 보이므로 적절한 영양공급이 무엇보다 중요하다. 세계보건기구(WHO)에 따르면 모유는 영·유아의 건강한 성장과 발육에 필요한 영양을 제공하는 가장 이상적인 공급원으로서, 최적의 성장 발달을 위해서는 생후 첫 6개월동안은 전적으로 모유를 수유하기를 권장하고 있다(WHO, 2003). 근래에는 여성들의 사회진출이 증가함에 따라 조제분유의 사용이 보편화 되었다. 조제분유는 모유 수유가 어려운 환경이거나 혹은 수유양이 충분하지 못한 경우에도 손쉽게 영유아에게 제공할 수 있다는 이점이 있다. 식약처 식품유형별 기준규격에 따르면 조제분유는 특수용도식품군에 속하는 조제유류로서 원유 혹은 유가공품을 주원료로 하여 영·유아의 성장발육에 필요한 비타민, 무기질 등의 영양성분을 첨가하여 모유의 성분과 유사하게 가공한 것으로 정의하고 있다(MFDS, 2021a). 조제분유는 소화기관이 잘 발달되지 않은 아기가 우유를 쉽게 소화할 수 있도록 가공한 것으로, 초기 제품은 우유에 당류(포도당, 유당, 설탕 등)와 비타민, 무기질을 첨가한 제품이었다(Jin, 2005). 점차로 모유를 gold-standard로 한 조제분유의 영양성분을 모유와 유사하도록 보강하는 연구들이 지속적으로 이루어져 많은 제품들이 생산되고 있다. 국내 유아용 조제분유는 1970년대 이후로 모유와 유사하도록 유청단백질, 필수지방산, 칼슘, 철분 등이 강화되었으며, 1990년대 이후로는 프리미엄 개념의 arachidonic acid (C20:4, ARA, omega-6) 첨가 및 면역기능이 강화된 제품이 출시되었다. 2000년대 이후로는 docosahexaenoic acid (C22:6, DHA, omega-3)의 첨가 및 ARA : DHA의 비율 조정 등으로 프리미엄 조제분유들이 출시되었다. 조제분유의 개발은 모유의 영양성분들에 근거하여 이루어져야 하며, Duan 등(2019a)의 연구에 따르면 한국인 모유(n = 34, mature milk 42 - 264 days)에는 카로티노이드 중에 루테인(lutein)과 지아잔틴(zeaxanthin) 함량이 평균 3.85 µg·100 g−1으로 가장 높았고 다음 베타크립토잔틴(β-crpytoxanthin)과 베타카로틴 함량(β-carotene)이 각각 3.60 µg·100 g−1과 1.68 µg·100 g−1함유하였다. 이외에 lycopene 함량이 평균 0.34 µg·100 g−1을 나타내었다. 모유에는 총포화지방산과 총불포화지방산 함량이 각각 40.2%와 59.1%이었으며, 이때 ARA와 DHA 함량은 각각 0.54%와 0.77%함유되어 있다고 보고하였다. Xue 등(2017)의 보고에 따르면 중국인 모유에는 β-carotene, lycopene, β-crpytoxanthin, lutein, zeaxanthin이 주로 검출되며, 이들 카로티노이드류는 주로 식물체에 존재하며 인체내에서 합성이 안되므로 식품을 섭취함으로써 함유되는 성분들이다.
조제분유에 함유된 대표적인 지용성 영양성분은 토코페롤(tocopherol), 레티놀(retinol), 카로티노이드(carotenoid), 지방산(fatty acid), 콜레스테롤(cholesterol), 인지질(phospholipid) 등이 있다. 조제분유 중에 존재하는 토코페롤(비타민 E)은 α-, β-, γ-, δ-tocopherol들이 주로 존재하고 그 이성체인 α-, β-, γ-, δ-tocotrienol이 소량 검출될 수 있으며, 모유에는 주로 알파토코페롤을 함유하고 있다(Duan et al., 2021a). 비타민 E는 인체 내의 활성산소를 소거시켜 항산화 작용을 하여 세포막과 지단백(lipoprotein)의 산화로부터 지방산을 보호한다(Ricciarelli et al., 2001). 또한, 염증성 질환을 예방하고 면역력을 향상시키기 때문에 영유아에 필요한 영양성분이다(Ricciarelli et al., 2001; Xue et al., 2017). 비타민 A는 레티놀과 비타민 A의 활성을 나타내는 카로티노이드류(알파카로틴, 베타카로틴, 베타크립토잔틴)의 총칭이다. 모유의 비타민 A는 레티놀의 저장형태인 레티닐 에스테르 뿐만 아니라 프로비타민 A인 카로티노이드로도 존재하며, 상피세포와 점막의 기능을 유지하고, 영유아의 성장에 있어서 필수적인 대사 기능과 시각 발달에 중요한 역할을 한다(Xue et al., 2017). 영유아에게 필요한 영양성분인 루테인(lutein)과 지아잔틴(zeaxanthin)은 눈 건강 및 발달, 질환 예방에 도움을 주며, lycopene은 항산화에 도움을 주고 면역력을 향상시켜줄 수 있는 대표적인 카로티노이드이다(Duan et al., 2019a). 조제분유에서 지방은 대표적인 에너지원으로 이용이 되며 동시에 지용성 비타민들(A, D, E, K)이 원활하게 흡수되도록 도와주는 영양성분이다(Son et al., 2011). 지방산들 중 다가불포화지방산인 ARA (C20:4)와 DHA (C22:6)는 뇌에 가장 많이 존재하는 지방산으로서 결핍시 두뇌발달과 감각 기능 등에 영향을 줄 수 있다(Mozaffarian and Rimm, 2006; Zou et al., 2021). 또한, ARA와 DHA의 균형있는 섭취는 만성질환과 염증 예방에 중요하다고 보고되고 있다(Simopoulos, 2011). 식품의약품안전처의 식품별 기준 및 규격에서는 영유아용 조제분유에서 리놀레산(linoleic acid, C18:2, omega-6)과 α-리놀렌산(α-linolenic acid, C18:3, omega-3)의 비율이 5 : 1 - 15 : 1의 비율이 되도록 기준을 제시하고있다(MFDS, 2021a). 모유에서 지방구는 human milk fat globule (MFGM)이라고 하는 콜로이드 집합체 형태로 존재하며, 인지질 삼중막(phospholipid trilayer membrane)으로 둘러싸여 있다(Zou et al., 2012). 모유에 존재하는 대표적인 인지질은 phosphatidylehanolamine (PE), phosphatidylcoline (PC), sphingomyelin (SM), phosphatidylserine (PS) 등이 주로 존재하며, 한국인 모유에는 SM이 2.35 - 8.32 mg·100 g−1으로 가장 높은 함량을 보이며, 다음 PC (1.13 - 3.14 mg·100 g−1)와 PE (0.68 - 4.21 mg·100 g−1)순으로 검출된다고 하였다(Duan et al., 2021b). 이들 인지질은 세포막을 구성하고 뇌 및 폐의 발달 및 중추신경계의 발달에 중요한 역할을 한다(Jiang et al., 2018). 특히 PE와 PC는 각각 콜레스테롤 감소와 간 질환 치료에 도움을 주고, PC와 SM은 염증으로부터의 보호 및 뇌 발달과 밀접한 관련이 있으며, PS는 중추신경계의 발달에 중요한 인자로 보고되고 있다(Cohn et al., 2008; Claumarchirant et al., 2016; Duan et al., 2021b).
본 연구에서는 시중에 유통되고 있는 수입산 조제분유 4종(SPA, SPS, SFS, SSI)과 국내산 조제분유 3종(MLM, MPM, NIX)에 함유된 비타민 E(토코페롤 및 토코트리에놀), 비타민 A (retinol)와 카로티노이드류(루테인, 지아잔틴, 베타크립토잔틴, lycopene, 알파카로틴, 베타카로틴), 지방산 함량 및 콜레스테롤, 인지질조성을 분석하여 비교하였다. 본 연구결과는 조제분유 개발을 위한 기초자료로 이용될 수 있을 것으로 사료된다.
Materials and Methods
실험재료
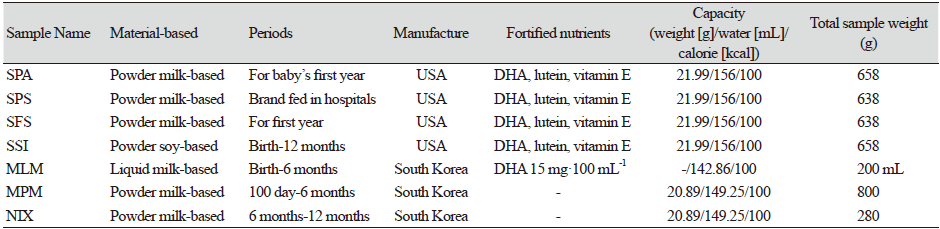
실험에 사용된 시중에 유통되고 있는 수입산 조제분유 4종(SPA, SPS, SFS, SSI)과 국내산 조제분유 3종(MLM, MPM, NIX)은 매일유업㈜에서 제공받아 분석에 사용하였다. 7종의 조제분유 정보는 Table 1에 나타내었다. 수입산 조제분유 SPA와, SPS, SFS는 분말의 milk-based 제품들로서 DHA와 lutein, 비타민 E가 강화된 제품들이었고, SSI 제품은 soy-based 분말제품으로서 DHA와 lutein, 비타민 E가 강화된 제품이었다. 국내산 조제분유 3종에서 MLM은 액상유 제품이었으며, MPM과 NIX는 milk-based 분말 제품들이었다. 기기분석에 사용된 유기용매들(n-hexane, chloroform, methanol, acetonitrile, isopropanol, n-heptane)은 HPLC grade (Fisher Scientific Korea LTD., Seoul, Korea)이었다. Pyrogallol (254002-250 g)과 hexamethyldisilazane (52619-50 mL, ≥ 99.0% purity), chlorotrimethylsilane (92360-25 mL, ≥ 99.0% purity) 그리고 각 영양성분들의 검량선 작성에 사용된 표준품들(cholesterol, C8667-5 g; retinol, R7632-25 mg; α-tocopherol, T3251-5 g; rac-β-tocopherol, Supelco 46401-U; γ-tocopherol, T1782-25 mg; δ-tocopherol, T2028-25 g; 5α-cholestane, C8003-1 g; L-α-phosphatidylethanolamine, P7943-25 mg; L-α-phosphatidylcholine, P3556-25 mg; L-α-phosphatidyl-L-serine, P0474-25 mg; sphingomyelin, 85615-50 mg)은 Sigma-Aldrich Korea (Seoul, Korea)에서 구입하였다.
알칼리 검화법에 의한 토코페롤, 레티놀, 카로티노이드, 콜레스테롤 동시 추출법
조제분유에서 토코페롤, 레티놀, 카로티노이드, 콜레스테롤의 지용성 비검화물들은 알칼리로 검화한 후 지용성 용매로 다음과 같이 동시 추출하였다(KFDA, 2012; Duan et al., 2019b; MFDS, 2021b). 시료 2 g을 100 mL의 추출관에 취하고 항산화제로 6% pyrogallol ethanol 용액을 첨가하여 시료와 잘 혼합되도록 vortex로 균질화하였다. 다음 초음파 추출기(JAC 2010, KODO Ultrasonic Co., Hwaseong, Korea)에서 10분동안 추가 균질화를 진행한 후 60% KOH 용액 8 mL을 첨가하여 vortex로 균질화하고 추출관의 내부공기를 질소로 1분동안 치환하였다. 다음 추출관에 air condenser를 연결하여 75℃의 100 rpm으로 설정된 shaking water bath (VS-310SWR, Vision Scientific Co., Ltd., Daejeon, Korea)에서 1시간동안 검화를 진행하였다. 검화를 완료한 후 추출관이 충분히 냉각되었을 때 2% NaCl 용액 20 mL과 추출용매(n-hexane : ethyl acetate = 85 : 15, v/v, 0.01% butylated hydroxytoluene [BHT]) 15 mL을 첨가하고 vortex로 2분동안 혼합하였다. 비검화물을 포함하고 있는 분리된 상등액을 anhydrous sodium sulfate column을 통과하여 수분을 제거하고 50 mL 정용플라스크에 옮겼다. 이러한 추출과정을 세번 반복수행하여 얻어진 비검화물 추출액은 50 mL 정용플라스크에서 눈금까지 정용한 후 잘 혼합하였다. 이렇게 얻어진 비검화물 추출액 50 mL는 각각 일정한 양을 취하여 토코페롤, 레티놀, 카로티노이드, 콜레스테롤 함량 분석에 사용하였다. 이때 각 시료의 분석은 3반복으로 수행되었다. 레티놀과 비타민 A활성을 나타내는 카로티노이드는 레티놀 활성당량(retinol activity equivalent, RAE)으로 다음과 같이 환산하였다(RDA, 2016).
1 RAE = (1 µg retinol) + (1/12 µg β-Carotene) + (1/24 µg α-Carotene or β-Cryptoxanthin) (1)
HPLC를 이용한 토코페롤 함량 분석
조제분유에서 토코페롤함량은 식품공전의 일반시험법에서 비타민 E의 HPLC 정량법에 준하여 분석하였다(KFDA, 2012; MFDS, 2021c). 시료를 알칼리로 검화한 후 얻어진 비검화물 추출액에서 4 mL을 25-mL screw-capped vial에 취하고 질소로 용매를 완전히 제거하여 n-hexane 2 mL에 재용해하였다. 재용해된 추출물은 0.5 μm disposable syringe filter (PTFE, Advantec, Tokyo, Japan)로 여과하여 토코페롤 정량을 위한 normal-phase HPLC (JASCO, Tokyo, Japan) 분석에 사용하였다. 분석컬럼은 LiChrosphere®Diol 100 (250 × 4 mm, 5 μm, Merck KGaA, Darmstadt, Germany)이었고, 이동상은 n-hexane : isopropanol (99.4 : 0.6, v/v) 혼합용매를 1 mL·min-1의 유량으로 등용리 조건에서 분석하였다. 검출기는 여기파장(Exλ) 290 nm와 측정파장(Emλ) 330 nm로 설정되어 있는 fluorescence detector (FP-4025, JASCO, Tokyo, Japan)를 이용하였다. α-토코페롤(α-T), β-토코페롤(β-T), γ-토코페롤(γ-T), δ-토코페롤(δ-T)의 검량선은 0.625, 1.25, 2.5, 5, 10, 20, 40 μg·mL-1의 농도들로 작성하였고, 시료양과 희석배수를 감안하여 시료에서의 각 토코페롤 함량(mg·100 g−1)으로 환산하였다. 이들의 각 4종의 토코트리에놀(T3) 이성체들은 각각의 토코페롤 검량선을 이용하여 정량하였다. 토코페롤함량으로 체내 비타민 E 활성을 나타내는 α-tocopherol equivalent (α-TE)를 다음과 같이 환산하여 나타내었다.
α-TE = (α-T × 1.0) + (β-T × 0.5) + (γ-T × 0.1) + (δ-T × 0.01) + (α-T3 × 0.3) + (β-T3 × 0.05) (2)
HPLC를 이용한 레티놀 함량 분석
조제분유에서 레티놀 함량은 normal-phase HPLC 분석으로 이루어졌다. 비검화물 추출액 10 mL을 25-mL screw-capped vial에 취하여 질소로 용매를 완전히 제거하였다. 다음 잔류물에 chloroform 1 mL를 첨가하여 재용해한 후 0.5 μm disposable syringe filter로 여과하여 HPLC 분석에 사용하였다. 레티놀의 HPLC 분석을 위한 컬럼은 LiChrosphere®Diol 100 (250 × 4 mm, 5 μm, Merck KGaA, Darmstadt, Germany)이었고, 이동상은 n-hexane : isopropanol (95 : 5, v/v) 혼합용매를 등용리조건에서 1 mL·min-1의 유량으로 분석하였다. 분석에 사용된 형광검출기는 여기파장(Exλ) 326 nm와 측정파장(Emλ) 470 nm으로 설정하였다. 레티놀 표준품의 검량선 농도는 0.625, 1.25, 2.5, 5, 10, 20, 40 μg·mL-1이었으며, 시료양과 희석배수를 감안하여 시료에서의 레티놀 함량(μg·100 g−1)을 구하였다.
HPLC를 이용한 카로티노이드 함량 분석
조제분유에서 카로티노이드는 α-carotene, β-carotene, β-cryptoxanthin, lycopene, 그리고 lutein + zeaxanthin의 함량을 분석하였다(Duan et al., 2019a). 검화 후 얻어진 비검화물 추출액 10 mL을 25-mL screw-capped vial에 취하고 용매를 질소로 완전히 제거하여 n-hexane 1 mL에 재용해하였다. 다음 0.5 μm disposable syringe filter로 여과하여 reversed-phase HPLC 분석(Younglin, Anyang, Korea)에 사용하였다. 카로티노이드 분석에 사용된 컬럼은 Shiseido Capcell Pak UG120 C18 (250 × 4.6 mm, 5 μm, Shiseido, Tokyo, Japan)이었으며 자외부흡광광도검출기(UV/Visible detector)가 장착되어 있어 450 nm의 파장에서 분석하였다. 이동상은 기울기 용리로 A 용매는 acetonitrile:methanol:methylene chloride 혼합용매의 비율이 75 : 20 : 5 (by volume)이었으며 B 용매는 A 혼합용매의 비율이 70 : 10 : 30 (by volume)이 되도록 하였다. 분석조건은 전의 보고한 것에 준하였다(Duan et al., 2019a). 카로티노이드 6종의 표준품을 구입하여 각각 0.1, 0.5, 1, 5, 10, 20, 40 μg·mL-1의 농도로 검량선을 작성하여 시료양과 희석배수를 감안하여 시료에서의 함량(μg·100 g−1)을 구하였다. 이때 lutein과 zeaxanthin의 함량은 합으로 나타내었다.
콜레스테롤 유도체화 및 GC를 이용한 함량 분석
조제분유에서 콜레스테롤 함량은 추출한 비검화물 일정량을 취하여 식품공전법에 따라 트리메틸실릴(trimethylsilane, TMS) 에테르화하여 유도체화한 후, gas chromatography (GC, YL6100, Younglin Co., Ltd., Anyang, Korea)로 정량하였다(KFDA, 2012; Lee et al., 2015; MFDS, 2021b). 검화 후 얻어진 추출액 12.5 mL을 25-mL vial에 취하여 질소로 용매를 완전히 제거하고, acetone 3 mL을 첨가하여 vortex로 균질화하여 다시 질소로 용매를 완전히 제거하였다. 건조된 vial에 dimethyl formamide (DMF) 3 mL을 첨가하고 vortex로 진탕한 후 이 중에서 1 mL을 시험관(test tube)에 취하여 hexamethyldisilazane 0.2 mL와 trimethyl chlorosilane 0.1 mL를 넣고 마개를 받아 1분 동안 vortex로 진탕하여 상온에서 15분동안 정치하여 유도체화 하였다. 다음 각 시험관에 내부표준물질인 5α-cholestane (0.1 mg·mL-1 in heptane, ≥ 97%)와 증류수 10 mL를 첨가하여 마개를 닫고 1분동안 진탕하였다. 상온에서 방치하여 층분리된 상층(heptane 층)을 anhydrous sodium sulfate column을 통과하여 수분을 제거하고 이를 GC vial에 옮겼다. 콜레스테롤 분석은 HP ultra-2 column (Crosslinked 5% PH ME siloxane, 25 m × 0.2 mm × 0.33 μm, Agilent, Santa Clara, USA)이 장착되어 있는 GC (YL6100, Younglin, Anyang, Korea)를 사용하였다. 분석 oven 온도는 초기 250℃에서 5분동안 유지하고 285℃까지 10℃·min-1으로 상승하여 20분동안 유지하도록 하였다. 주입구와 검출기 온도는 각각 280℃와 300℃로 설정하였으며, carrier gas는 He이었다. 콜레스테롤 정량을 위한 검량선은 내부표준물질과 콜레스테롤 표준품의 농도별 면적비(cholesterol area/5α-cholestane area ratio)를 구하여 식품공전법에 따라 작성하였다(KFDA, 2012; MFDS, 2021b).
조지방 추출 및 GC를 이용한 지방산 함량 분석
조제분유에서 조지방 추출 및 지방산 함량분석은 식품공전법(MFDS, 2021d)과 AOAC (2001)의 방법에 따라 산가수분해법으로 추출한 후 수산화나트륨 메탄올용액(0.5 N NaOH)과 BF3 메탄올 용액으로 지방산 메틸에스테르화하여 GC로 분석하였다. 시료 1 g과 6% pyrogallol ethanol용액 2 mL, triundecanoin (internal standard, 5 mg·mL-1 in iso-octane) 1 mL을 50 mL vial에 취하여 균질화 한 후, 8.3 M HCl 용액 10 mL을 첨가하여 80℃, 200 rpm으로 설정된 shaking water bath에 1시간동안 가수분해하였다. 반응 후 diethyl ether와 petroleum ether를 각각 15 mL씩 첨가하여 조지방을 추출하였고, 2회 반복 추출한 후 용매를 완전히 제거하여 조지방 함량을 구하였다. 얻어진 조지방에 0.5 N methanolic NaOH 용액 3 mL을 첨가하여 85℃에서 10분동안 1차 methylation을 진행하였고, 다음 충분히 냉각한 후 14% BF3 메탄올 용액 5 mL을 첨가하여 85℃에서 10분동안 2차 methylation을 진행하였다. 반응 완료 후 iso-octane 5 mL과 포화 NaCl 용액 1 mL을 첨가하여 vortex 한 후 분리된 상층을 GC분석에 사용하였다. 지방산 함량 정량을 위한 GC (Hewlett-Packard 6890 series, Agilent, Santa Clara, USA)는 SP™-2560 column (100 m × 0.25 mm, 0.2 μm film thickness, Sigma-Aldrich Co., St. Louis, MO, USA)이 장착되어 있고, carrier gas는 He으로 유량이 0.7 mL·min-1이였다. 주입구와 검출기 온도는 각각 225℃와 285℃으로 설정하였으며, split ratio는 200 : 1 이었다. 각 지방산들의 피크 동정은 Supelco 37 Component FAME (CRM47885, Supelco., Bellefonte, PA, USA)에 의하여 이루어졌으며, 지방산 정량은 g·100 g−1으로 나타내었다(Duan et al., 2019a).
인지질 추출 및 HPLC-ELSD 함량 분석
조제분유에서 인지질의 추출 및 분석은 Duan 등(2021b)의 방법에 준하여 수행되었다. 조제분유 0.5 g의 시료를 증류수 6 mL에 완전히 녹여서 folch 용액(chloroform : methanol = 2 : 1, v/v) 24 mL을 첨가하여 2분동안 vortex하였다. 다음 원심분리(3,000 rpm, 10분)하여 하층(chloroform 층)을 무수황산나트륨이 충진된 column을 통과하여 수분을 제거한 후 25 mL 정용병에 모았다. 남은 상층에 chloroform 12 mL과 methanol 1 mL을 첨가하여 반복추출하여 얻어진 하층을 다시 25 mL 정용병에 함께 모아서 N2로 용매를 완전히 제거한 후 무게를 측정하였다. 추출한 시료는 folch 용액 100 µL에 녹여서 HPLC 분석에 사용하였다. 각 인지질 표준품은 0.05 - 2 mg·mL-1의 농도범위로 검량선을 작성하였다. 인지질 정량분석은 YMC-Pack PVA-Sil column (S-5 µm, 250 × 4.6 mm I.D., YMC Co., Schermbeck, Germany)과 evaporative light scattering detector (ELSD, ZAM3000, Bad Honnef, Germany)으로 장착되어 있는 normal-phase HPLC 조건으로 분석하였다. ELSD 검출기의 분석 조건은 set heating 65℃와 nebulizing gas flow 2.0 L·min-1으로 설정하였다. 이동상은 기울기용리로 A 용매(2-propanol), B 용매(hexane), C 용매(water)를 초기 A 용매 : B 용매 : C 용매 = 58 : 42 : 0 (v/v/v)의 비율로 흘려주다가 4분까지 58 : 40 : 2 (A : B : C, v/v/v) 비율로 변경되도록 하였으며, 이후 11분까지 52 : 40 : 8 (A : B : C, v/v/v)로 변경되도록 하고, 24분까지 이 비율을 유지하였다.
Results and Discussion
조제분유 7종의 토코페롤 함량
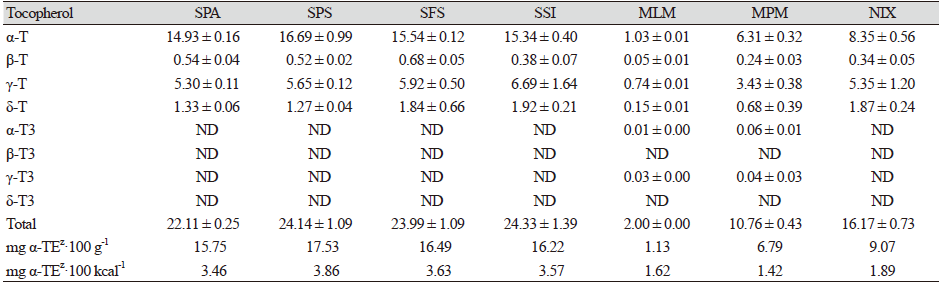
식품의약품안전처의 식품별 기준 및 규격에 따르면, 영유아 조제분유의 비타민 E(토코페롤)함량은 0.5 또는 0.7 mg a-TE·100 kcal-1의 기준규격을 제시하고 있다(MFDS, 2021a). Duan 등(2021a)의 보고에 따르면, 한국인 모유에는 총 토코페롤 함량(α-, β-, γ-, δ-토코페롤)이 0.09 - 0.75 mg·100 g−1의 범위로 검출되었다고 하였다. 이중에서 알파토코페롤이 0.072 - 0.632 mg·100 g−1의 범위를 나타내며 가장 높은 함량을 나타내었다(Duan et al., 2021a). 시중에서 판매되는 영유아 조제분유 7종(SPA, SPS, SFS, SSI, MLM, MPM, NIX)의 토코페롤(α-, β-, γ-, δ-T)과 그들의 이성체인 토코트리에놀(α-, β-, γ-, δ-T3)의 함량을 분석하여 Table 2에 나타내었다. 또한, 분석한 각 토코페롤 함량 수치를 이용하여 체내 비타민 E 활성을 나타내는 α-TE로 환산하였다. 한국인 영양섭취기준(dietary reference intakes, DRIs)은 평균필요량, 권장섭취량, 충분섭취량 및 상한섭취량으로 구분되어 있는데, 영유아의 경우 모유 및 조제분유 등의 식품만을 섭취하기 때문에 영유아의 영양섭취기준은 충분섭취량의 범위에 포함된다(KNS, 2020). 식약처 식품별 기준 및 규격 에서는 최대권장량을 5 또는 7 mg a-TE·100 kcal-1로 제시하고 있다. 조제분유 7종을 분석한 결과, SPA와 SPS, SFS, SSI 시료에서 총 토코페롤 함량이 22.11 - 24.33 mg·100 g−1으로 비교적 높은 함량이 검출되었다. 이것은 mg a-TE·100 g−1으로 환산하였을 때 15.75 - 16.22 mg a-TE·100 g−1에 해당되는 함량이었다. 이들 시료에 함유된 토코페롤은 주로 알파토코페롤(14.93 - 16.69 mg·100 g−1)함량이 높았으며 다음 감마토코페롤(1.27 - 1.92 mg·100 g−1) 순으로 나타났다. 액상조제분유인 MLM의 총 토코페롤 함량은 2.00 mg·100 g−1 (1.13 mg a-TE·100 g−1)이었으며, 분말조제분유 MPM과 NIX는 각각 10.76 mg·100 g−1 (6.79 mg a-TE·100 g−1)와 16.17 mg·100 g−1 (9.07 mg a-TE·100 g−1)의 총 토코페롤 함량을 나타내었다. 이들 조제분유들도 알파토코페롤 함량이 가장 높았고, 다음 감마토코페롤, 델타토코페롤 순으로 검출되었다. 조제분유 MLM과 MPM에서는 토코트리에놀류(α-T3와 γ-T3)들이 0.04 - 0.10 mg·100 g−1 내외로 소량 검출되었다. 수입산 조제분유 SPA와 SPS, SFS, SSI의 100 kcal 당 mg a-TE의 함량은 3.46 - 3.86 mg a-TE·100 kcal-1로 비교적 높은 함량을 보였다. 액상조제분유 MLM과 분말조제분유 MPM, NIX의 100 kcal 당 mg a-TE의 함량은 1.42 - 1.89 mg a-TE·100 kcal-1 수준으로 서로 유사한 함량을 나타내었다. 7종의 조제분유 모두 영유아 조제분유의 식품별 기준 및 규격에서 비타민 E의 기준치인 0.5 또는 0.7 mg a-TE·100 kcal-1보다 높으면서 최대권장량 기준인 7 mg a-TE·100 kcal-1 이하를 나타내어 기준치를 만족한 수준이었다. 수입산 4종(SPA와 SPS, SFS, SSI)의 토코페롤 함량이 높은 것은 이들의 지방산 조성(Table 3 and 4)에서 불포화지방산 함량이 높다는 것과 특히 리놀레산(C18:2, n6)의 함량이 높았기 때문에 항산화제로서 토코페롤 함량을 강화한 것으로 사료된다. 실제로 식약처 식품별 기준 및 규격에서는 조제분유에서 리놀레산함량이 1 g 이상인 경우 최소한 0.5 mg a-TE·100 kcal-1의 비율로 첨가되어야 한다고 명시하고 있다(MFDS, 2021a).
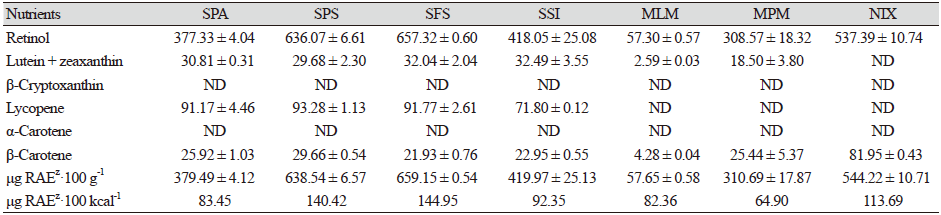
조제분유 7종의 레티놀과 카로티노이드류 함량
조제분유에서 레티놀과 카로티노이드류인 루테인과 지아잔틴, 베타카로틴, 알파카로틴, 베타크립토잔틴, lycopene 함량을 분석하여 Table 5에 제시하였다. 비타민 A는 레티놀과 베타카로틴, 알파카로틴, 베타크립토잔틴이 비타민 A의 활성을 갖는다고 보고되고 있으며, 총 비타민 A는 레티놀, 베타카로틴, 알파카로틴, 베타크립토잔틴 값에 비타민 A 환산계수를 감안하여 레티놀 활성당량(RAE)으로 표기하고 있다(RDA, 2016). 이외에 카로티노이드류 중 루테인과 지아잔틴은 영유아의 시각발달에 중요한 역할을 하기 때문에 중요한 영양인자이다. Duan 등(2019a)에 따르면, 한국인 모유(n = 34, mature milk 42 - 264 days)에서 총 카로티노이드 함량은 2.68 - 24.89 µg·100 g−1으로 검출되었으며, 이중에서 루테인과 지아잔틴의 합이 1.15 - 9.68 µg·100 g−1범위로 검출되어 비교적 높았고, 다음 베타크립토잔틴(0.53 - 10.96 µg·100 g−1), 베타카로틴(0.49 - 9.46 µg·100 g−1), lycopene (0.00 - 1.22 µg·100 g−1), 알파카로틴(0.03 - 1.07 µg·100 g−1) 순으로 검출되었다. 식약처 식품기준 및 규격에 따르면, 비타민 A 함량은 영아용 조제유의 경우 60 - 180 µg·100 kcal-1, 성장기용 조제유의 경우 75 - 225 µg·100 kcal-1함유하도록 하고 있다(MFDS, 2021a). Codex에서 제시하는 비타민 A 또한 60 - 180 µg RE·100 kcal-1가 기준치이다(MacLean et al., 2010). 조제분유 7종에서 레티놀 함량은 SFS와 SPS에서 636.07 - 657.32 µg·100 g−1으로 가장 높은 함량을 보였으며, NIX와 SSI, SPA, MPM 순으로 각각 537.39, 418.05, 377.33, 308.57 µg·100 g−1을 함유하고 있었다. 액상조제유는 57.30 µg·100 g−1의 레티놀을 함유하였다. 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 루테인과 지아잔틴의 합이 29.68 - 32.49 µg·100 g−1으로 비교적 높은 함량을 나타내었고, 국내산 조제분유 MPM에서는 18.50 µg·100 g−1으로 검출되었으며, NIX에서는 루테인과 지아잔틴을 함유하고 있지 않았다(Fig. 1). 액상조제유에는 2.59 µg·100 g−1의 루테인과 지아잔틴을 함유하였다. 베타카로틴 함량은 NIX시료에 81.95 µg·100 g−1으로 가장 높았고, 수입산 조제분유들(SPA, SPS, SFS, SSI)과 MPM 시료에서는 21.93 - 29.66 µg·100 g−1의 범위로 측정되었으며, 액상조제유 MLM에서는 4.28 µg·100 g−1을 함유하고 있었다. 카로티노이드류 중 특이적으로 lycopene이 4종의 수입산 조제분유에서 71.80 - 93.28 µg·100 g−1의 범위로 높은 함량이 검출되었으며, 국내산 조제분유(MLM, MPM, NIX)에서는 검출되지 않았다(Fig. 1). 한국인 모유에서뿐만 아니라 중국인 모유(n = 540, 0 - 240 days)에서도 lycopene이 4.0 - 9.9 µg·100 mL-1내외로 검출되었다(Xue et al., 2017; Duan et al., 2019a). 따라서 영유아조제분유에서 보강된 lycopene 함량은 모유와 유사하도록 제조된 제품으로 사료된다. 시판 조제분유 7종에서는 알파카로틴과 베타크립토잔틴은 검출되지 않았다. 비타민 A 활성을 나타내는 레티놀 활성당량(RAE)은 SFS와 SPS에서 659.15 μg RAE·100 g−1와 638.54 μg RAE·100 g−1으로 가장 높았으며, 이것은 100 kcal 당 144.95 μg RAE·100 kcal-1와 140.42 μg RAE·100 kcal-1에 해당되는 함량이었다. NIX에서는 544.22 μg RAE·100 g−1 (113.69 μg RAE·100 kcal-1)함유되어 있었고, SPA와 MPM에서는 각각 379.46 μg RAE·100 g−1 (83.45 μg RAE·100 kcal-1)와 310.69 μg RAE·100 g−1 (64.90 μg RAE·100 kcal-1)의 비타민 A 활성 당량을 나타내었다. 액상조제유에서는 57.65 μg RAE·100 g−1로 검출되었는데 이것은 100 kcal 당 82.36 μg RAE·100 kcal-1 함량이었다. 분석된 조제분유 7종 모두 비타민 A 활성당량이 식약처 및 Codex 기준치인 60 - 180 µg RE·100 kcal-1의 범주에 속하였다. 수입산 조제분유들에서는 영유아의 건강에 중요한 인자들인 루테인, 지아잔틴, lycopene 등이 강화된 제품들이 시판되고 있는 경향을 보였다.
조제분유 7종의 조지방 및 지방산, 콜레스테롤 함량
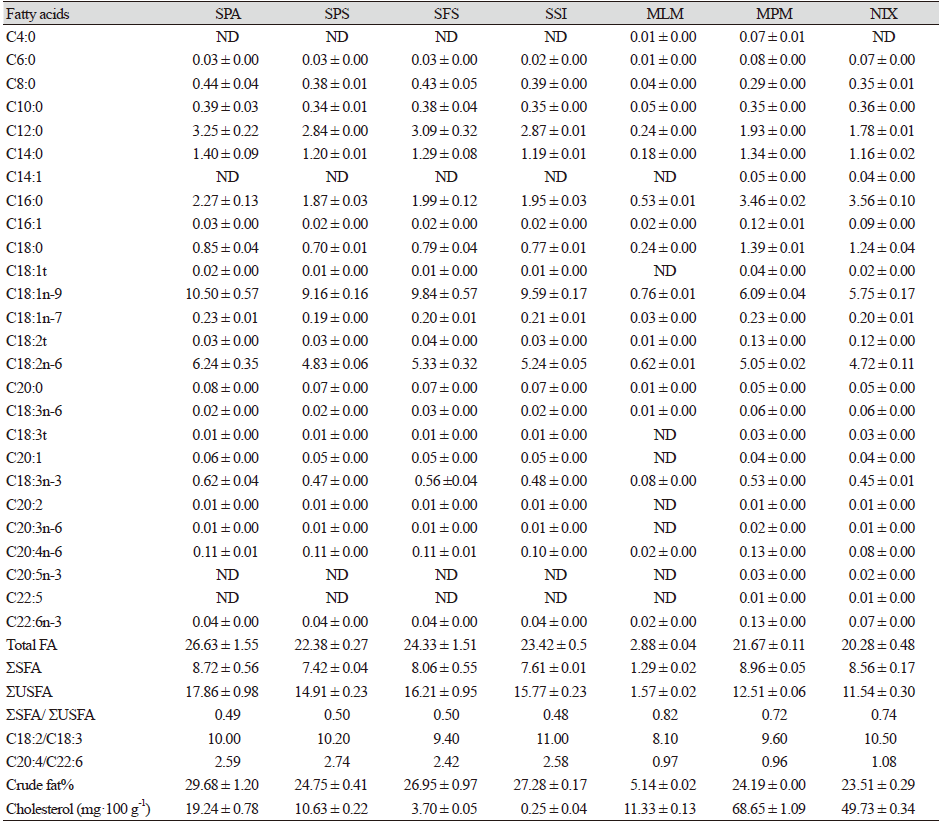
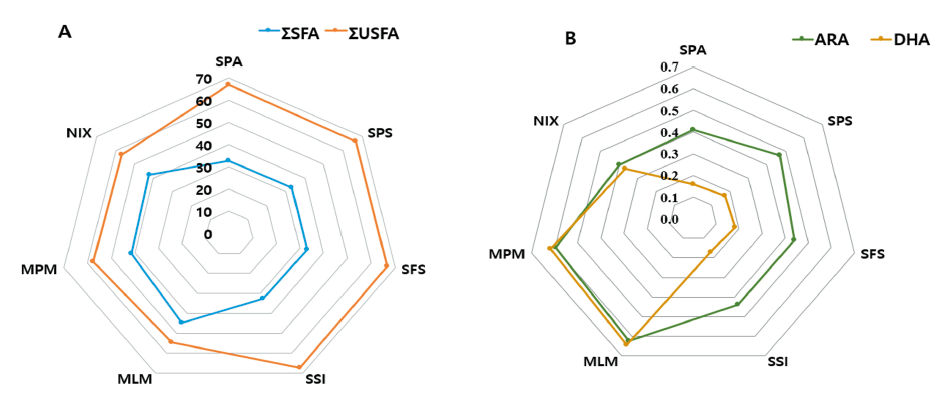
조제분유의 지질 성분에는 중성지방(triacylglycerol)과 이 중성지방의 구성인자인 지방산들, 그리고 콜레스테롤이 포함된다. 지방산은 오메가-3(ω-3) 계열의 α-linolenic acid (C18:3), eicosapentaenoic acid (C20:5, EPA), docosahexaenoic acid (C22:5, DHA)과 오메가-6(ω-6) 계열의 linoleic acid (C18:2), arachidonic acid (C20:4, ARA) 등으로 분류된다. 조제분유 7종의 조지방 함량(wt%)과 각 지방산 조성(g·100 g−1) 및 콜레스테롤 함량(mg·100 g−1)을 Table 3에 나타내었다. 이들 조성들의 100 kcal 당 조지방(g·100 kcal-1) 및 지방산 조성(mg·100 kcal-1), 콜레스테롤 함량(mg·100 kcal-1)으로 정리한 결과들은 Table 4에 제시하였다. 조제분유에 함유된 지방산 조성은 Table 3에 제시된 것과 같이 butyric acid (C4:0)에서부터 DHA까지 다양한 지방산들이 분포하였으며, 총 포화지방산 함량(ΣSFA)은 액상조제유인 MLM을 제외한 6종의 시료에서 7.42 - 8.96 g·100 g−1으로 나타내었고, 총 불포화지방산 함량(ΣUSFA)은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 14.91 - 17.86 g·100 g−1, 국내산 조제분유 MPM과 NIX에서 각각 12.51 g·100 g−1과 11.54 g·100 g−1이 함유되었다. 따라서 총 지방산 함량은 액상조제유인 MLM을 제외한 6종의 시료(SPA, SPS, SFS, SSI, MPM, NIX)에서 20.28 - 26.63 g·100 g−1의 범위를 나타내었다. 액상조제유인 MLM은 총 포화지방산과 총 불포화지방산 함량이 각각 1.29 g·100 g−1와 1.57 g·100 g−1으로 검출되었으며, 따라서 총 지방산 함량은 2.88 g·100 g−1이었다. 총 포화지방산 함량을 총 불포화지방산 함량으로 나눈 값(ΣSFA/ ΣUSFA)은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 0.48 - 0.50을 보였으며, 국내산 조제분유 3종(MLM, MPM, NIX)에서는 0.72 - 0.82를 나타내었다. 따라서 지방산조성에서 수입산 조제분유 4종은 불포화지방산이 포화지방산보다 더 높은 함량 함유하고 있었고 국내산 조제분유 3종은 포화지방산이 불포화지방산보다 더 높은 비율을 차지하고 있었다. Fig. 2에서는 조제분유 7종의 지방 100 g에 대한 포화지방산과 불포화지방산의 비율을 나타내었다. 수입산 조제분유 4종(SPA, SPS, SFS, SSI)들은 총 포화지방산 함량(ΣSFA, g·100 g−1 fat%)과 총 불포화지방산 함량(ΣUSFA, g·100 g−1 fat%)이 각각 32.47 - 33.16%와 66.60 - 67.31%이었으며, 국내산 조제분유 3종(MLM, MPM, NIX)의 총 포화지방산 함량(ΣSFA, g·100 g−1 fat%)과 총 불포화지방산 함량(ΣUSFA, g·100 g−1 fat%)은 각각 41.37 - 44.89%와 54.45 - 57.75%를 나타내었다(Fig. 2).
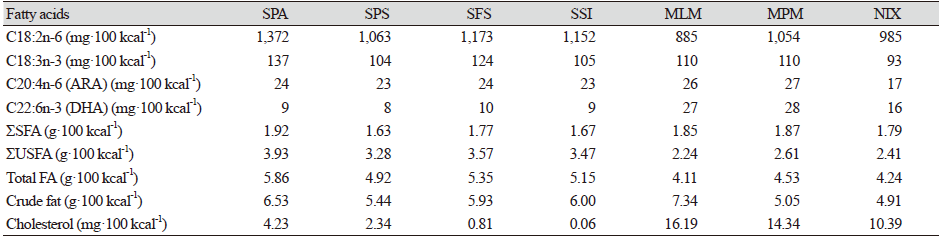
이들 지방산 함량을 100 kcal기준으로 환산하면 Table 4에 제시된 바와 같이, 7종의 조제분유들에서 총 지방산 함량과 총 포화지방산 함량은 각각 4.11 - 5.86 g·100 kcal-1와 1.63 - 1.92 g·100 kcal-1으로 나타내었고, 총 불포화지방산 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 3.28 - 3.93 g·100 kcal-1, 국내산 조제분유 3종(MLM, MPM, NIX)에서 2.24 - 2.61 g·100 kcal-1으로 검출되었다. 전반적으로 수입산 조제분유들은 국내산 조제분유보다 총 불포화지방산 함량과 총 지방산 함량이 높은 경향을 보였다. 식약처 식품별 기준 및 규격에 따르면, 조지방 함량은 영아용 조제유의 경우 4.4 - 6.0 g·100 kcal-1, 성장기용 조제유의 경우 3.0 - 6.0 g·100 kcal-1으로 제시하고 있다(MFDS, 2021a). Codex의 경우 지방함량이 4.4 - 6.0 g·100 kcal-1가 되도록 기준을 설정해놓고 있다(MacLean et al., 2010). 산가수분해법에 의해 추출한 조제분유 7종의 조지방 함량은 4.91 - 7.34 g·100 kcal-1의 범위로 나타내었다(Table 4). 식약처 식품별 기준 및 규격에 따르면, 영유아용 조제분유의 리놀레산(C18:2, ω-6) 함량은 300 mg·100 kcal-1 이상이며, 최대권장기준은 1,400 mg·100 kcal-1으로 제시하고 있고, α-리놀렌산(C18:3, ω-3)함량은 영아용 조제유에서 50 mg·100 kcal-1 이상으로 권장하고 있다(MFDS, 2021a). 이때 리놀레산(C18:2)과 α-리놀렌산(C18:3)의 비율이 5 : 1 - 15 : 1이 되도록 권장하고 있다(MFDS, 2021a). 조제분유 7종의 리놀레산(C18:2)과 α-리놀렌산(C18:3) 함량은 각각 885 - 1,372 mg·100 kcal-1과 93 -137 mg·100 kcal-1의 범위를 나타내며 식약처 권장량 기준을 만족하고 있었다(Table 4). 조제분유 7종에서 C18:2/C18:3 비율은 8.1 - 11.0을 나타내며 식약처 권장 비율을 만족하였다(Table 3). 식약처 조제분유의 식품별 기준 및 규격에서 리놀레산 함량이 1 g 이상인 경우 최소한 0.5 mg a-TE·100 kcal-1의 비율로 비타민 E가 첨가되도록 하고 있는데, 수입산 조제분유들의 리놀레산 함량이 4.83 - 6.24 g·100 g−1을 나타내어 mg a-TE 함량이 3.46 - 3.86 mg a-TE·100 kcal-1을 보이며 비타민 E의 함량이 적절히 첨가된 것으로 사료된다(MFDS, 2021a).
조제분유 7종에 함유된 ARA (C20:4, ω-6)와 DHA (C22:5, ω-3)의 함량을 비교해 보면, ARA 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)과 국내조제분유 2종(MLM, MPM)에서 23 - 27 mg·100 kcal-1 내외의 함량을 보였고, NIX에서는 17 mg·100 kcal-1를 함유하였다(Table 4). DHA 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 8 - 10 mg·100 kcal-1, 국내산 조제분유 2종(MLM, MPM)에서 27 - 28 mg·100 kcal-1, NIX에서는 16 mg·100 kcal-1를 함유하였다. ARA/DHA 비율은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 2.42 - 2.74의 비율을 보였고, 국내산 조제분유 3종(MLM, MPM, NIX)에서는 0.96 - 1.08의 비율을 나타내었다. ARA와 DHA함량을 지방 100 g에 대한 g (g·100 g−1 fat%)로 환산한 결과를 Fig. 2에 나타내었다. 지방함량을 100 g으로 하였을 때, ARA 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)과 NIX시료에서 0.40 - 0.47% (g·100 g−1 fat%) 이였으며, MLM과 MPM에서 0.60 - 0.63%이었다. DHA 함량은 MLM과 MPM에서 0.62 - 0.65% 함유하였고, NIX에서 0.37% 그리고 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 0.16 - 0.18% 함유하였다. 수입산 조제분유들은 ARA 함량이 DHA 함량보다 2 - 3배 정도 높게 제공되고 있었으며, 국내산 조제분유들은 ARA와 DHA의 비율이 1에 가깝기 때문에 ARA 함량이 DHA 함량과 비슷한 함량으로 제공되고 있었다. 또한, 국내산 조제분유들은 DHA의 제공량이 수입산 조제분유들보다 2 - 3배 정도 높았다. 국내산 조제분유의 ARA/DHA의 비율은 Duan 등(2019a)가 보고한 한국인 모유의 지방산조성에서 ARA/DHA의 비율이 평균 0.93 (0.11 - 2.10 범위)으로 보고된 결과와 유사한 비율이었다.
콜레스테롤은 영유아의 성장에서 뇌신경세포 및 수초 형성에 이용이 되는 중요한 영양성분이다. Codex나 식약처 식품 기준 및 규격에서는 조제분유의 콜레스테롤 함량 권장량이 제시되어 있지 않고있다. 조제분유 7종의 콜레스테롤 함량은 mg·100 g−1 sample에 대한 값과 mg·100 kcal-1에 대한 값을 각각 Table 3과 4에 제시하였다. 한국인 모유의 콜레스테롤 함량은 5.17 - 26.71 mg·100 g−1의 범위를 보이며, 평균 13.97 mg·100 g−1을 나타낸다고 한다(Duan et al., 2021a). 국내산 조제분유 MPM과 NIX에서는 68.65 mg·100 g−1과 49.73 mg·100 g−1으로 비교적 높은 함량이었고, SPA와 SPS, MLM은 10.63 - 19.24 mg·100 g−1의 범위로 콜레스테롤이 함유되어 있었고, SFS와 soy-based milk인 SSI에는 0.25 - 3.70 mg·100 g−1 함유되었다. 에너지 100 kcal당 콜레스테롤 함량은 국내조제분유 3종(MLM, MPM, NIX)에서 10.39 - 16.19 mg·100 kcal-1로 비교적 높은 함량을 제공하고 있었으며, 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 0.06 - 4.23 mg·100 kcal-1 수준의 콜레스테롤을 함유하고 있었다.
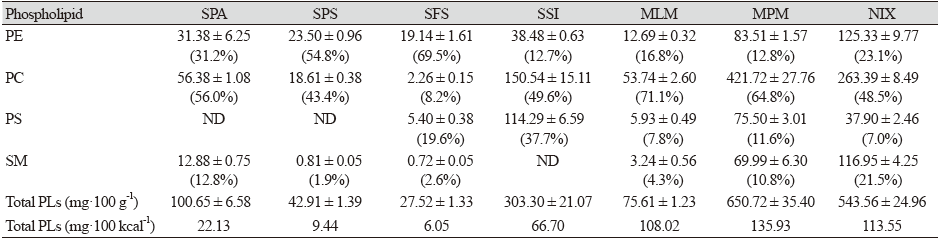
조제분유 7종의 인지질 함량
한국인 모유에 존재하는 대표적인 인지질은 phosphatidylehanolamine (PE), phosphatidylcoline (PC), sphingomyelin (SM), phosphatidylserine (PS) 등이 주로 존재하며, 세포막을 구성하고 뇌 발달 및 충추신경계의 발달에 중요한 역할을 한다(Jiang et al., 2018; Duan et al., 2021b). 조제분유 7종의 인지질 함량을 Table 6에 나타내었다. MPM과 NIX에서 총 인지질 함량이 각각 650.72 mg·100 g−1과 543.56 mg·100 g−1이었으며, MPM 조제분유의 인지질의 구성비(% of total PLs)는 PC (64.8% of total PLs)와 PE (12.8%), PS (11.6%), SM (10.8%)의 순으로 함유하였다. NIX의 인지질 구성비는 PC (48.5%)와 PE (23.1%), PS (7.0%), SM (21.5%)으로 MPM과 마찬가지로 PC의 함량이 가장 높은 비율을 차지하였다. Soy-based milk인 SSI의 총 인지질 함량은 303.30 mg·100 g−1 (PC 49.6%, PS 37.7%, PE 12.7%)이었으며, PC의 함량이 150.54 mg·100 g−1으로 가장 높았고 특이적으로 PS의 함량이 114.29 mg·100 g−1로서 높은 함량을 보였으며, SM은 함유되지 않았다. SPA는 총 인지질 함량은 100.65 mg·100 g−1 (PC 56.0%, PE 31.2%, SM 12.8%)이었으며, 주된 인지질은 PC (56.38 mg·100 g−1)이었고, PS는 검출되지 않았다. 액상조제유인 MLM의 총 인지질 함량은 75.61 mg·100 g−1이었고 인지질 구성비는 PC (71.1%)와 PE (16.8%), PS (7.8%), SM (4.3%)으로 구성되어 있었다. SPS의 총 인지질 함량은 42.91 mg·100 g−1이었으며, 주된 인지질은 PE로서 54.8% (23.50 mg·100 g−1)를 차지하였다. SPS 조제분유는 PS는 함유하지 않았고, PC와 SM은 각각 18.61 mg·100 g−1 (43.4%)과 0.81 mg·100 g−1 (1.9%)를 함유하고 있었다. SFS 조제분유의 총 인지질 함량은 27.52 mg·100 g−1로서 비교적 낮은 함량을 나타내었으며 구성비는 PE (69.5%)와 PS (19.6%), PC (8.2%), SM (2.6%)의 순으로 차지하였다. 에너지 100 kcal당 총 인지질 함량은 국내산 조제분유 3종(MLM, MPM, NIX)에서 108.02 - 135.93 mg·100 kcal-1로 비교적 높은 함량을 보였으며, 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 6.05 - 66.70 mg·100 kcal-1 범위를 나타내었다. 한국인 모유의 총 인지질 함량은 4.89 - 17.85 mg·100 g−1 (평균 10.39 mg·100 g−1)으로서 그 구성비는 SM 49.64%, PC 22.41%, PE 18.89%, PS + LPC 9.06%를 차지한다고 하였다(Duan et al., 2021b). 또한 일본인 모유의 인지질 구성비는 PE 36.1%, SM 30.6%, PC 23.1%, PS 6.7%, PI 3.5% (phosphatidylinositol)으로 보고되었다(Wang et al., 2000). 시중에서 유통되는 조제분유의 인지질 함량 및 그 인지질 구성비도 다양하였다. 본 연구결과는 모유성분에 가까운 조제분유 개발을 위한 기초자료로 이용될 수 있을 것으로 사료된다.
Conclusion
시중에서 유통되고 있는 수입산 조제분유 4종(SPA, SPS, SFS, SSI)과 국내산 조제분유 3종(MLM, MPM, NIX)에 함유된 비타민 E(토코페롤 및 토코트리에놀), 비타민 A (retinol)와 카로티노이드류(루테인, 지아잔틴, 베타크립토잔틴, lycopene, 알파카로틴, 베타카로틴), 지방산 함량 및 콜레스테롤, 인지질조성을 분석하여 비교하였다. 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에는 총 토로페롤 함량이 22.11 - 24.33 mg·100 g−1 (15.75 - 16.22 mg a-TE·100 g−1)이었으며, MPM과 NIX는 각각 10.76 mg·100 g−1 (6.79 mg a-TE·100 g−1)와 16.17 mg·100 g−1 (9.07 mg a-TE·100 g−1)의 총 토코페롤 함량을 나타내었다. 액상조제유 MLM은 총 토코페롤 함량이 2.00 mg·100 g−1 (1.13 mg a-TE·100 g−1)이었다. 100 kcal당 mg a-TE의 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 3.46 - 3.86 mg a-TE·100 kcal-1 함유하였고, 국내산 조제분유 3종(MLM, MPM, NIX)에서는 1.42 - 1.89 mg a-TE·100 kcal-1으로 검출되어 식약처 식품별 기준 및 규격에서 비타민 E의 기준치인 0.5 - 7 mg a-TE·100 kcal-1를 만족하였다. 이들 조제분유에는 알파토코페롤 함량이 가장 높았고, 다음 감마토코페롤 그리고 델타토코페롤 순으로 함유되었다. 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에는 비교적 높은 함량의 루테인과 지아잔틴 함량(29.68 - 32.49 µg·100 g−1)과 lycopene 함량(71.80 - 93.28 µg·100 g−1)을 보였고, 국내산 조제분유 MPM과 MLM에서는 루테인과 지아잔틴 함량(18.50 µg·100 g−1과 2.59 µg·100 g−1)이 소량 검출되었지만, NIX에서는 루테인과 지아잔틴이 검출되지 않았다. 또한, 국내산 조제분유 3종(MLM, MPM, NIX)에서는 lycopene이 함유되어 있지 않았다. 100 kcal당 mg RAE 함량은 SFS와 SPS, NIX에서 113.69 - 144.95 µg RAE·100 kcal-1의 범위로 함유되어 있었고, SSI와 SPA, MLM에서는 82.36 - 92.35 µg RAE·100 kcal-1 정도 함유하였고, MPM에서는 64.90 µg RAE·100 kcal-1 함유하였다. 분석된 조제분유 7종 모두 비타민 A 활성당량이 식약처 및 Codex 기준치인 60 - 180 µg RE·100 kcal-1의 범주에 속하였다. 수입산 조제분유들에서 루테인과 지아잔틴, lycopene이 두드러지게 높은 함량을 보였다. 조제분유 7종의 리놀레산(C18:2)과 α-리놀렌산(C18:3) 함량은 각각 885 - 1,372 mg·100 kcal-1과 93 -137 mg·100 kcal-1의 범위를 나타내며 식약처 권장량 기준(C18:2, 300 - 1,400 mg·100 kcal-1; C18:3, 50 mg·100 kcal-1이상)을 만족하였다. 지방산 조성에서 ARA함량은 수입조제분유 4종(SPA, SPS, SFS, SSI)과 국내조제분유 2종(MLM, MPM)에서 23 - 27 mg·100 kcal-1 (0.41 - 0.44 g·100 g−1 fat%)범위로 함유되어 있었고, NIX에서는 17 mg·100 kcal-1 (0.40 g·100 g−1 fat%)를 함유하였다. DHA 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 8 - 10 mg·100 kcal-1 (0.16 - 0.18 g·100 g−1 fat%), 국내산 조제분유 3종(MLM, MPM, NIX)에서 16 - 28 mg·100 kcal-1 (0.37 - 0.65 g·100 g−1 fat%)를 함유하였다. 따라서 ARA/DHA 비율은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 2.42 - 2.74의 비율을 보였고, 국내산 조제분유 3종(MLM, MPM, NIX)에서는 0.96 - 1.08의 비율을 나타내었다. 수입산 조제분유들은 ARA 함량이 DHA 함량보다 2 - 3배 정도 높게 함유하고 있었으며, 국내산 조제분유들은 ARA 함량이 DHA 함량과 비슷한 함량으로 제공되고 있었다. 전반적으로 국내산 조제분유에서 ARA와 DHA함량이 수입산 조제분유보다 비교적 높았다. 총 포화지방산 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 1.63 - 1.92 g·100 kcal-1 (32.47 - 33.16 g·100 g−1 fat%), 국내산 조제분유 3종(MLM, MPM, NIX)에서 1.79 - 1.87 g·100 kcal-1 (41.37 - 44.89 g·100 g−1 fat%)이었다. 총 불포화지방산 함량은 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서 3.28 - 3.93 g·100 kcal-1 (66.60 - 67.31 g·100 g−1 fat%), 국내산 조제분유 3종(MLM, MPM, NIX)에서 2.24 - 2.61 g·100 kcal-1 (54.45 - 57.75 g·100 g−1 fat%)으로 검출되었다. 전반적으로 수입조제분유들은 국내조제분유보다 총 불포화지방산 함량이 높은 경향을 보였다. 콜레스테롤 함량은 국내산 조제분유 3종(MLM, MPM, NIX)에서 10.39 - 16.19 mg·100 kcal-1로 비교적 높았으며, 수입산 조제분유 4종(SPA, SPS, SFS, SSI)에서는 0.06 - 4.23 mg·100 kcal-1 수준의 콜레스테롤을 함유하고 있었다.
조제분유 7종의 인지질 함량 분석결과, MPM과 NIX시료에서 총 인지질함량이 650.72 mg·100 g−1 (135.93 mg·100 kcal-1)와 543.56 mg·100 g−1 (113.55 mg·100 kcal-1)로 가장 높은 함량을 보였으며, SSI와 SPA시료에서는 303.30 mg·100 g−1 (66.70 mg·100 kcal-1)와 100.65 mg·100 g−1 (22.13 mg·100 kcal-1)의 총 인지질을 함유하고 있었다. 액상조제유인 MLM에서 총 인지질 함량은 75.61 mg·100 g−1 (108.02 mg·100 kcal-1)이었으며, SPS와 SFS에서는 42.91 mg·100 g−1 (9.44 mg·100 kcal-1)와 27.52 mg·100 g−1 (6.05 mg·100 kcal-1)의 총 인지질이 검출되었다. 국내산 조제분유들은 수입산보다 인지질 함량이 비교적 높았으며, 대체로 주된 인지질은 PC (48.5 - 71.1%) 이었고, 이외에 PE (12.8 - 23.1%), PS (7.0 - 11.6%), SM (4.3 - 21.5%)을 모두 함유하고 있었다. NIX 시료의 경우 SM (21.5%)이 특이적으로 많은 함량을 차지하였다. 수입산 조제분유인 SPS와 SFS의 경우, PE (54.8 - 69.5%)가 주된 인지질이었으며, SPA 시료의 경우에는 PC (56.0%)와 PE (31.2%)가 주를 이루었으며 소량의 SM (12.8%)를 함유하였다. SSI시료는 인지질들 중에서 PC (49.6%)와 PS (37.7%), PE (12.7%)가 주로 함유되었고, SM은 검출되지 않았다. SPA와 SPS 조제분유에서는 PS가 검출되지 않았다.