Introduction
국내의 한우 산업은 협소한 우사에서 송아지를 생산하여 출하하기까지 질병 발생 없이 건강하고 우수한 개체로 사육하기 위해 집약적인 관리가 요구된다(Kang et al., 2002). 좁은 공간에서 밀집 사육하는 경우 우사는 다양한 병원체들에 의한 오염이 발생하며 질병 감염에 대한 위험도 높아진다. 가축사육 환경 내 잔존하는 병원체들은 현재 발병하지 않았더라도, 환경 조건이 적합할 때 언제든 발병할 수 있으므로 송아지가 질병에 저항할 수 있도록 다양한 면역 증진 방법을 선택해야 한다(Heinrichs et al., 1995). 송아지는 국내 비육프로그램에 따라 높은 생산성을 위해 고에너지 사료를 급여하며 이에 따라 산독증, 반추위 발달 및 성장 지연 등 다양한 대사성 질병이 나타날 수 있다(Owens et al., 1998; Ahn et al., 2019).
낙산은 발효단계에서 생성되는 단쇄지방산으로 반추위 유두를 자극하여 반추위 발달을 촉진하는 것으로 알려져 있다(Sander et al., 1959). Guilloteau 등(2009)은 생후 1개월부터 3개월령까지 낙산나트륨을 첨가 급여했을 때 성장성적에 긍정적인 효과가 나타났으나, 그 이후는 실험구와 대조구의 성장성적에 차이가 없다고 보고하였다. Cavini 등(2015)에서도 어린양에게 낙산 나트륨을 첨가 급여하였을 때, 반추위 발달 및 성장률에 영향을 미쳤다고 보고하였다. 그러나 국내 한우 송아지에게 낙산나트륨 첨가 급여하여 생산성에 어떠한 영향을 주는지에 대한 연구결과는 매우 부족한 상황이다.
따라서 본 연구에서는 낙산 나트륨 첨가가 반추위 발효를 저해하지 않는 수준을 확인하고 한우 송아지에게 급여 시 성장 성적의 변화를 확인하고자 하였다.
Materials and Methods
실험 재료 및 화학적 성분분석
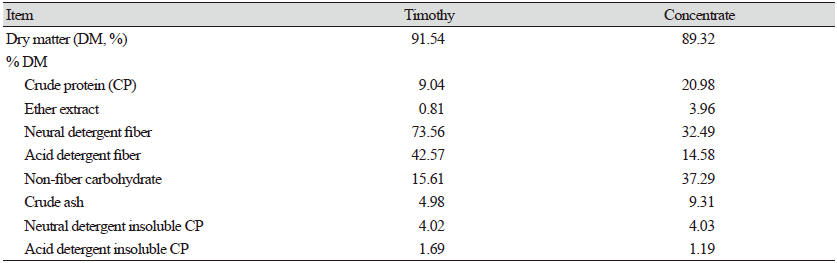
본 연구에서는 한우 송아지 사육에 많이 사용되고 있는 티모시(timothy)와 송아지용 배합사료(Onegiwoo, Woosung feed Co., Ltd., Nonsan, Korea)를 사용하였다. 실험에 사용된 사료의 일반 성분 분석은 60℃ 송풍 건조기에서 48시간 건조한 후 건물 함량을 측정하였다. 건조된 시료는 분쇄기를 이용하여 1 mm 망에 통과 가능한 크기로 분쇄 후 일반성분 분석에 이용하였다. 실험 사료의 조단백질(crude protein, CP), 조지방(ether extract, EE), 및 조회분(crude ash) 함량은 AOAC (2016)에 따라 분석하였으며, 중성세제불용섬유 (neutral detergent fiber, NDF)와 산성세제불용섬유(acid detergent fiber, ADF) 함량은 Van Soest 등(1991)의 방법을 이용하여 분석하였다. 중성 세제 불용 조단백질(neutral detergent insoluble crude protein, NDICP)과 산성 세제 불용 조단백질(acid detergent insoluble crude protein, ADICP)은 Licitra 등(1996)의 방법으로 측정하였다. 비섬유소 탄수화물(nonfiber carbohydrate, NFC)은 100 - {CP% + EE% - Ash% - (NDF%-NDICP%)}의 수식으로 산출하였으며(NRC, 2001), 실험에 사용된 사료의 화학적 성분은 Table 1과 같다.
반추위 발효 특성
실험 설계
본 연구는 낙산 나트륨을 급여 시 첨가 수준을 설정하기 위해 수행되었다. 실험 기질은 조사료와 배합사료(Onegiwoo, Woosung feed Co., Ltd., Nonsan, Korea)를 각각 4:6 비율로 배양병에 1 g씩 분주하였으며, 실험구는 낙산 나트륨 첨가량에 따라 0, 0.1, 0.3 및 0.5% 첨가로 구성하였다.
공시 동물은 농촌진흥청 국립축산과학원에서 반추위 누관이 장착된 한우 거세우(체중 655 ± 70.7 kg) 2 두를 이용하여 오전 사료 급여전 반추위액을 채취하였다. 볏짚 2 kg과 비육전기 배합사료 5 kg을 하루에 2 회(07:00 및 16:00)에 나누어 급여하였고, 물과 미네랄 블록은 무제한 급여하였다. 채취된 위액은 4 겹의 cheese cloth로 여과 후 O2-free CO2가 충진 된 2 L, flask (39℃)에 head space가 없도록 채워졌으며, 산소의 침입을 차단하여 혐기 조건을 유지하였다.
반추위 in vitro 발효 및 분석방법
실험 배양 개시 30분 전 반추위액을 O2-free CO2로 bubbling 하여 pH를 6.5로 보정하고 NaHCO3 9.8 g, Na2HPO4H2 4.62 g, KCL 0.57 g, NaCl 0.47 g, MgSO47H2O 0.12 g, CaCl2/100 mL 4 g로 구성된 McDougall’s buffer solution (Troelsen and Hanel, 1966)과 반추위액을 4 : 1로 혼합하여 rumen inoculum으로 사용하였다. 또한 위액의 희석 및 여과 과정 동안 O2-free CO2를 분사하여 위액이 산소에 노출되지 않도록 혐기 상태를 유지하였으며 Tilley와 Terry (1963)의 방법에 따라 배양병을 3 반복하여 실험을 실시하였다. 총 가스 생성량은 실험용 유리 주사기를 이용하여 배양병에 있는 총 가스를 측정하였다. pH는 발효가 종료된 배양병을 개봉한 후 pH meter (S20 Seven Easy™, Mettler-Toledo, Columbus, OH, USA)를 이용하여 반추위액의 pH를 측정하였다. 반추위 암모니아태 질소의 함량은 Chaney와 Marbach (1962)의 방법에 따라 진행되었으며, 4,000 rpm으로 15 분간 원심 분리하여 사료 입자가 제거된 반추위액의 상등액 20 L에 phenol color reagent 1 mL 및 alkali hypochlorite reagent 1 mL를 완전히 혼합하여 37℃에서 15 분간 반응 후 분광 광도계(Optizen UV2120, Mecasis, Daejeon, Korea)를 이용하여 630 nm 흡광도에서 측정하였다. 휘발성 지방산은 Erwin 등(1961)의 방법에 따라 실시되었다. 사료 입자가 제거된 반추위액의 상등액에 1 mL에 metaphosphoric acid 200 μL를 첨가하여 30 분 동안 정치 후, 13,000 rpm에서 원심분리 하는 전처리 과정을 거친 시료를 Nukol™, fused silica capillary column (0.25 mm I.d. × 30 m length, SUPELCO, Bellefonte, PA, USA)이 장착된 gas chromatography (HP4890, Agilant, CA, USA)로 분석하였다(oven = 180℃, injector = 220℃ 및 detector = 200℃).
한우 송아지의 성장 성적 평가
본 연구에서는 2 개월령 한우 송아지 14두(74.3 ± 4.62 kg)를 실험동물로 사용하였고, 전라북도 남원 소재의 한우 농가에서 사양 실험을 진행하였다. 실험동물들은 체중과 체적을 고려하여 총 2개의 우방에 나누어 배치하였고, 실험동물의 우방 배치와 각 우방에 대한 실험구 설정은 완전 임의 배치법에 따라 진행하였다. 실험 사료는 티모시와 시판 송아지 배합사료를 무제한으로 급여하였으며, 낙산 나트륨은 시판 배합사료에 0.3%를 혼합하여 급여하였다(Table 1). 물과 미네랄 블록은 실험 동물이 자유롭게 접근하여 섭취할 수 있도록 하였다. 실험동물의 성장은 사양 실험 개시일을 기준으로 실험개시일과 120일에 체중 및 체적을 측정하여 비교하였다. 사료 섭취량은 일주일 동안 섭취하고 남은 사료량을 우방별로 측정하여 계산하였다. 얻어진 체중과 사료 섭취량 결과를 바탕으로 일당 증체량 및 사료 요구율을 평가하였다. 체적은 체장, 체고 및 십자부고를 측정하여 실험동물의 성장을 확인하였다. 본 연구는 국립축산과학원 동물실험윤리위원회의 승인 하에 수행되었다(승인번호 NIAS 2019-346).
통계 분석
연구의 통계 분석은 SPSS 프로그램(Version 18, IBM, NewYork, USA)을 사용하였다. 반추위 발효 실험에서는 일반선형모형(general linear model)의 분산분석(analysis of variance)을 사용하였고, 각 평균간 유의성 검정은 Duncan의 다중검정법(multiple range test)을 이용하여 분석하였다. 한우 송아지 성장성적은 T-검정(T-test)을 이용하여 95% 수준에서 유의성을 검정하였다.
Results and Discussions
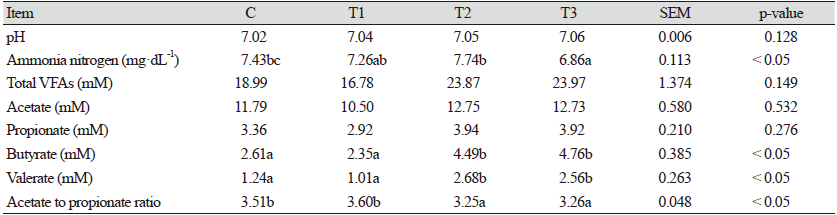
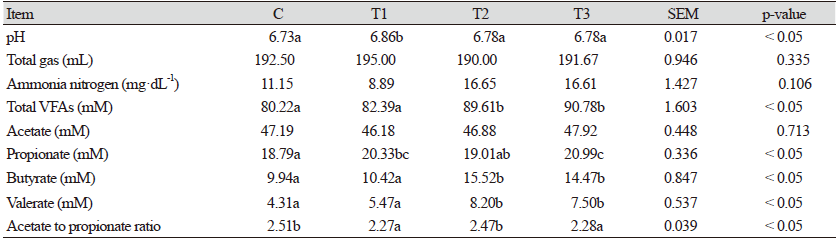
본 연구에서 수행된 반추위 발효 특성은 Table 2 및 3에서 볼 수 있다. 반추위 발효 개시 전 pH는 실험구 간의 유의적 차이가 나타나지 않았다. 암모니아태 질소생성량에서는 T3에서 C보다 유의적으로 낮은 결과를 보였다(p < 0.05). 총 휘발성지방산, 초산 및 프로피온산에서는 실험구 간의 차이가 없었으나, 낙산과 발러릭산에서는 T2 및 T3에서 C보다 유의적으로 높게 나타났다(p < 0.05). 초산과 프로피온산의 비율에서는 T2 및 T3에서 C보다 유의적으로 낮았다(p < 0.05). 48시간동안 반추위 in vitro 발효가 진행된 후, 반추위 pH는 C보다 T1에서 높은 결과를 나타냈다. 반추위 pH는 사료의 성분에 의해 영향을 받으며, 소화 속도에 따라 변화의 폭이 크다. 본 연구에서는 소량의 첨가제를 사용하여 유의적 차이가 나타났지만, 전실험구에서 반추위 발효 적정수준인 5.8 - 7.2 범위에 속해 반추위 발효에 부(-)의 영향이 없을 것으로 생각된다(Hiltner and Dehority, 1983). 총 가스 생성량 및 암모니아태 질소생성량에서는 실험구 간의 차이가 없었다. 총휘발성지방산은 T2와 T3에서 C보다 유의적으로 높았으며(p < 0.05), 초산은 실험구 간 유의적 차이가 없었다. 프로피온산은 전 실험구 중 T1과 T3에서 가장 높았고(p < 0.05), 낙산 및 발러릭산에는 T2와 T3에서 유의적으로 높은 결과를 보였다(p <0.05). 초산과 프로피온산의 비율에서는 T1과 T3에서 C보다 유의적으로 낮았으나(p< 0.05), 2.27 - 2.51 수준으로 나타났다. 반추위 휘발성지방산은 탄수화물 유래 분해 산물이며, 반추동물의 주요 에너지원이다(Casper et al., 1990). 또한, 반추위 발효를 가장 쉽게 볼 수 있는 지표이며, 휘발성지방산이 높았던 T2 및 T3에서 C보다 높은 반추위 발효가 나타났다고 생각된다. 본 연구는 첨가제가 낙산 나트륨이므로 반추위내 낙산이 증가할 것으로 예상되었고 연구결과에서도 낙산 및 발러릭산이 증가하였다. 따라서 본 연구에서는 반추위 발효를 증진시키는 최적의 농도를 T2의 0.3%로 선정하여 사양 실험을 수행하였다.
한우 송아지를 이용한 성장 성적을 비교한 사양실험에서는 개시체중에서 대조구와 실험구 간의 유의적 차이가 없었다(Table 4). 일당증체량에서는 대조구가 실험구보다 높은 수치를 보였고, 사료 섭취량에서는 대조구보다 실험구에서 수치적으로 높았으나 모두 통계적 유의성이 없었다. 사료 요구율 및 종료 체중은 대조구보다 실험구에서 낮게 나타났으나 이 또한 유의적 차이가 없었다. 송아지의 체적에서는 실험 시작 시 체장, 체고 및 십자부고에서 유의적 차이가 나타나지 않았으며, 실험 종료 시에도 체장, 체고 및 십자부고에서 모두 유의적 차이가 없었다(Table 5).
낙산은 반추위 유두 발달을 촉진하는 것으로 알려져 있어(Kim et al., 2012), 본 연구에서는 낙산 나트륨의 첨가 급여가 반추위 발효에 도움을 줄 것으로 예상하였다. In vitro 반추위 발효에서 0.3%이상의 낙산 첨가가 반추위 발효 증진에 영향을 주었다고 판단하였으나, 한우 송아지에게 직접 급여하였을 때는 성장 성적에 큰 영향을 미치지 못했다. Górka 등(2011)의 연구에서는 농후사료를 급여하는 송아지에게 낙산나트륨을 첨가 급여하였을 경우 성장성적은 긍정적이나 유의성이 없었다고 보고하였다. 본 연구 또한 개월령이 낮은 송아지를 이용했으나 이미 농후사료를 급여하고 있어 성장성적에 직접적 영향이 없었다. 별도의 처리 및 가공이 없는 낙산 나트륨 급여시 반추위 내 위장관 벽에 흡수 및 이용 될 수 있으며, Ma 등(2018)의 낙산 나트륨 급여시 반추위 과산증을 개선하는 효과가 있다고 보고하였다. 일련의 연구결과, 낙산 나트륨이 반추위 발효를 증진시키고 반추위 안정화에 도움을 줄 수 있으나, 첨가제 급여 시기에 따라 성장이 촉진되는 효과가 나타나지 않을 수 있다. 추후 연구에서는 첨가제 급여 시기를 보완할 필요가 있다고 생각되며, 성장 성적 및 도체 성적을 비교해 장기적 효과를 확인할 필요가 있다고 생각된다.