Introduction
Thioredoxin (TRX)은 박테리아, 식물 및 동물을 포함하여 지구상에 존재하는 다양한 생물에 존재하는 12 kDa의 작은 단백질이다(Yodoi et al., 2017). TRX는 cysteine thiol-disulfide 교환에 의해 다른 단백질들의 환원작용을 촉진하는 항산화물질(antioxidant)로 알려져 있으며, 최근에는 세포간의 결합에도 관여한다고 보고되었다(Nordberg and Arnér 2001; Meng et al., 2010). 인간에서는 TXN과 TXN2가 TRX를 만드는 유전자로 알려져 있고, 이들 유전자를 함께 제거할 경우 발생초기단계인 창자배형성(gastrulation) 전에 수정란에서 배아로의 발생을 막아 유산시키기 때문에 필수 유전자로 알려져 있다(Matsui et al., 1996). 또한 피부질환 관련한 TRX의 기능 연구에서는 TRX의 마우스내 과발현 유도가 알레르기 접촉 피부염, 자극성 접촉 피부염, 자외선 유도 피부염을 억제한다고 보고되었다(Fukunaga et al., 2009; Ono et al., 2012). 이와 관련하여 알레르기 접촉 피부염 모델에서는 TRX가 알레르기 반응과 염증도 억제하고, 자극성 접촉피부염 마우스 모델에서는 국소적으로 도포된 TRX가 염증과 관련된 물질의 생산을 억제하는 것으로 나타나(Tian et al., 2013), 항알레르기 및 항노화 작용이 있는 화장품소재로 TRX의 기능이 최근까지 보고되고 있다.
Epidermal growth factor (EGF)는 epidermal growth factor receptor (EGFR)에 결합하여 세포의 성장과 분화를 촉진하는 약 6 kDa의 단백질이다(Carpenter and Cohen, 1990). EGF 단백질은 keratinocyte migration, fibroblast 기능과 granulation tissue의 형성에 관혀하는 것으로 알려져 있다. 화장품소재로써의 EGF는 epidermal cell의 증식을 촉진하고 keratinocyte의 이동과 증식을 촉진함으로써 피부상처 치유 과정에서 중요한 역할을 한다. 하지만 만성 상처 환경에서는 EGF 단백질이 쉽게 분해되는 단점을 가지고 있어 현재에는 EGF의 전달 시스템 개발을 통하여 단백질을 안정화하기 위한 연구가 진행중이다(Hardwicke et al., 2008).
콩의 종자 내 단백질 함량은 39.3%로 육류에 비해서도 높은 단백질 함량을 가지고 있다. 이를 이용하여 TRX와 EGF를 종자특이적으로 발현시키는 유전자변형콩이 개발되었다. 이렇게 개발된 유전자변형작물의 경우 1993년 발표된 OECD (Organization for Economic Cooperation and Development) 합의보고서(Consensus documents)를 기초로 만들어진 실질적 동등성 개념에 따라 상업화를 위한 위해성 평가를 수행하여야 한다(Oh et al., 2020). 국내의 경우 2008년 1월 1일부터「LMO 법률」과 유전자재조합 농산물·축산물·수산물 및 미생물은 「식품위생법」제 18조에 따라 “유전자재조합 농산물·미생물 안전성평가 심사”를 거쳐야 하며 세부항목으로 유전자변형작물의 알레르기 및 독소 유발 가능성을 확인하기 위하여 단회경구투여독성 분석 자료를 제출하도록 하고 있다.
본 연구에서는 종자특이적 TRX 및 EGF 발현 유전자변형콩에 도입된 TRX와 EGF 단백질에 대한 단회경구투여 독성시험 실시하였다. 이를 위하여 OECD 테스트 가이드라인(OECD, 2002a, 2002b)과 식품의약품안전처 고시 제2015-82호(KFDA, 2015)에 따라서 TRX와 EGF 단백질을 단회 경구 투여하여, TRX 및 EGF 단백질이 알레르기와 독성을 유발할 가능성이 있는지 평가하였다.
Materials and Methods
TRX와 EGF 단백질의 과발현과 대량정제
유전자변형콩에 각각 도입된 TRX (NP_003320)와 EGF (AAS833951) 단백질을 대량 정제하기 위하여 해당 유전자에 특이적인 프라이머 조합(Table 1)과 유전자변형콩으로부터 추출한 total genomic DNA를 주형으로 PCR (polymerase chain reaction) 방법으로 증폭하였다. 이렇게 증폭된 TRX와 EGF 번역 유전자는 pET-26b (+) 벡터(Merch, St. Louis, MO, USA)에 NdeI과 XhoI DNA 제한효소를 이용하여, C-말단에 6개의 hitidine들을 융합한 TRX와 EGF 단백질을 발현시스템(pET26-TRX_H6, pET26-EGF_H6)을 제작하였다. TRX와 EGF 단백질 발현을 위하여 만들어진 pET26-TRX_H6과 pET26-EGF_H6는 각각 E. coli BL21 (DE3)에 도입하였다. 각각의 발현시스템이 도입된 개별 콜로니를 최종 50 μL·mL-1 kanamycin이 포함된 0.8 L LB broth에 배양하였다. OD600 값이 0.6에 근접할 때 IPTG (isopropyl β- d-1-thiogalactopyranoside)를 배양액 최종 농도가 1 mM이 되도록 처리한 후 4시간동안 37℃에서 200 rpm으로 배양하였다. 그 후 배양액은 4,000 rpm으로 원심분리하여 침전된 세포를 회수하였다. 이렇게 얻어진 세포는 French press를 이용하여 파쇄한 후 15,000 rpm으로 원심분리하여 상등액을 Ni-NTA-agarose (Cat# 30210, Qiagen, Hilden, Germany)을 이용하여 단백질 정제를 수행하였다. TRX 단백질의 경우 수용성 단백질에 사용되는 방법을 수행하였으며 EGF의 경우 urea를 이용하여 불용성 단백질 정제방법을 따라 단백질을 정제하였다. 이렇게 얻어진 단백질은 SDS-PAGE (sodium dodecyl sulphate–polyacrylamide gel electrophoresis)와 anti-His tag antibody를 이용한 Western blot 분석들을 통해 확인하였다.
단회투여독성에 필요한 2 g 이상의 TRX와 EGF 단백질을 얻기위해 유가식배양(fed-batch culture)을 수행하였다. TRX 발현시스템의 배양을 위해서는 5 L 배양조에 2 L 배양을 수행하였고 EGF 발현시스템의 배양을 위해서는 500 L 배양조에 300 L 대량 정제를 진행하였다. 이렇게 배양된 세포는 4,000 rpm 원심분리를 통하여 회수하였고 lysis buffer (50 mM Tris HCl [pH 8.0], 5 mM EDTA, 0.5% Triton X-100)에 의해 희석한 후 microfluidizer를 이용하여 파쇄한 후 원심분리를 통하여 inclusion body를 회수하였다. 이렇게 얻어진 inclusion body는 EBA (expanded bed adsorption) 방법을 FPLC (fast protein liquid chromatography)에 His-tag 결합 컬럼(HisTrap FF 5 mL, GE Healthcare)을 통해 수행하였다. 단백질 정제 동안 binding buffer (20 mM sodium phosphate, 500 mM NaCl, 20 mM imidazole, 8 M Urea)와 elution buffer (20 mM sodium phosphate, 500 mM NaCl, 500 mM imidazole, 8 M Urea)가 이용되었으며 최종적으로 5 mL씩 분리된 분획을 회수하였다. 이렇게 얻어진 단백질은 SDS-PAGE 분석을 통해 단백질의 분자량을 확인하였고 마지막 과정으로 단회투여독성을 위하여 D.W. (deionized sterile water)로 dialysis를 수행하고 동결건조하여 TRX와 EGF 최종단백질을 준비하였다.
시험물질의 제조
실험동물에 투여하는 TRX과 EGF단백질은 실험시작일에 전자저울(CP323S, Sartorius, Göttingen, Germany)로 측량 한 부형제를 이용하여 규정농도(200 mg·mL-1)로 제조하였다.
실험동물
본 시험은 동물보호법(제정 1991년5월31일 법률 제4379호, 일부개정 2015년 1월20일 법률 제13023호)에 근거하여 ㈜바이오톡스텍의 동물실험윤리위원회에 의해 승인되었다(TRX 승인번호: 160726; EGF 승인번호: 180618). EGF와 TRX 단회투여독성 분석에 각각 사용된 마우스의 종과 계통은 CrljOri:CD1 (ICR)과 SPF이며 5주령을 수컷 12마리와 암컷 12마리를 (주)오리엔트바이오(Seongnam, Korea)부터 수령하여 외관 검사 및 체중 측정을 실시하였다. 그 후, 3일간 일반증상을 관찰한 후 3일간 순화하였다. 순화기간 중에 매일 일반증상을 관찰하고 마지막날에 평균체중에 가까운 암·수 각 10마리를 선별하고 선발한 동물을 각 군 평균체중이 균등하도록 무작위로 암수 각 2군, 군당 5마리로 군분리하였다. 실험기간 동안 사육환경으로 스테인레스 철망사육장(100 cm [W] × 200 cm [D] × 130 cm [H])에 사육상자 당 수용동물은 순화기간 중에는 3마리가 사육되었고 관찰기간 동안은 1마리가 사육되었다. 사육온도와 습도는 20.7 - 23.7℃, 48.1 - 59.4%, 그리고 환기횟수는 시간 당 10 - 15회였다. 명암주기는 12시간씩 오전 7시부터 오후 7시 조명을 조도 150 - 300 Lux로 하였으며, 사육상자 및 급이기는 2주당 1회, 급수병은 주당 1회 교환하였다. 그리고 사료로는 고형사료(Teklad Certified Irradiated Global 18% Protein Rodent Diet 2918C, Envigo RMS Inc., Indianapolis, USA)를 음수와 함께 자유 섭취시켰다.
실험 군 구성 및 투여
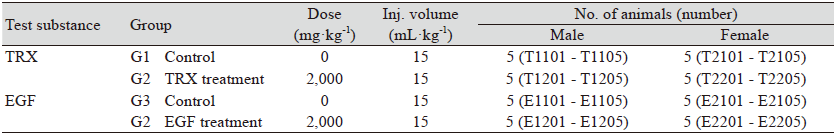
TRX와 EGF 단백질의 단회 경구투여독성 평가를 위하여 4개의 군으로 나누어 진행하였다. TRX와 EGF 처리군은 각각 G2군과 G4군으로 나누었으며 부형제만 처리한 TRX와 EGF의 대조군은 G2군과 G3군으로 분류하였다. 각 군은 군 분리일 기준으로 6주령 암컷 5마리와 수컷 5마리 총 10마리로 구성되었으며 G1군부터 G4군까지 총 40마리 모두에 고유 식별번호를 부여하였다(Table 2). 시료의 투여액량은 투여당일 절식 후 마우스 체중 1 kg 당 10 mL로 하였고 존데에 부착된 1 mL 주사기를 이용하여 위내에 직접 단회 강제 투여하였다. 모든 동물은 투여 전 4시간부터투여 후 2시간까지 절식시키고 음수는 자유 섭취시켰다. 투여용량은 OECD의 단회투여독성시험의 허용 한계용량인 2,000 mg·(10 mL·kg-1)-1으로 암컷과 수컷 1마리씩에 투여하는 예비실험을 시행하였으면 실험동물의 사망례가 보이지않아 본 시험에서도 투여용량을 동일하게 설정하였다(OECD, 2002). 대조군의 부형제 처리는 시험물질 처리 외에는 모두 동일하게 진행하였다.
임상 관찰 및 검사
시험물질 처리 후 임상관찰과 검사를 위하여 투여당일에는 투여 후 0.5, 1, 2, 4과 6시간, 그리고 투여 후 14일동안 매일 1회씩 독성징후의 종류, 발현시기 및 회복시기, 사망유무 등 임상증상 관찰을 수행하였다. 또한 모든 실험에 참여한 동물들의 체중 측정은 투여직전과 투여 후 1, 3, 7 및 14일에 측정되었으며 투여 후 14일째인 부검일에 모든 동물에 CO2 가스를 흡입시키고 배대동맥에서 방혈시켜 안락사 하고 장기에 대한 육안검사를 통해 병변 유무를 검사하는 부검을 수행하였다.
자료의 통계처리
이번 검정동안 측정된 대조군과 투여군의 체중 변화는 SAS (version 9.3, SAS Institute Inc., Cary, NC, USA)를 이용하여 분석되었으며, Folded-F 검정법을 이용하여 등분산성을 유의수준 0.05로 분석하고 등분산인 경우 Student t-test를 수행하였으며 등분상이 기각되면 Aspin-Welch t-test를 실시하여 최종 통계적 유의성을 확인하였다(유의수준: 양측 0.05 및 0.01).
Results and Discussion
TRX와 EGF 단백질의 정제 및 대량생산
TRX와 EGF 형질전환콩에 사용된 동일한 단백질을 대장균으로부터 생산하기 위하여 동일한 유전자서열에 추가적으로 (His)6-tag을 C-말단에 도입한 단백질이 생산되는 발현시스템을 이용하였다. TRX 단백질의 경우 총 111개의 아미노산으로 구성되어있다. ProtParam으로 예측된 TRX의 분자량은 12.56 kDa이며 pI값은 5.74로 분석되었다(Wilkins et al., 1999). EGF 단백질은 총 60개의 아미노산으로 구성되어 있으며 분자량과 pI값은 7.2 kDa과 6.0으로 확인되었다. 각각의 TRX와 EGF 단백질 발현 시스템(pET26-TRX_H6, pET26-EGF_H6)을 각각 E. coli BL21 (DE3)에 도입하여 IPTG를 inducer로 하여 과발현 시켰다. 이렇게 과발현된 세포를 파쇄한 후 TRX와 EGF의 C-말단에 위치한 (His)6-tag과 결합력을 가지는 Ni-NTA-agarose resin을 이용하여 각각의 단백질을 정제하였다. 이렇게 만들어진 단백질이 TRX와 EGF인지 확인하기위하여 SDS-PAGE 분석을 통하여 분자량을 확인하고 anti-(His)6-tag antibody를 이용하여 Westorn blotting 분석을 실시하여 TRX와 EGF 단백질이 정제되었다는 것을 확인하였다(Fig. 1A and 1B).
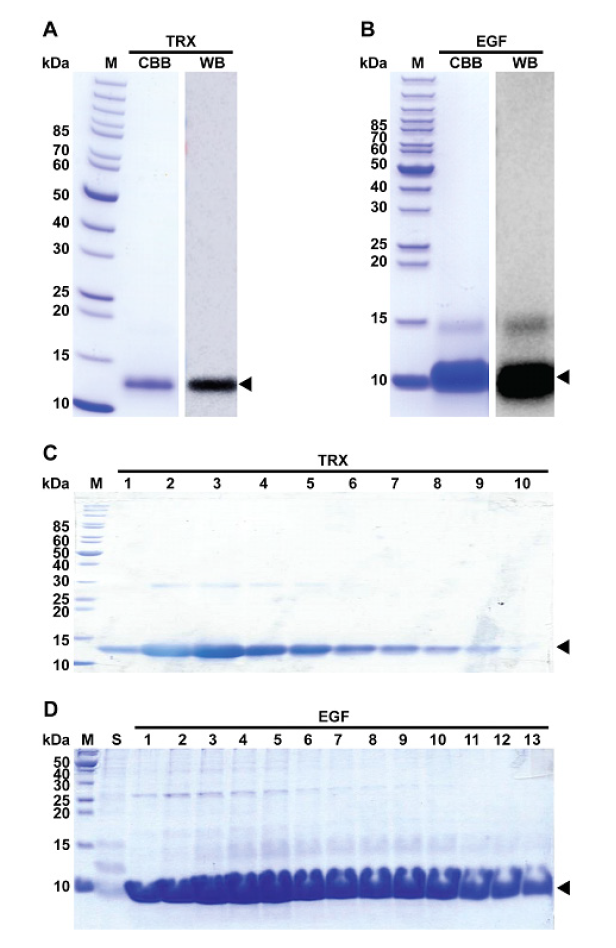
Fig. 1. Purification of thioredoxin (TRX) (A) and epidermal growth factor (EGF) (B) proteins from flask cultures, and fractions of TRX (C) and EGF (D) proteins purified by expanded bed adsorption from fed-batch culture. M, CBB, WB and S indicate protein molecular weight marker, Coomassie brilliant blue stain, western blot, and loaded sample, respectively. Arrow head indicates TRX (C) and EGF (D) bands in the gel.
단회투여독성 분석의 허용 한계용량인 2,000 mg·(10 mL·kg-1)-1의 시료 확보를 위하여 TRX와 EGF 단백질이 각각 약 2 g 정도가 필요할 것으로 예측되어 이를 위한 대량생산 방법을 개발하였다. TRX와 EGF를 과발현하는 세포를 대량으로 얻기위해 2 L (TRX)와 300 L (EGF) 배양액을 이용하여 유가식 배양을 수행하였다. 이렇게 얻어진 세포를 파쇄한 후 EBA (Kennedy, 2005) 방법과 Ni-NTA-agarose resin을 이용하여 각각의 단백질을 정제하였다(Fig 1C and 1D). 이렇게 정제된 단백질은 Ni-NTA-agarose resin을 이용하여 정제된 분획들 중 TRX는 1번부터 10번 분획을 그리고 EGF는 1번부터 13번 분획까지 모아 D.W.로 투석(dialysis) 한 후 동결건조하여 무게를 측정한 후 -80℃에 보관하고 시료로 사용하였다.
TRX 및 EGF 처리군과 대조군 간의 임상증상 및 치사율 비교
임상관찰과 검사를 위하여 TRX와 EGF 단백질을 각각 단회경구 처리한 후 투여당일에는 0.5, 1, 2, 4과 6 시간 총 5회 그리고 다음날부터 실험종료일인 14일까지 하루 1회씩 독성징후, 사망유무 등 전반적인 임상증상을 관찰하였다. 그 결과 전체 실험군에서 임상적 이상소견이 보이지 않았다(Table 3). 또한 TRX와 EGF 단백질을 허용 한계용량으로 처리 후에 치사율을 확인한 결과에서도 대조군인 G1와 G3군 뿐만 아니라, 처리군인 G2과 G4에서도 사망사례가 발견되지 않았다(Table 4). 따라서 이번 연구에서는 시험물질인 TRX와 EGF의 최소 치사량(minimal lethal dose)은 허용 한계용량인 2,000 mg·kg-1 보다 높은 것으로 확인되었다.
Table 4. Mortality of ICR mice treated with TRX or EGF on single-dose toxicity test.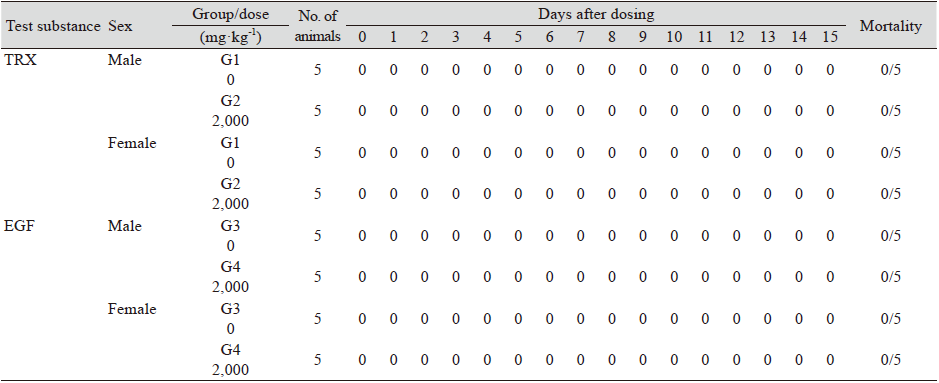
|
|
ICR, Institute of Cancer Research; TRX, thioredoxin; EGF, epidermal growth factor. |
체중 변화 및 육안적 부검소견
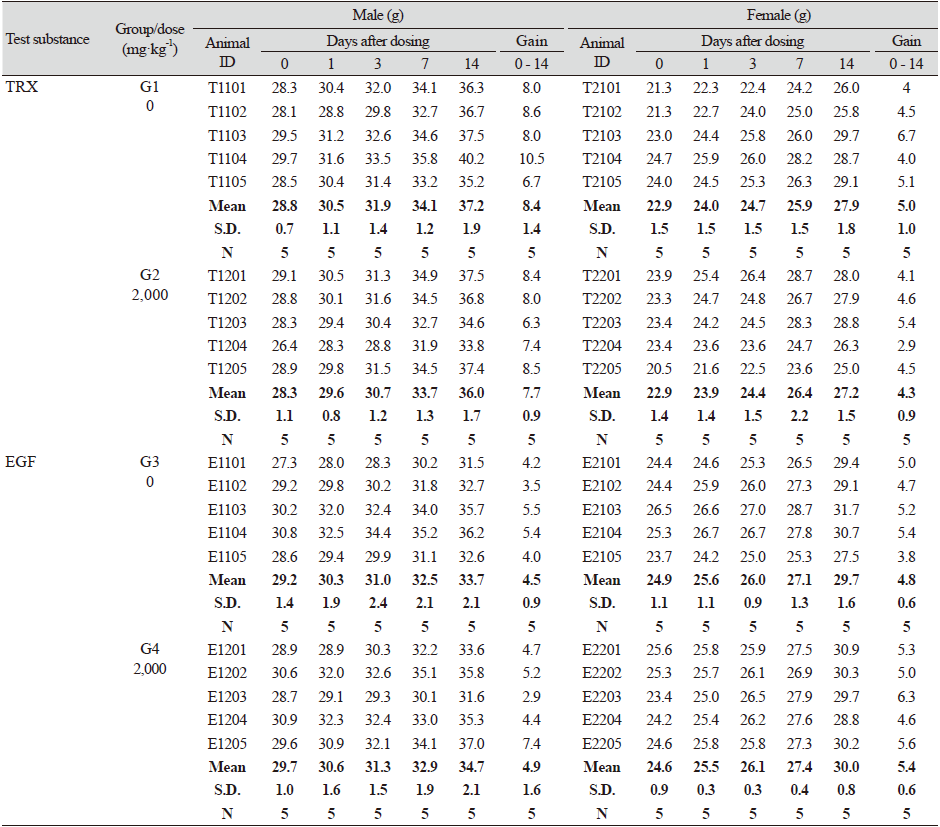
TRX와 EGF 단백질을 경구단회투여한 군들(G2와 G4)과 부형제만 처리한 군들(G1과 G3)의 암컷과 수컷 각각 5마리씩에 대한 투여 전 0일 과 투여 후, 1일, 3일, 7일, 및 14일에 체중 변화를 확인한 결과 모든 동물에서 시간이 지남에 따라서 체중이 정상적으로 증가하는 경향을 보였으며, TRX와 EGF 투여군 모두 부형제만 처리한 대조군과 비교한 결과 해당 시험물질이 마우스의 체중변화에 통계적으로 유의한 변화를 유도하지는 않은 것으로 확인되었다(Table 5; Fig. 2).
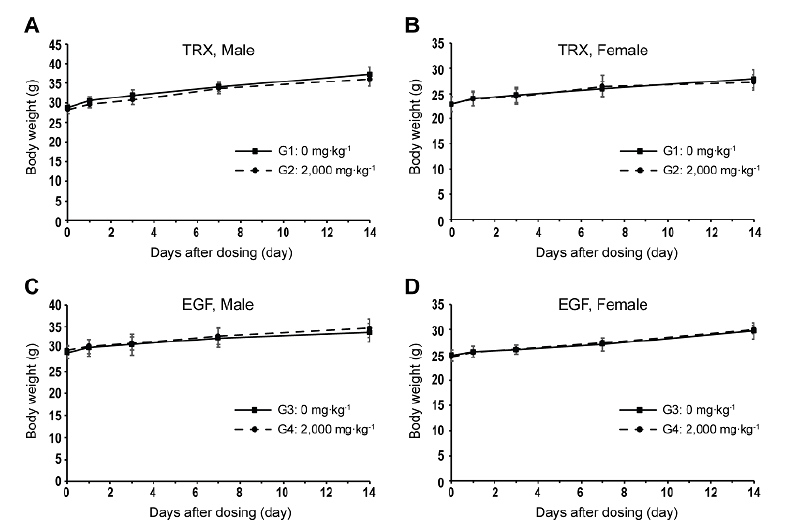
Fig. 2. Purification of thioredoxin (TRX) (A) and epidermal growth factor (EGF) (B) proteins from flask cultures, and fractions of TRX (C) and EGF (D) proteins purified by expanded bed adsorption from fed-batch culture. M, CBB, WB and S indicate protein molecular weight marker, Coomassie brilliant blue stain, western blot, and loaded sample, respectively. Arrow head indicates TRX (C) and EGF (D) bands in the gel.
또한 TRX와 EGF의 경구투여일로부터 14일째 되는 날에 실험에 사용된 4개군 모든 마우스에 대하여 부검을 실시하였다. 그 결과 투여군(G2와 G4)와 대조군(G1과 G3) 모두에서 육안으로 확인가능 한 이상 소견은 관찰되지 않았으며, 투여군과 대조군간의 부검상의 차이점을 발견할 수 없었다. 이런 이유로 추가적인 조직병리학적 검사는 실시하지 않았다.
Conclusion
본 연구는 화장품 및 의약 소재로 사용 가능한 TRX와 EGF 단백질의 단회경구투여독성을 확인하기위해 TRX와 EGF단백질을 높은 순도로 정제하고 독성평가를 위해 필요한 2 g 이상의 단백질을 생산하여 ICR 마우스에 투여한 후 체중변화, 임상증상 및 치사율 등 단회경구투여독성을 확인하기 위하여 시행하였다. 대장균을 이용하여 생산된 TRX의 경우 단백질의 과발현과 수용성 모두 기존 다른 단백질에 비하여 높게 나타나 3 L 배양액을 이용한 유가식 배양 만으로도 2 g의 단백질을 대량생산 할 수 있었다. 하지만 EGF의 경우 대량생산이 쉽지 않은 것으로 알려져 있어(Lee et al., 2003), 본 연구에서는 EBA 방법(Sharma et al., 2008)을 이용하여 EGF 단백질을 분리 및 정제를 수행하였다. 이렇게 만들어진 단백질은 C-말단의 (His)6-tag 부위를 제외하고 종자특이적 TRX 발현 형질전환콩과 종자특이적 EGF 발현 형질전환콩에서 만들어지는 TRX와 EGF단백질과 동일한 서열을 가지는 것으로 확인되었다. 이들 정제단백질을 이용하여 단회경구투여독성을 OECD 급성독성시험의 허용 한계용량인 2,000 mg·(10 mL·kg-1)-1으로 처리하여 부형제만을 처리한 대조군과 비교하였다.
TRX와 EGF 단백질을 각각 단회경구 처리한 후의 임상관찰과 검사를 위하여 독성징후, 사망유무 등 전반적인 임상증상을 관찰한 결과 전체 실험군에서 임상적 이상소견이 보이지 않았으며, TRX와 EGF 단백질을 허용 한계용량 처리 후에 치사율을 확인한 결과 전체 실험군에서 사망사례가 발견되지 않았다. 또한 TRX와 EGF 투여군과 이에 대한 대조군 간의 암컷과 수컷을 분리하여 체중변화를 확인한 결과, 투여군과 대조군 간의 통계적으로 유의한 차이가 보이지 않았다. 마지막으로 TRX와 EGF의 경구투여일로부터 14일째 되는 날에 실시한 4개군 모두의 부검 결과에서도 투여군과 대조군간의 부검상의 차이점을 발견할 수 없었다. 따라서 이번 연구에서는 시험물질인 TRX와 EGF의 최소 치사량(minimal lethal dose)은 허용 한계용량인 2,000 mg·kg-1 보다 높은 것으로 확인되었다.