Introduction
발효유의 건강 증진 효과는 유산균과 유산균 배양 중에 형성된 대사산물이 장내 부패균의 성장 저해 작용을 일으키는데 근거를 두고 있다. 유산균 발효유의 건강증진 효과에 대해서는Metchnikoff (1908)의 불노장수설에서 시작하여 많은 연구자에 의하여 장 운동 조절, 유산균에 의한 장내 균총의 균형 유지에 의한 소화기 건강(Mistuoka, 1990), 병원성 세균의 억제, 소화 흡수의 촉진, 변비, 설사 등의 효과 이외에 영양생리적인 건강증진 작용 또는 항암 기능(Ayebo et al., 1980) 등과 같은 질병 억제 작용에 대한 과학적인 연구가 진행되었다. 최근에는 probiotics로 잘 알려진 Bifidobacteria에 성장촉진물질과 식이섬유를 첨가한 발효유의 특성(Cho et al., 2020; Cho and Nam, 2021)을 바탕으로 장내 대사이상 현상 개선에 유용한 Bifidobacteria의 생존과 증식을 도와주는 Bifidobacteria 성장촉진물질을 선정하여 과민성대장증후군 개선효과가 있는 발효유 연구가 진행되어 인류에게 고통을 주는 질병을 호전시키는데 크게 기여하고 있다.
요구르트 제조에 천연식재료를 첨가한 연구는 많은 연구자들이 수행하였는데 오디 첨가요구르트(Kim et al., 2003), 쌀의 저장이 쌀 첨가요구르트에 미치는 영향(Paik and Ko, 1992), 돼지감자 첨가요구르트(Park et al., 2019). 녹색홀그레인 보리, 밀, 찹쌀, 멥쌀 분말을 첨가한 발효유의 특성(Bae et al., 2011)과 홍삼 추출물 첨가가 미생물의 생육에 미치는 영향(Bae et al., 2005) 등이 있다.
비타민나무열매는 항암, 항당뇨, 항균효과(Park et al., 2010)와 면역기능, 항염기능 및 노화방지에 뛰어난 것으로 알려져 있어 유럽 등 일부 국가에서 기능성 식품으로 개발되어 왔다(Guan et al., 2005). 천연항산화물질인 ascorbic acid, tocopherols, carotenoids, flavonoids, fatty acid 등이 함유되어 있다(Halliwell, 1997; Gao et al., 2000; Kallio et al., 2002; Rosch et al., 2003). 비타민나무열매는 약용외에도 주스용, 잼, 또는 독특한 맛으로 인해 유제품의 맛 성분으로 사용된다. 과일과 채소의 섭취 증가로 인하여 이들 성분과의 강한 연관성이 있고 암과 심장병 예방은 항산화phytonutrients의 함량에 의해 영향을 미친다(Halliwell, 1997). 그동안 항산화 활성과 다양한 과일의 식물영양소 사이의 관계(Plumb et al., 1996; Heinonen et al., 1998; Prior et al., 1998)에 관해 많은 연구가 진행되었다. 비타민나무열매는 높은 함량의 ascorbic acid (100 - 700 mg∙100 g-1), tocopherols (1 - 10 mg∙100 g-1), carotenoids (93 - 15 mg∙100 g-1)을 함유하고 있다(Yao et al., 1992).
본 연구는 국내에 비타민나무열매의 기능성 식품소재로써 활용 가능성을 알아보기 위해 항산화 물질이 풍부한 비타민나무열매 분말을 첨가한 요구르트를 제조하여 생리활성기능을 연구함으로써 기능성 요구르트 개발에 기초자료를 제공하기위해 수행하였다.
Materials and Methods
발효유 준비
비타민나무열매 분말
본 실험에서 사용된 비타민나무열매(Hippophae rhamnoides L. powder, HP)는 ㈜스타일온(Hunana Delore Naural product, Changsha, China)에서 구매한 비타민나무열매 추출 분말 100%을 사용하였다.
비타민나무열매 분말을 첨가한 요구르트 제조
10% 환원탈지유에 HP (Hippophae rhamnoides L. powder)를 각각1, 3, 5%를 혼합한 다음 starter를 9 mg 접종하고 0, 4, 8, 12, 16, 24시간으로 배양하였다. 배양이 끝난 후 4℃ 냉장고에서 24시간 숙성을 실시하였다((Park et al., 2022).
항산화 활성
DPPH 라디칼 소거능
비타민나무열매 분말 첨가 요구르트 시료의 1,1-diphenyl-2-picrylhydrazyl (DPPH; Sigma-Aldrich, St. Louis, MO, USA) 라디칼 소거능을 Blois (1958)의 방법을 변형하여 수행하였다. 시료 1 mL에 1.5 × 10-4 M DPPH 용액을 가하여 실온, 암실에서 10분간 방치한 후 517 nm에서 흡광도를 측정하였다. 그리고 양성대조군으로 L-ascorbic acid를 동일한 농도로 용해하여 사용하였다.
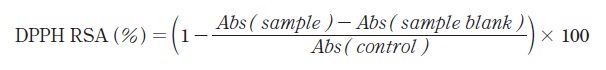 (1)
(1)
ABTS 라디칼 소거능
2,2-anziobis (3-ehtylbenzothiazoline-6-sulfonic aicd) (ABTS; Sigma-Aldrich, St. Louis, MO, USA) radical scavenging activity는Re 등(1999)의 방법을 응용하여 측정하였다. 먼저 7 mM ABTS를 140 mM K2O8S2와 혼합한 ABTS stock solution을 암실에서 12시간동안 보관한 후 potassium persulfate buffer에 혼합하여 OD (optical density) value가 0.7인 ABTS working solution을 제조하였다. 이를 희석한 발효유와 혼합한 후 37℃에서 10분간 반응 후 OD값을 측정한 후 OD 값을 식에 대입하여 소거능을 도출했다.
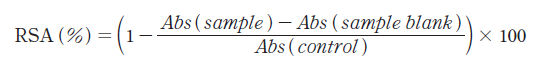 (2)
(2)
항균 활성 조사
병원성미생물인 Escherichia coli (KCTC1039), Staphylococcus aureus (KCTC1621), Pseudomonas aeruginosa (KCT3191), Salmonell Typhimurium (KCCM40253)는 Korean Collection for Type Cultures (KCTC, Daejeon, Korea)와 Korean Culture Center of Microorganisms (KCCM, Seoul, Korea)로부터 분양 받았다. 4종류의 병원성 미생물은 LB (Luria-Bertani) broth 배지에 3% 농도로 접종시켜 배양 후 원심분리를 통해 배지를 제거한 후 각각 멸균수에 희석하여 650 nm에서 동일한 0.04로 OD 값으로 맞춘 후 100 μL를 96 well microplate에 주입하였다. 시료는 대조구와 비타민나무열매 분말 1, 2, 5% 첨가한 발효유를 0, 12, 24, 48시간 각각 발효시키고 처리시간별로 시료를 well당 100 μL를 추가한 뒤 37℃에서 24시간 동안 배양하면서 0, 4, 8, 12, 16, 24시간마다 microplate reader를 이용하여 650 nm에서 흡광도를 측정하였다.
항염 효과 조사
세포 독성 평가
Y (yogurt), HP (Hippophae rhamnoides L. powder), Y + HP (yogurt with 5% Hippophae rhamnoides L. powder), HPY (yogurt containing 5% Hippophae rhamnoides L. powder)가 세포활성도에 미치는 영향을 측정하기 위해3-(4, 5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS) assay를 수행하였다. BEAS-2B 세포주를 3 × 103 cells·welL-1로 96 well plate에 분주하였으며, 표준세포배양법(37℃, 5% CO2)에서 24시간 동안 배양한 후 각각의 well에 Y, HP, Y + HP, HPY를 농도 별로 처리하고 24시간 동안 동일하게 배양하였다. 이후에 MTS 시약 20 μL을 첨가하여 490 nm 파장에서 흡광도를 측정하였다. 세포의 생존율은 다음과 같은 식에 적용하여 각 처리에 따른 상대적 세포 활성도를 측정, 평가하였다.
세포생존율(%) = 시료 첨가군의 흡광도/ 대조군의 흡광도 × 100 (3)
(cell viability)
세포배양
본 실험에 사용한 세포는 마우스 대식세포인 RAW 264.7 세포로 ATCC (American Type Culture Collection)를 사용하였다. 표준 세포 배양 법인 37℃, 5% CO2 조건을 유지하여 배양하였으며, DMEM (Dulbecco's Modified Eagle Medium; 11966-025, GIBCO, Waltham, MA, USA)에 10% (v·v-1) FBS (Fetal Bovine Serum; 16000-044, GIBCO, Carlsbad, CA, USA) 과 1% (v·v-1) Pen/Strep (Penicillin-Streptomycin; Invitrogen, Carlsbad, CA, USA)을 첨가하여 세포를 배양하였다.
Quantitative RT-PCR
RAW 264.7 세포를 7.5 × 10⁴ cells·welL-1로 12-well culture dish에 분주해 24시간 동안 배양하였다. 이후 각 well을 Y, HP, Y + HP, HPY를 0.25, 1.25 mg·mL-1 농도로 처리한 media로 교체하여 24시간 반응시킨 뒤에 염증반응을 유도하였다. 염증 반응은 각 well에 1 μg∙mL-1의 LPS를 처리하여 6시간동안 반응시켜 유도하였다. Y, HP, Y + HP, HPY가 처리된 media를 제거한 뒤 PBS를 이용하여 세척하고 hybrid-R RNA purification kit (GeneAll, Seoul, Korea)를 이용하여 RNA를 추출하였다. 추출한 RNA를 The Qubit 2.0 Fluorometer (Invitrogen, Life Technologies, Carlsbad, California, USA)를 통해 정량 하여 RNA 각 1 μg을 부피가 9 mL이 되도록 DEPC (diethyl pyrocarbonate)-treated water와 희석한 후 random hexamer (100 pmol∙μL-1)를 Y, HP, Y + HP, HPY에 1 μL를 넣고 65℃에서 5분간 반응시켰다. 반응 후 얼음에 냉각시킨 다음, 5X M-MLV RT reaction buffer 4 μL, M-MLV reverse transcriptase 1 μL, RNase inhibitor 1 μL, dNTP mix (10 mM) 1 μL, DEPC-treated water 3 μL를 첨가하여 상온에서 10분간 둔 뒤, 50℃에서 1 h 동안 반응시켜 cDNA를 합성하였다. 반응이 끝난 cDNA를 D.W를 이용해 1/10로 희석하여 실험에 사용하였다. 2×Prime Q-master mix 10 μL, 10 pmol∙μL-1의 forward primer와 reverse primer를 각각 1.5 μL, distilled water 4 μL, cDNA 3 μL를 넣은 뒤 95℃에서 denaturation 20 s, 58℃에서 annealing 20 s, 72℃에서 elongation 20 s를 40 cycle 실시하는 조건에서 AriaMx를 이용하여 qRT-PCR을 수행하였다. 실험에 사용한 primer는 다음과 같다. Tumor necrosis factor (TNF)-α, 5'-AGG GTC TGG GCC ATA GAA C-3', 5'-CCA CCA CGC TCT TCT GTC TAC-3'; interleukin (IL)-1β, 5'-AGG TCA AAG GTT TGG AAG CA-3', 5'-TGA AGC AGC TAT GGC AAC TG-3'; IL-6, 5'-GTC CTT CAG AGA GAT ACA GAA ACT-3', 5'-AGC TTA TCT GTT AGG AGA GCA TTG-3'; induced nitric oxide synthase (iNOS), 5'-CAG CTG GGC TGT ACA AAC CTT-3', 5'-CAT TGG AAG TGA AGC GTT TCG-3'; glyceraldehyde 3-phosphate dehydrogenase (GAPDH), 5'-CCA TGG AGA AGG CTG GGG-3', 5'-CAA AGT TGT CAT GGA TGA CC-3'.
통계처리
모든 실험은 3회반복하여 실시하였고 SAS package (release 8.01, SAS Institute, Cary, NC, USA)를 이용하여 평균 ± 표준편차로 표시하였고, 평균값의 통계적 유의성은 p <0.05 수준에서 Duncan’s multiple range test에 의해 검정하였다.
Results and Discussion
항산화 효과
DPPH 라디칼 소거능
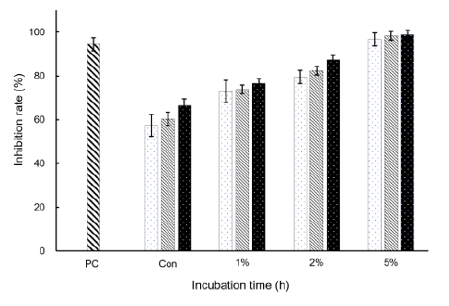
DPPH는 비교적 안정한 free radical을 가지고 있는 화합물로써 항산화력이 있는 물질과 만나게 되면 환원작용에 의해radical이 소거되는 점을 이용하여 항산화 효과를 측정한다(Blois, 1958). 그러므로 다양한 추출물들의 항산화 효과 검증에 DPPH라디칼 소거능 법을 사용하고 있다. 비타민나무열매 분말 첨가 요구르트의 DPPH 라디칼 소거능 결과는 Fig. 1에 나타난 바와 같다. 최종 발효시간인 24시간으로 비교해 보았을 때 대조구는 66.55%이며 1, 2, 5% 첨가구들은 각각 76.63, 87.38, 98.9%로 비타민나무열매 분말을 많이 첨가하고 발효시간이 길어질수록 항산화 효과가 높게 나타나는 것을 관찰할 수 있었다. 이와 유사한 실험인 비타민나무 열매 추출물의 항산화 활성 및 미백 효과(Ko et al., 2012) 결과에서도 비타민나무열매의 DPPH 대한 항산화물질 검출 결과를 확인할 수 있었다.
ABTS 라디칼 소거능
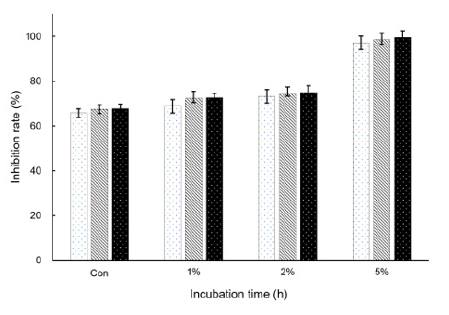
ABTS 라디칼 소거능은 항산화제의 유무를 확인하는 것으로 라디칼을 생성하는 ABTS 존재 시 hydrogen peroxide와 metmyoglobin의 활성을 토대로 보다 빠른 항산화반응을 일으켜 myoglobin 라디칼을 감소시키는 기전이다(Re et al., 1999). 비타민나무열매 분말 첨가 요구르트의 ABTS 라디칼 소거능 결과는 Fig. 2에 나타난 바와 같다. 발효 종점인 24시간째 대조구는 67.79%이며 1, 2, 5% 첨가구는 각각 74.93, 83.89, 99.57%로 대조구에 비해 비타민나무열매 분말을 많이 첨가하고 발효시간이 길어질수록 항산화 효과가 높게 나타나는 것을 관찰할 수 있었다. 이와 유사한 실험인 비타민나무 잎 첨가 현미설기떡 제조(Cho and Kim, 2015)에서도 비타민나무열매의 ABTS라디칼소거능에 대한 항산화물질 검출 결과를 확인할 수 있었으며, 항산화 효과가 잘 알려진 홍삼 추출물을 첨가한 요구르트 제조한 결과(Kim et al., 2008)와 비교하였을 때 비타민 나무열매 추출물이 항산화 작용이 높다는 결과를 얻었다. 한편 Gao 등(2000)은 비타민나무열매를 수확하는 과정 동안 phytonutrients의 상관관계와 항산화효과의 변화는 수확 초기가 중기와 말기 보다 ABTS 라디칼 소거능과 phytonutrients의 함량이 현저히 감소된다고 보고하였다. 따라서 비타민나무열매의 수확시기가 항산화효과에 미치는 영향이 크다는 것을 알 수 있었다.
항균효과
Escherichia coli
비타민나무 열매 분말 첨가 요구르트의 Escherichia coli에 관한 항균 효과는 Fig. 3에 나타난 바와 같다. Escherichia coli에 관한 항균 효과를 보면 대조구는 24시간 발효한 요구르트에서 현저하게 나타났고, 1, 2, 5% 첨가구 모두 12, 24시간 발효 요구르트에서 비타민나무열매 분말 첨가량이 높은 요구르트일수록 또한 발효 시간이 길수록 항균효과가 높게 나타났다. 또한 5% 첨가구는 0, 12, 24시간 발효 요구르트 모두에서 Escherichia coli에 대해 항균효과가 현저하게 나타난 것으로 확인되었다. 이러한 이유는 유산균은 유산 및 초산과 같은 대사산물을 생산함으로써 pH를 낮추어 유해균의 생장을 억제하고(Vandenbergh, 1993), 유산균이 생산하는 초산과 propionic acid는 유해균의 세포막과 상호반응하여 세포내 산성화와 단백질 변성을 유발시킨다고 보고하였다(Huang et al., 1986). 이와 같이 유산균이 생산하는 유산과 초산 등의 유기산에 의해 병원균들이 억제된다고 보고하였다(Midolo et al., 1995; Jeong et al., 2022).
Staphylococcus aureus
비타민나무 열매 분말 첨가 요구르트의 Staphylococcus aureus에 관한 항균 효과는 Fig. 4에 나타난 바와 같다. Staphylococcus aureus에 대한 병원성 미생물의 항균 효과는 Escherichia coli와 마찬가지로 대조구는 24시간 발효한 요구르트에서 현저하게 나타났고, 1, 2, 5% 첨가구 모두 12, 24시간 발효 요구르트에서1, 2, 5% 첨가구 모두 0시간과 24시간 발효 요구르트에서 비타민나무열매 분말 첨가량이 높은 요구르트일수록 또한 발효 시간이 길수록 항균효과가 높게 나타났다. 또한 5% 첨가구는 0, 12, 24시간 발효 요구르트 모두에서 Staphylococcus aureus에 대해 항균효과가 현저하게 나타난 것으로 확인되었다.
Fig. 3.
Antimicrobial activity in yoghurt with Hippophae rhamnoides L. powder against Escherichia coli (KCTC1039) during fermentation time by microplate reader at 650 nm. All values are mean ± standard deviation (SD) (p < 0.05). Fermentation time: ○, 0 h; △, 12 h; □, 24 h. (A) Contorl, (B) 1%, (C) 2%, (D) 5%.
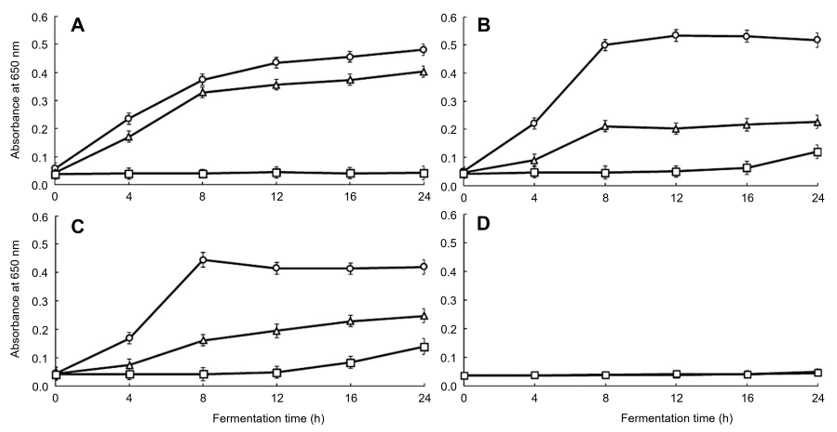
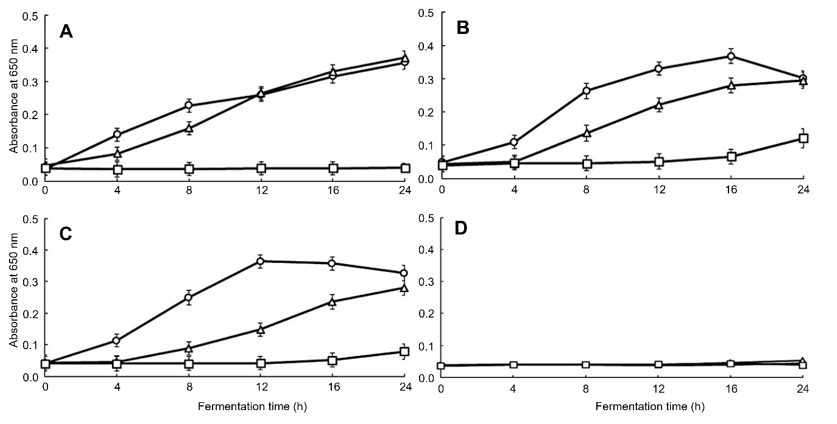
Fig. 4.
Antimicrobial activity in yoghurt having Hippophae rhamnoides L. powder against Staphylococcus aureus (KCTC1621) during fermentation time by microplate reader at 650 nm. All values are mean ± standard deviation (SD) (p < 0.05). Fermentation time: ○, 0 h; △, 12 h; □, 24 h. (A) Control, (B) 1%, (C) 2%, (D) 5%
Pseudomonas aeruginosa
비타민나무 열매 분말 첨가 요구르트의 Pseudomonas aeruginosa에 관한 항균 효과는 Fig. 5에 나타난 바와 같다. Pseudomonas aeruginosa에 대한 병원성 미생물의 항균 효과는 대조구는 24시간 발효한 요구르트에서 현저하게 나타났고, 1, 2, 5% 첨가구 모두 12, 24시간 발효 요구르트에서1, 2, 5% 첨가구 모두 0시간과 24시간 발효 요구르트에서 비타민나무열매 분말 첨가량이 높은 요구르트일수록 또한 발효 시간이 길수록 항균효과가 높게 나타났다. 또한 5% 첨가구는 0, 12, 24시간 발효 요구르트 모두에서 Pseudomonas aeruginosa에 대해 항균효과가 현저하게 나타났다. 이와 같이 항균효과는 단백질 복합체, pH 저하, 페놀성 화합물 등에 의해서 발생하는 것으로 알려졌다(Wiegand et al., 2015; Rempe et al., 2017; Elyas et al., 2019).
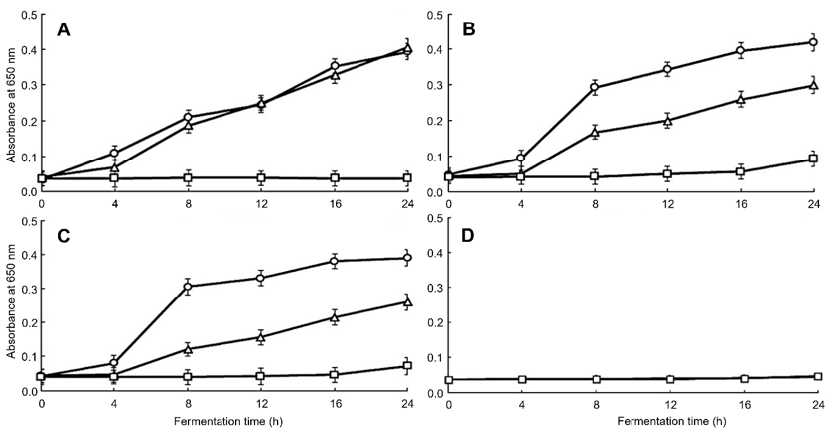
Fig. 5.
Antimicrobial activity in yoghurt with Hippophae rhamnoides L. powder against Pseudomonas aeruginosa (KCT3191) during fermentation time by microplate reader at 650 nm. All values are mean ± standard deviation (SD) (p < 0.05). Fermentation time: ○, 0 h; △, 12 h; □, 24 h. (A) Control, (B) 1%, (C) 2%, (D) 5%.
Salmonella Typhimurium
비타민나무 열매 분말 첨가 요구르트의Salmonella Typhimurium에 관한 항균 효과는 Fig. 6에 나타난 바와 같다. Salmonella Typhimurium에 대한 병원성 미생물의 항균 효과는 대조구는 24시간 발효한 요구르트에서 현저하게 나타났고, 1, 2, 5% 첨가구 모두 12, 24시간 발효 요구르트에서1, 2, 5% 첨가구 모두 0시간과 24시간 발효 요구르트에서 비타민나무열매 분말 첨가량이 높은 요구르트일수록 또한 발효 시간이 길수록 항균효과가 높게 나타났다. 또한 5% 첨가구는 0, 12, 24시간 발효 요구르트 모두에서 Salmonella Typhimurium에 대해 항균효과가 현저하게 나타났다.
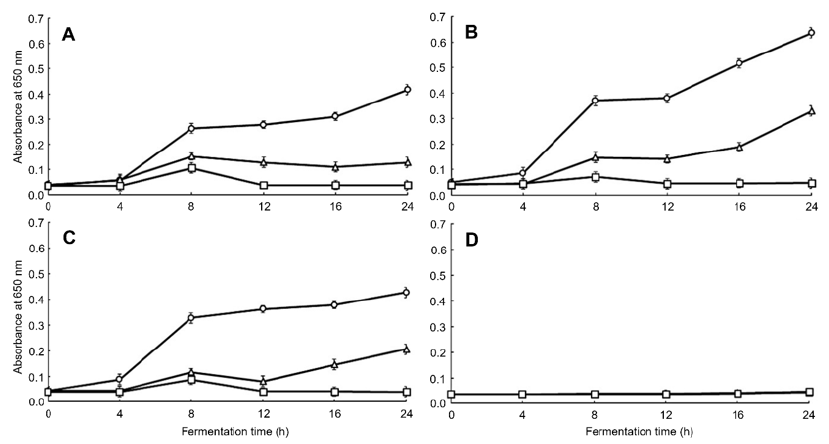
Fig. 6.
Antimicrobial activity in yoghurt with Hippophae rhamnoides L. powder against Salmonella Typhimurium (KCCM40253) during fermentation time by microplate reader at 650 nm. All values are mean ± standard deviation (SD) (p < 0.05). Fermentation time: ○, 0 h; △, 12 h; □, 24 h. (A) Control, (B) 1%, (C) 2%, (D) 5%.
항염효과
TNF-α, IL-6, IL-1β, iNOS의 mRNA발현
비타민나무열매 분말의 세포 독성 평가는 BEAS-2B세포의 활성도 변화를MTS assay로 1.25 mg·mL-1까지 실시한 결과 세포 독성이 없는 것을 확인 후 실험에 이용하였다. 비타민나무열매 분말 첨가 요구르트의 TNF-α, IL-6, IL-1β, iNOS의 mRNA발현은 Fig. 7에 나타난 바와 같다. TNF-α는 yoghurt + 5% Hippophae rhamnoides L. powder (Y + HP) 처리구가 대도구에 비해 농도의존적으로 발현이 억제됨을 알 수 있었다. 대조구(Y)인 요구르트 처리구를 제외한 처리구에서 발현 양은 억제되었으나 유의적인 차이는 없었다. TNF-α는 염증반응에서 macrophage와 mast cell 등에서 분비되며, LPS반응의 주요 매개체로서 내재면역에 있어서도 중요한 역할을 하며 만성 염증반응과도 관련되어 있다(Lee et al., 2003). IL-6는 대조구(Y)에서 0.25 mg·mL-1처리시 발현 양은 10,441.2 ± 98.97로 1.25 mg·mL-1처리시 발현 양이7,082.29 ± 67.13로 감소되었으며, HP 0.25 mg·mL-1처리시 8,335.19 ± 79.00, 1.25 mg·mL-1처리시 4,497.79 ± 42.63로 발현 양이 감소하였으며, Y + HP 0.25 mg·mL-1처리시 5,653.78 ± 53.59, 1.25 mg·mL-1처리시 1,652 ± 15.67로 발현 양이 현저하게 감소하였으며, HPY 0.25 mg·mL-1처리시는 5,007.93 ± 47.47, 1.25 mg·mL-1처리시는 2,565.46 ± 24.31로 발현 양이 농도의존적으로 현저하게 감소하였다. IL-6는 림프구를 활성화시켜 항체 생산을 증가시키는 것으로, IL-6의 수준은 염증성 병변에서 항상 증가하는 것으로 보고되고 있다(Delgado et al., 2003). 따라서 염증성 cytokine인 IL-6의 발현 양 감소는 비타민나무열매 첨가 발효유가 염증반응을 억제하는 효과가 있는 것으로 사료된다.
Fig. 7.
Effects of yoghurt (Y), 5% Hippophae rhamnoides L. powder (HP), yoghurt + 5% Hippophae rhamnoides L. powder (Y + HP), yogurt containing 5% Hippophae rhamnoides L. powder (HPY) on mRNA expression level of TNF-α, IL-6, IL-1β, and iNOS. RAW 264.7 cells were treated with indicated concentration of Y, HP, Y + HP, HPY with LPS (1 μg·mL-1) or without for 24 h. Total RNA was isolated and analysed for mRNA expression with qRT-PCR. All values are mean ± standard deviation (SD) (p < 0.05). TNF, tumour necrosis factor; IL, interleukin; iNOS, induced nitric oxide synthase; LPS, lipopolysaccharide; qRT-PCR, quantitive real time-polymerase chain reaction.
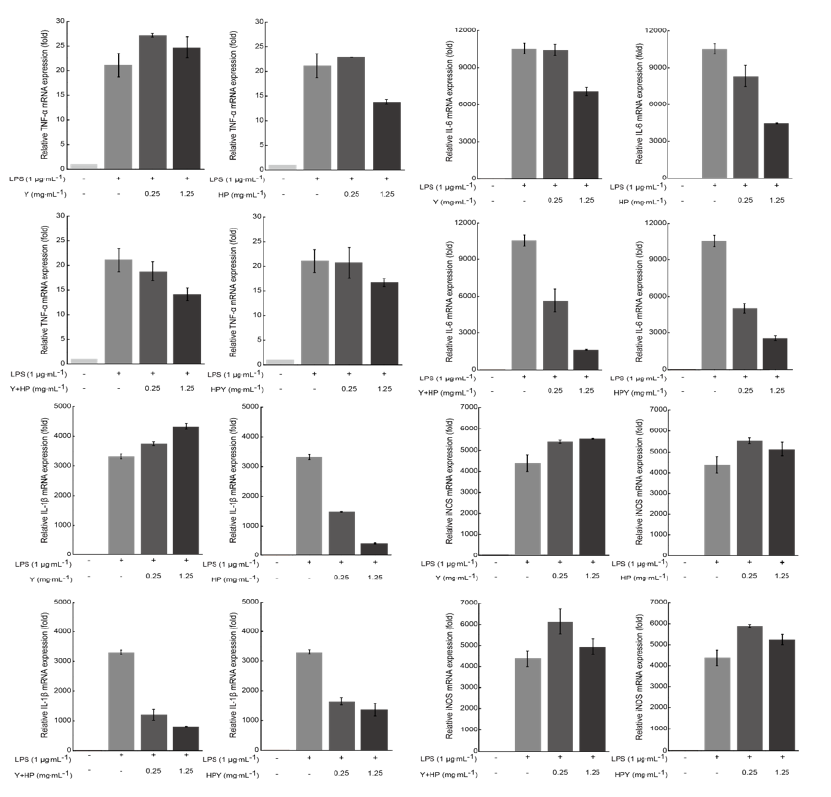
염증 관련 cytokine 중 IL-1β는 monocyte, macrophage, B-cell, dendritic cell, 간세포 등에서 분비되며, TNF-α, IL-6와 함께 pro-inflammatory cytokine으로서 여러가지 면역학적 작용들과 연관되어 있다. 또한 IL-1β는 T-cell의 활성화, B-cell의 성숙, NK cell의 activity를 활성화한다. Fig. 7에 나타난 바와 같이 IL-1β의 발현은 대조구(Y)는 농도 의존적으로 발현 양을 증가시켰으나, HP 0.25 mg·mL-1처리시는 1,468.37 ± 44.29, 1.25 mg·mL-1처리시는 407.31 ± 12.29로 급격하게 발현 양이 감소하였고, Y + HP처리시에서 0.25 mg·mL-1는 1,196.83 ± 36.1, 1.25 mg·mL-1는 806.2 ± 24.32로 현저하게 감소하였고, HPY 0.25 mg·mL-1처리시는 1,646.29 ± 49.65, 1.25 mg·mL-1처리시는 1,360.57 ± 41.04로 모두 농도 의존적으로 발현 양이 현저하게 감소하였다. 이는 염증성 cytokine인 IL-β의 발현 양 감소는 비타민나무열매 첨가 발효유가 염증 반응을 억제하는 효과가 있는 것으로 사료된다. iNOS는 평소에는 세포 내에 존재하지 않으나 일단 유도되면 장시간 동안 다량의 NO를 생성하며, 생성된 NO는 혈관 투과성, 부종 등의 염증 반응을 촉진시킬 뿐만 아니라 염증매개체의 생합성을 촉진하여 염증을 심화시키는 것으로 알려져 있다(Tezuka et al., 2001; Kim et al., 2002). iNOS는 대조구(Y)가 비타민나무열매 분말 5%를 첨가한 모든 처리구에 비해 발현이 억제되었지만 유의적인 차이는 없었다. 결론적으로 비타민나무열매 분말을 첨가한 요구르트는 항염 관련 cytokine인IL-6와 IL-1β의 발현을 억제하므로 항염 효과가 있는 것으로 사료된다.