Introduction
대두는 약 40%의 단백질을 함유하고 있는 대표적인 식물성 단백질 소재이다. 대두단백은 영양적, 기능적 특성 및 가공적성이 뛰어나 식품 또는 동물 사료에 주로 이용되며 (Mugisha et al., 2016) 대두 단백의 약 70%는 7S (β-conglycinin), 11S (glycinin) globulin 단백질로 구성되어 있다. 그 외에도 이소플라본, 페놀화합물 등의 항산화 물질과 생리활성물질을 함유하고 있고 최근에는 혈당조절, 항콜레스테롤 등 다양한 기능성을 가진 식품으로 주목받고 있다(Nishinari et al., 2014).
그러나 대두에는 8대 알레르기 유발 물질(알레르겐)이 포함되어 폭 넓은 사용 및 섭취가 제한적이며, 다른 콩과 식물과 교차 반응을 일으킬 수 있어 주의가 필요하다(Frias et al., 2008; Ra et al., 2022). 주로 알레르기를 유발하는 물질은 단백질이며, 대두의 주요 알레르겐 단백질로는 7.0 - 71 kDa 크기의 β-conglycinin (α, α’, β-subunit), Gly m Bd 30K 및 glycinin (acidic, basic subunit) 등이 있다.
미생물 발효는 알레르겐을 분해하여 알레르기 유발성을 저하하는 동시에 건강 기능성을 증진할 수 있는 방법 중 하나로 알려져 있다. 그중 고상발효는 낮은 수분 함량으로 고체 기질을 발효하는 방법으로 공정 중 오염될 가능성이 적으며 낮은 에너지 소모량과 높은 생산성을 특징으로 하는 배양 기술이다(Singhania et al., 2009).
Bacillus 속 균주는 단백질 분해효소 생산에 주로 이용되는 세균 중 하나로 열과 pH에 안정성을 가지므로(Yang et al., 2019) 상업적 가치가 뛰어나 식품 가공, 사료 보충제 및 박테리아 접종제 등 광범위하게 이용되고 있다(Back et al., 2022; Bai et al., 2022).
본 연구에 사용된 균주인 Bacillus amyloliquefaciens는 막걸리, 템페, 된장 등 전통 발효 식품이나 치즈, 요거트와 같은 유제품에도 적용할 수 있는 활용성이 뛰어난 균주로 α-amylase, protease, lipase와 cellulase 등 다양한 효소의 생산이 보고된 바 있으며(Ngalimat et al., 2021), 최근 Eom 등(2015)은 된장에서 분리된 B. amyloliquefaciens 균주가 B. cereus와 그 독소에 억제효과를 보임을 확인했다(Woldemariamyohannes et al., 2020).
B. subtilis는 청국장을 제조할 때 주로 이용되는 균주로 알칼리성 단백질 분해효소를 생산할 수 있는 것으로 알려져 있으며 항균 화합물을 생성하여 식품 방부제 및 동물 의약품 등 다방면으로 활용되고 있다(Wang et al., 2015).
B. subtilis var. natto는 일본의 전통 발효식품인 낫토(natto)를 제조할 때 이용되는 B. subtilis 와 계통학적으로 동일한 균주 중 하나로 최근 항균, 항염증, 항산화, 면역 조절 활성 등의 효과가 입증되었다(Schallmey et al., 2004; Ruiz Sella et al., 2021).
발효 대두에 대한 연구는 지속적으로 이어지고 있으나, Bacillus 속 균주의 발효 시간에 따라 변화되는 기능적 특성에 대한 비교는 아직 미비하다. 따라서 본 연구에서는 단백질 분해능이 뛰어난 Bacillus 속 균주로 발효한 대두의 단백질 분포 변화 및 기능적 특성을 비교하고자 한다.
Materials and Methods
실험 균주 배양
발효과정에 사용된 균주는 Bacillus amyloliquefaciens, Bacillus subtilis와 Bacillus subtilis var. natto로, Bacillus amyloliquefaciens, Bacillus subtilis는 건국대학교 동물자원과학과에서 제공받았으며 각각 우유와 된장에서 분리되었다. 낫토에서 분리된 Bacillus subtilis var. natto (KCTC3239)는 KCTC (Korean Collection for Type Cultures)에서 분양 받았다. B. amyloliquefaciens와 B. subtilis는 pH 7.4 nutrient broth에서 37℃로 배양되었으며 B. subtilis var. natto는 pH 6.8 nutrient broth 에서 30℃로 배양되었다.
대두 발효물 제조
본 실험에서는 대한농산의 국산 백태를 구매하여 실험을 진행하였고 발효 과정은 다음과 같다. 대두를 흐르는 수돗물에 세척한 뒤 증류수에 24시간 침지하였다. 물기가 제거된 대두는 121℃에서 30분 증자 후 37℃ 이하가 되도록 충분히 냉각하였다. 각각의 균주를 대두 1 g 당 106 CFU가 되도록 접종하여 상대습도 90%, 온도 37℃에서 각각 12, 24, 36, 48시간 발효하고 121℃에서 15분 가압증자하여 발효를 중단하였다. 이후 발효된 대두는 동결건조하여 보관하였다.
대두 단백 추출 및 농도 측정
발효 대두는 곱게 분쇄한 후 시료 내 지방성분을 제거하기 위해 0.07% β-mercaptoethanol이 함유된 acetone에서 2시간 교반하였다. 이후 얻어진 분말은 pH 8.0 50 mM Tris-HCl buffer과 1 : 10 (w·v-1) 비율로 섞은 후 4시간 교반하여 4℃, 8,000 × g에서 40분간 원심분리하였다. 상등액은 실험 전까지 -20℃에 보관하였고 BCA (bicinchoninic acid) protein assay를 이용하여 단백질 정량하였다. Standard로는 bovine serum albumin (BSA)이 사용되었고, 단백질 추출물과 BSA는 96-well plate에 25 µL씩 분주되었고 각각 200 µL의 Working reagent와 반응하여 Multskan SkyHigh Microplate (Sigma-Aldrich, St. Louis, Missouri, USA)를 이용하여 562 nm에서 흡광도를 측정하였다.
SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis)
발효 대두 추출물은 동일한 농도로 증류수와 희석한 뒤 5X Tris-glycine SDS loading buffer로 변성되었고 1 well 당 15 µg이 되도록 loading 하였다. 전기영동은 15% separating gel과 5% stacking gel을 이용하여 각 80, 100 V에서 시행되었으며 gel은 Coomassie staining solution으로 염색되었다.
DPPH (2,2-diphenyL-1-picrylhydrazyl) 자유 라디칼 소거능 분석
분쇄 대두 샘플 0.1 g을 추출용매 1 mL에 넣고 섞은 뒤 24시간 동안 실온에 보관하였다. 이후 15,000 rpm에서 10분 동안 원심분리한 뒤 상등액을 채취하여 실험에 이용하였다. 빛이 없는 상태에서 샘플 용액 40 µL에 0.2 mM DPPH (2,2-diphenyL-1-picrylhydrazyl) solution 160 µL을 넣어준 뒤 37℃에서 30분 반응시킨 후 Multiskan SkyHigh Microplate (Sigma-Aldrich, St. Louis, Missouri, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. 양성대조군으로는 L-ascorbic acid가 사용되었으며 DPPH 라디칼 소거능은 Ascorbic acid standard curve를 이용하여 계산한 뒤 µg AAE (ascorbic acid equivalent)/100 mg of dry weight로 나타내었다.
통계분석
모든 실험은 3회 반복으로 수행하였고 값을 평균과 표준편차로 나타내었다. 유의성은 Prism 9.40 (GraphPad Software, California, USA)을 이용하여 유의수준 p < 0.05에서 Two-way ANOVA과 Tukey test를 통해 검증하였다. 결과값의 유의 수준은 Control group과 비교하여 *p< 0.05, **p < 0.01, ***p < 0.001와 같이 나타냈다.
Results and Discussion
단백질 농도
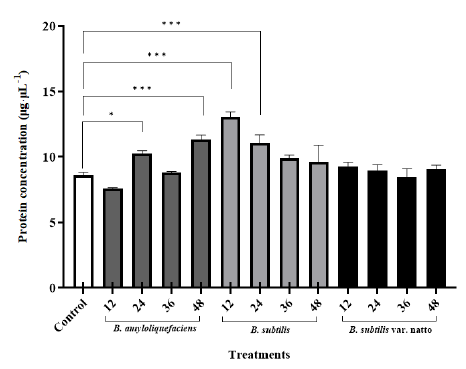
발효균주 및 시간 별 단백질 농도를 확인하기 위해 BCA assay로 분석하였다(Fig. 1). 대조군은 8.61 µg·µL-1의 농도를 보였으며 B. amyloliquefaciens로 12시간 발효한 대두를 제외하고 모두 대조군보다 높은 농도 값을 나타냈다.
B. subtilis 12, 24시간 발효물과 B. amyloliquefaciens 24시간, 48시간 발효물의 단백질농도는 대조군에 비해 유의적인 증가를 보였다(p< 0.05). 반면 B.subtilis var. natto로 발효한 대두에서는 유의적인 차이를 보이지 않았으며 발효 시간에 따른 단백질 농도의 차이를 보이지 않았다. B. subtilis로 12시간 발효한 대두의 단백질 농도는 대조군 대비 51.74% 증가하였고 B. amyloliquefaciens로 48시간 발효한 대두는 31.57%의 증가를 나타냈다.
SDS-PAGE
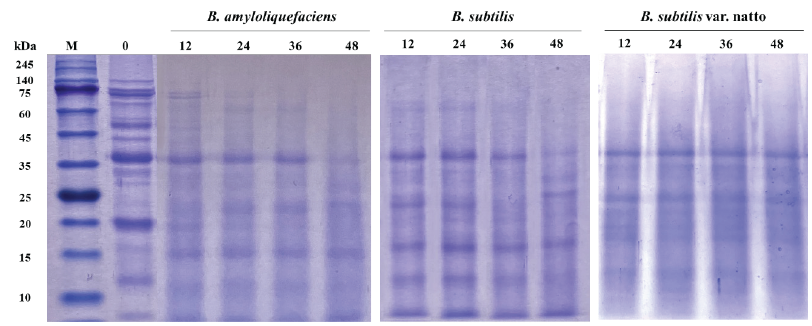
발효 대두 단백질의 분포를 확인하기 위해 발효 시간 별 대두 단백 추출물을 SDS-PAGE로 분석한 결과, 시간이 경과함에 따라 고분자 단백질 밴드가 분해됨을 확인할 수 있었다(Fig. 2). 발효 전 대두는 10 - 140 kDa에 거쳐 다양한 밴드가 분포하였으며 주요 알레르겐으로 알려진 β-conglycinin (52 - 76 kDa), Glycinin (21 - 38 kDa) 및 Gly m Bd 30K (34 kDa) 단백질 밴드가 관찰되었다. 12시간 발효 이후부터 60 kDa 이상의 고분자 밴드가 희미해지고 15 - 25 kDa 사이의 저분자 밴드의 농도가 증가하였다. B. amyloliquefaciens와 B. subtilis 발효물은 발효시간의 경과에 따른 단백질 밴드의 변화를 눈으로 확인할 수 있었지만 B. subtilis var. natto 발효물에서는 발효 시간과 관계없이 유사한 단백질 밴드를 확인할 수 있었다. 발효 전 대두에서 뚜렷하게 관찰되는 β-conglycinin은 세가지 발효 대두에서 모두 높은 수준으로 분해되었음을 확인할 수 있었으며 B. subtilis 발효 대두에서 최대 87.19%의 분해율을 보였다(Table 1). 38 kDa의 Glycinin 단백질은 B. amyloliquefaciens와 B. subtilis의 48시간 발효물에서 대부분 분해되었으나 B. subtilis var. natto 발효물에서는 발효시간의 증가에 따른 뚜렷한 변화를 확인할 수 없었다. 본 결과는 대두에 접종된 미생물이 분비하는 단백질 분해효소에 의해 주요 알레르겐으로 알려진 단백질이 작은 펩타이드로 가수분해 되었으며 B. subtilis가 세 균주 중 비교적 높은 분해율을 가짐을 알 수 있다. 이 결과는 B. subtilis의 발효능을 간접적으로 증명하고 발효에 인한 pH 감소와 연관된 것으로, 선행연구에서 pH 변화에 따른 β-conglycinin의 구조가 바뀌어 가수분해가 더 활발히 진행되는 결과와도 관련이 있을것으로 사료된다(Yang et al., 2020).
Fig. 2. SDS-PAGE patterns of extracted soybean protein after different fermentation time (0, 12, 24, 36, 48 hour) by B. amyloliquefaciens , B. subtilis and B. subtilis var. natto. M, protein marker; 0, unfermented soybean; 12, 12 hours fermented soybean; 24, 24 hours fermented soybean; 36, 36 hours fermented soybean; 48, 48 hours fermented soybean. SDS-PAGE, sodium dodecyl sulfate polyacrylamide gel electrophoresis; B., Bacilluss .
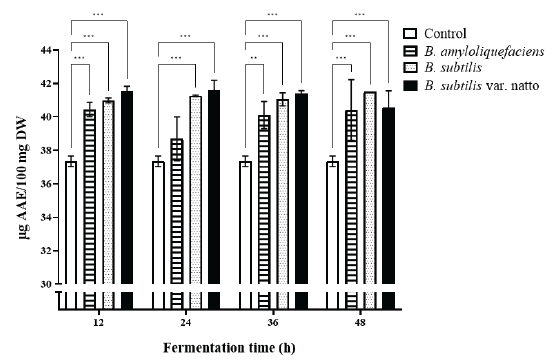
라디칼 소거능
발효하지 않은 대두와 시간 별 발효처리한 대두의 항산화능력을 DPPH assay로 측정한 결과는 Fig. 3와 같다. 발효처리한 샘플이 대조군보다 높은 라디칼 소거능을 가짐을 확인할 수 있었다. B. subtilis var. natto 발효 대두가 평균적으로 가장 높은 항산화능을 보였으며 24시간 발효물(41.5909 µg AAE/100 mg DW)에서 가장 높은 값으로 대조군(37.348 µg AAE/100 mg DW) 대비 약 11.36% 증가하였다. B. amyloliquefaciens 발효 대두는 세가지 균주 중 가장 낮은 항산화능을 보였으나 대조군보다 유의적으로 높은 값을 보였다(p < 0.01). 이는 효소를 이용한 대두 가수분해물이 기존 대두에 비해 항산화능이 향상되었다는 기존 연구와 유사한 결과를 나타내며(Zhang et al., 2018) 큰 분자량의 단백질이 유리 아미노산으로 분해되면서 강한 환원력을 나타낸다는 선행 연구(Sanjukta et al., 2015)에 따라 Fig. 2에서 분해된 유리 아미노산의 증가가 본 결과에 기여하였음을 추측 할 수 있다.
Conclusion
대두는 식품산업과 가축용 사료산업에서 널리 활용될 수 있는 대표적인 단백질 원료로 최근 대체단백식품에 주원료로 사용되고 있다. 이에 본 연구에서는 Bacillus 균주 발효를 통해 대두의 기능적 특성 변화를 확인하고자 하였다. Protease 활성이 높은 것으로 알려진 B. amyloliquefaciens, B. subtilis 와 B. subtilis var. natto 균주를 선발한 뒤 각각 12시간 간격으로 발효를 진행하였으며 균주 별 발효처리가 단백질 농도 및 분포와 항산화능에 미치는 영향을 조사하였다. 발효시간별로 상이한 결과를 보였으나 특정 시간을 제외한 대부분의 처리군에서 단백질 농도가 증가하였으며 대두 단백질이 발효 시간이 증가함에 따라 분해됨을 확인할 수 있었다. 단백질 농도는 11.33 µg·µL-1의 농도를 보인 B. subtilis 12시간 발효물에서 가장 높게 나타났으며 B. subtilis 48시간 발효물에서 가장 높은 알레르겐 단백질의 분해를 확인할 수 있었다. 또한 대조군과 비교했을 때, 모든 처리군에서 항산화능의 증가를 확인할 수 있었으며 B. subtilis var. natto 24시간 발효물에서 가장 높은 항산화능을 보였다.
이상의 결과로부터 발효균주 및 시간에 따라 대두의 특성 변화에 미치는 영향력이 상이하며 추후 대두의 사용 용도별로 적절한 발효 균주를 선정하여 고품질 발효 식품에 접목할 수 있을 것으로 예상된다.