Introduction
화상병(fire blight disease)은 화상병균(Erwinia amylovora) 병원균이 사과와 배 등 장미과(Rosaceae) 기주 식물에 감염하여 발생하는 식물세균병이다. 화상병균은 겨울철 나무의 궤양 등에서 월동하며, 봄철 날씨가 따뜻해지면 활동을 시작하여 기주 식물체의 꽃이나 상처 등을 통해 침입하며, 비, 바람, 곤충, 사람 등에 의해 다른 곳으로 전파된다. 화상병균이 나무에 침입하여 증식하면 꽃, 잎, 열매, 가지 등 감염 부위의 수침 현상과 함께 세균 누출 액이 관찰되며 점차 마름 증상과 함께 검게 변색되어 식물체 전체를 고사시킬 수 있다. 또한 오염된 묘목, 접수 등의 사용에 의해 화상병이 발생될 수 있다.
화상병은 1780년 미국 동부지역에서 최초 보고된 이후 지중해를 거쳐 유럽, 캐나다, 뉴질랜드, 중국 및 인접 중앙아시아까지 감염 범위가 점차 확대되고 있다. 국내에서는 2015년 경기도 안성시에서 최초로 병 발생이 보고된 이후, 식물방역법에 의거한 금지병원균으로 지정하고 병 발생 과수원 및 반경 100 m 이내의 모든 기주 식물을 매몰하는 등의 형태로 공적방제하고 있지만(Lee et al., 2018) 병 발생은 현재까지 계속되고 있는 실정이다.
화상병 발생에 기여하는 여러 병원성 인자들이 현재까지 보고되었다. Exopolysaccharides (EPS) amylovoran (ams)과 levan은 화상병균이 분비하는 외피다당류로 biofilm을 형성하여 식물체의 방어 시스템을 회피하여 병원성을 증가시킨다(Bugert and Geider, 1995). Type III secretion system (T3SS)은 침입관 형성을 통해 effector protein등의 식물 방어시스템 억제 물질을 기주세포내로 주입하여 기주식물의 침입에 중요한 역할을 한다(Oh et al., 2005). 이 외에도 다양한 인자들이 화상병 발생에 기여하고 있음이 밝혀져 있다(Bayot and Ries, 1986; Piqué et al., 2015). 하지만 지금까지 알려진 병원성 인자들만으로는 화상병균의 병징과 전파력을 충분히 설명하기는 힘들다고 생각되며, 화상병 방제를 위한 효과적인 방제 방법을 구축하는데 어려움이 있다.
약제를 활용한 방제는 동제 기반의 살균제 또는 항생제(streptomycin, kasugamycin, oxytetracycline)를 사용하면 화상병균을 효율적으로 제어할 수 있다는 보고가 있었지만(Slack et al., 2021), 항생제 사용이 늘면서 저항성 균이 계속적으로 발생되고 있으며 화학물질에 의한 자연 생태 파괴에 대한 문제가 지속적으로 제기되고 상황이다(Mun et al., 2017). 따라서 병을 효율적으로 방제하고 관리하기 위해서는 기주 식물체에 대한 병원체의 감염 기작 및 병원성에 대한 이해가 선행되어야 할 것이다.
본 연구에서는 화상병균에 대한 유전자 돌연변이 라이브러리를 제작하여 비 병원성 돌연변이체를 선별하고 특성을 분석하여 현재까지 보고된 병원성 유전자 이외의 새로운 병원성 유전자를 탐색하고자 하였다. 새로운 병원성 유전자들의 발견은 화상병 발생과 다양한 병원성 인자들 사이의 복잡한 상관관계를 이해하고 화상병을 방제하는데 기여할 수 있을 것이다.
Materials and Methods
화상병균 및 배양 조건
본 실험에 사용된 화상병균은 Erwinia amylovora strain TS3128 균주로 27℃, TSA (tryptic soy agar medium, BD DifcoTM, Le Pont de Claix, France) 배지에서 배양하였다. 필요한 경우 kanamycin (20 mg·mL-1)을 첨가한 TSA배지에 배양하였다.
변이체 라이브러리 제작
E. amylovora strain TS3128 균주의 변이체 제조는 EZ-Tn5TM (R6Kγori/KAN-2) Tnp Transposome kit (Epicenter Biotechnologies, Madison, WI, USA)를 사용하였다. 대상균주는 TSB배지에 접종하여 대수증식기 단계까지 27℃에서 6시간 배양하고, 이후 4℃에서 7,000 g 원심분리하여 상등액을 버리고 남은 pellet을 10% glycerol에 재현탁 하였다. 다시 4℃, 7,000 g에서 원심분리하고 상등액을 버린 뒤 남은 pellet을 10% glycerol에 재현탁하는 과정을 4회 반복하였다. 마지막 원심분리 후 pellet을 10% glycerol 1 mL에 재 현탁 하여 전기천공법을 위한 competent cell을 준비하였다. 준비된 competent cell 500 μL와 EZ-Tn5TM (R6Kγori/KAN-2)Tnp Transposome 1 μL를 2 mm cuvette에 넣어 MicroPulser Electroporator (Bio-Rad, Contra Costa, CA, USA)를 사용하여 1.8 kV, 5.1 ms의 조건으로 전기천공법을 수행하였다. 전이인자(transposon)이 삽입되어 변이를 일으킨 균주는 kanamycin (20 mg·mL-1)이 첨가된 TSB배지에서 선발하고 배양하여 20% glycerol에 현탁하여 -80℃에서 보관하였다.
병원성 검정
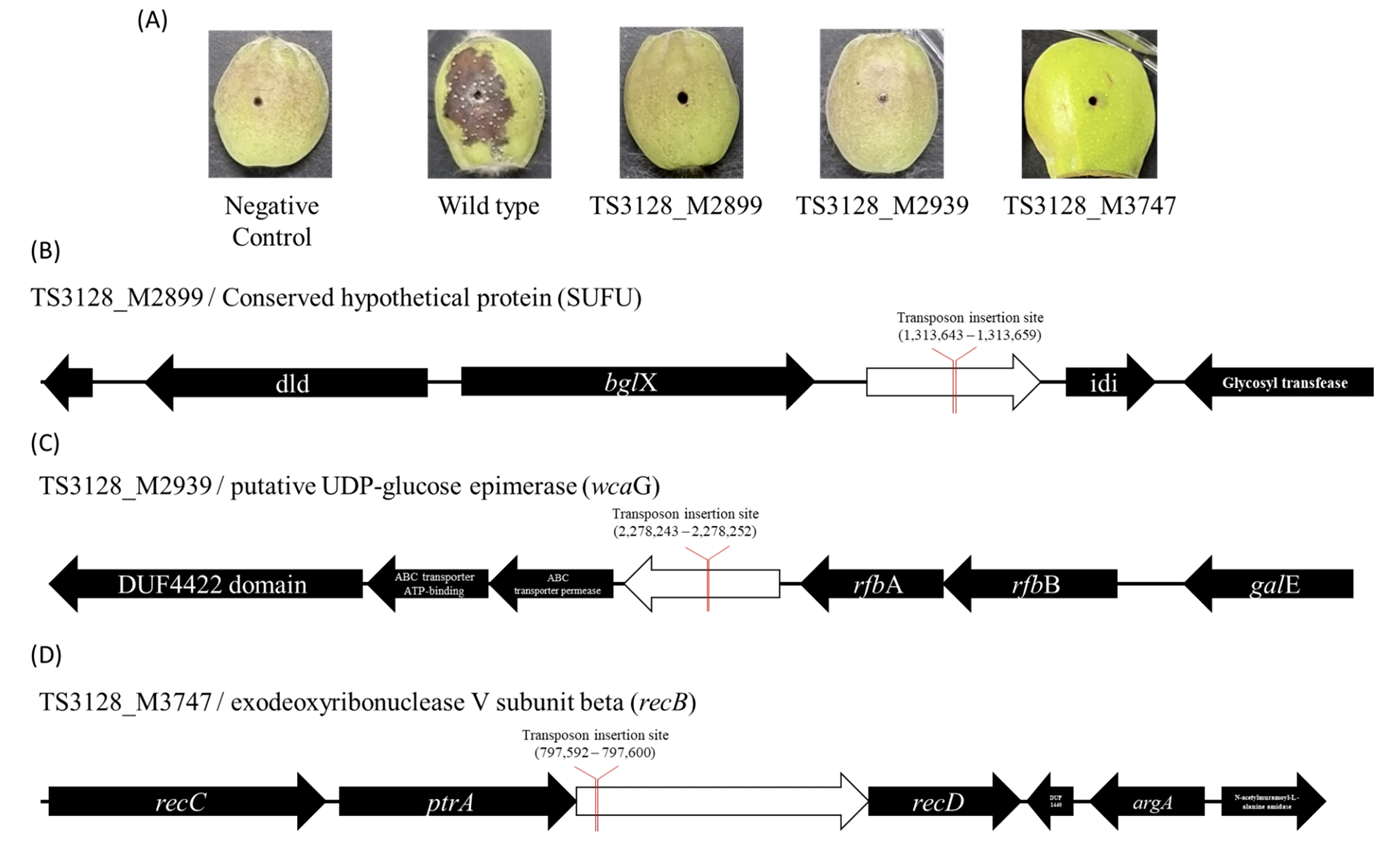
초저온 냉장고에 보관된 변이체들을 꺼내어 TSA 배지에서 하루 동안 배양한 균을 사용하였다. 대략 2.5 - 3 cm 크기의 사과 유과를 열 배 희석한 락스에서 1분간 표면 살균한 뒤, 유과를 세로방향으로 반으로 자르고 200 μL 파이펫 팁으로 중앙에 구멍을 내었다. 파이펫 팁 끝부분에 배양된 균을 소량 묻힌 뒤, 유과의 구멍에 균을 묻혔다. 화상병균 변이체를 접종한 유과는 습도가 높게 유지되는 상자에 넣어 27℃ 인큐베이터에서 일주일간 보관하였다.
DNA 추출 및 TAIL-PCR
세균의 DNA는 Wizard® Genomic DNA purification Kit (Promega, Madison, USA)를 사용하여 제조사의 프로토콜에 따라 추출하였다. TAIL-PCR을 통해 확인된 비 병원성 변이체에서 전이인자의 삽입 위치를 확인하였으며, TAILPCR은 이전의 연구(Zou et al., 2010)에서 사용된 specific primer (SP)와 arbitrary degenerated primer (AD primer)를 사용하였고, PCR 조건은 Singer와 Burke의 논문을 참고하여 수행하였다(Singer and Burke, 2003).
Results and Discussion
변이체 라이브러리 구축
사과나무와 배나무에서 화상병을 일으키는 화상병균(Erwinia amylovora)은 식물 병원균 중에서 가장 오랜 기간 연구가 되었으며, 화상병균의 병원성과 관련된 유전자들이 다수 알려져 있다(Borruso et al., 2017). 하지만 현재 알려진 병원성 관련 유전자들 만으로는 화상병균의 발병 기작을 충분하게 설명하기 힘들 뿐만 아니라, 발병 기작에 대한 이해도가 부족하기 때문에 지금까지 항생제 또는 동제 기반의 살균제 이외의 효과적인 방제 방법이 개발되지 못하고 있다. 화상병 발병 메커니즘에 기반한 새로운 방식의 방제법을 개발하기 위해서는 가능한 많은 병원성 관련 유전자들을 밝혀내는 것이 중요하다.
본 연구에서는 현재까지 알려지지 않은 화상병균의 병원성 인자를 추가로 탐색하기 위하여 야생형 화상병균(strain TS3128)에 전이인자(transposon)를 삽입하여 유전적 변이를 유도하였으며, 총 5,242개의 무작위 변이체가 제작되었다(Fig. 1).
비병원성 변이체 선발
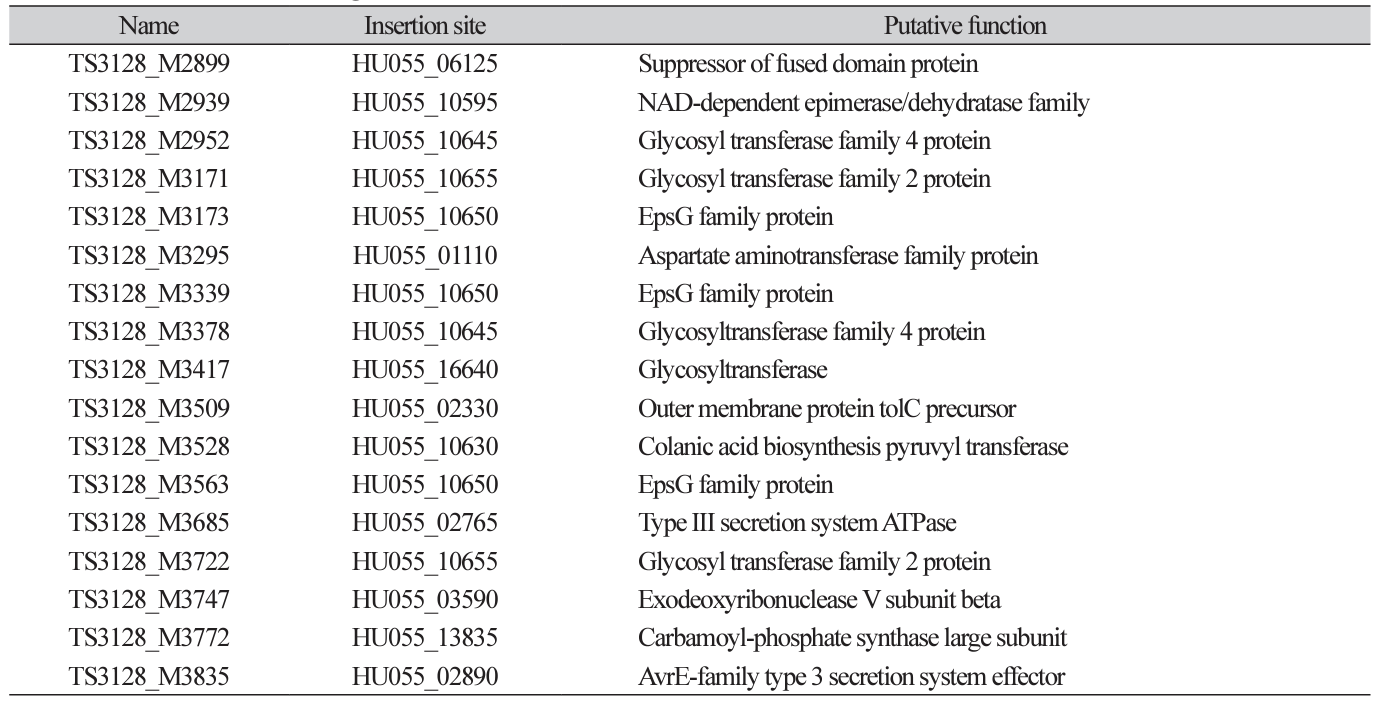
전이인자 삽입을 통해 제작된 변이체들의 병원성을 확인하기 위하여 각각의 변이체를 사과 유과에 접종하여 병원성을 검정하였다. 총 960개의 변이체를 평가하였으며, 17개의 비 병원성 변이체를 선발하였다(Table 1; Fig. 2). TAIL-PCR을 통해 해당 돌연변이의 유전체에서 전이인자 삽입 위치를 확인하여서 비활성 유전자를 찾아내었다. 그 중에서 9개 변이체(TS3128_M2952, TS3128_M3171, TS3128_M3173, TS3128_M3339, TS3128_M3378, TS3128_ M3417, TS3128_M3528, TS3128_M3563, TS3128_M3722)는 exopolysaccharide (EPS) 합성에 관련된 유전자가 비활성화 되어 있었다. 화상병균은 amylovoran과 levan를 포함하는 EPS를 생성하고, 바이오필름 형성하여 기주에 부착 또는 기주의 방어 기작으로부터 스스로를 보호하는 것으로 알려져 있다. 화상병균의 EPS 합성과 병원성의 관계는 이미 잘 알려져 있으며, EPS 자체에 기주 세포에 대한 독성은 없는 것으로 알려져 있다. 또, 2개 변이체(TS3128_ M3685, TS3128_M3835)는 Type III secretion system (T3SS)에 관련된 유전자가 비활성화 되어 있었다. T3SS는 많은 식물 병원균들이 보유하고 있는 병원성 기작으로, 기주 세포에 직접적으로 effector protein과 같은 강력한 virulence factor의 주입을 가능하게 하는 구조물이다. 그 이외에도 phytoalexins에 대한 저항성에 중요한 역할을 하는 tolC가 비활성화된 TS3128_M3509와, arginine 영양요구성(auxotrophy)과 관련된 argD gene과 carB gene이 비활성화된 TS3128_M3295, TS3128_M3772 변이체가 발견되었다. 하지만, 위 14개 변이체는 비활성화된 유전자들과 병원성과의 연관성이 이미 보고되어 있었기 때문에 해당 변이체들은 추가적으로 분석하지 않았다.
Fig. 2
A diagram of 17 pathogenic genes of Erwinia amylovora identified through this study and their functions. The black lines represent the mechanism associated with the defective gene in the corresponding mutant. The red dotted lines represent the predicted mechanism associated with the defective gene in the corresponding mutant.
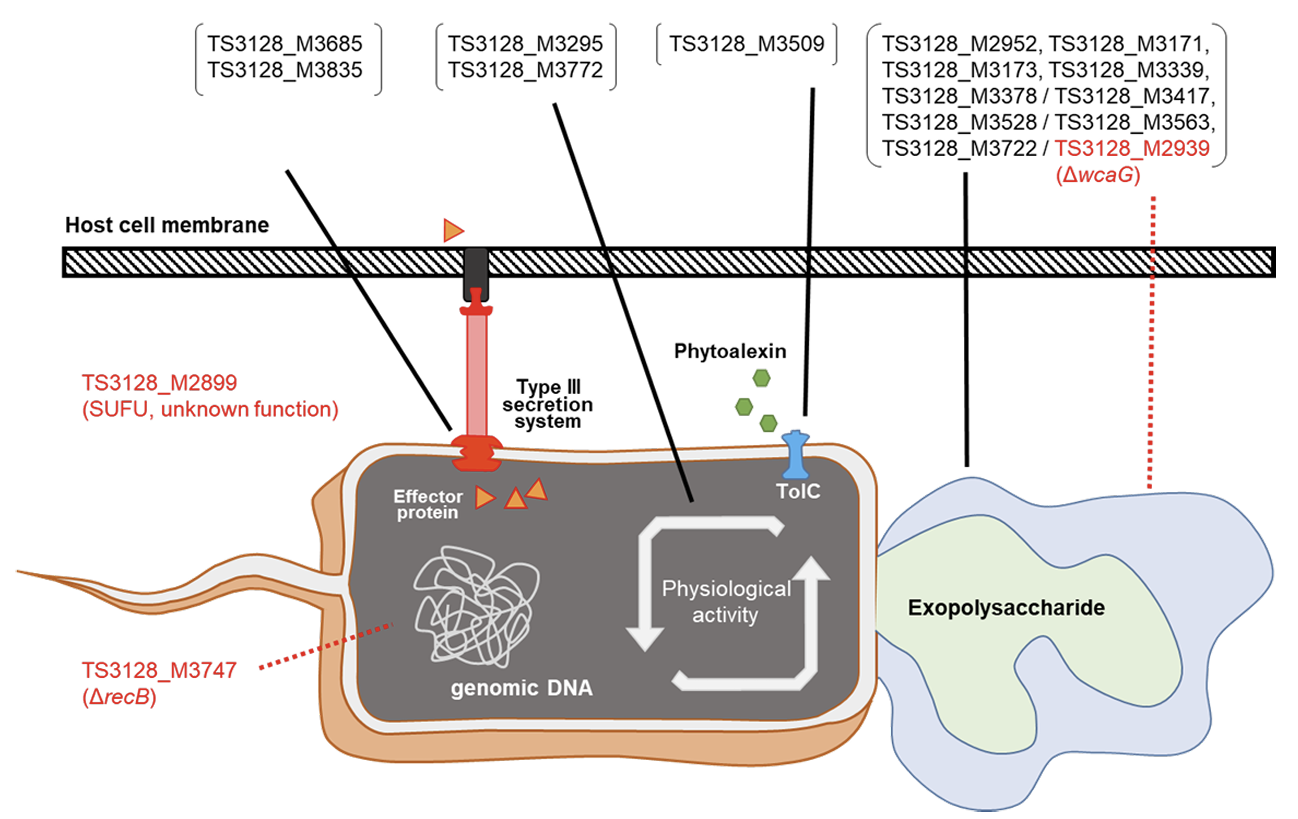
반면, TS3128_M2899 변이체에서 확인된 suppressor of fused domain protein (SUFU)와 TS3128_M2939 변이체에서 확인된 wcaG gene 그리고 TS3128_M3747 변이체에서 확인된 recB gene, 3개의 유전자와 화상병균의 병원성과의 연관성은 아직 보고되지 않았다. NAD-dependent epimerase/dehydratase family protein을 암호화하는 wcaG gene은 Pectobacterium carotovorum의 병원성에 관여한다는 사실이 보고되어져있다(Islam et al., 2019). P. carotovorum 균주에서 NAD-dependent epimerase/dehydratase family protein은 E. coli의 GDP-fucose synthase와 homologue인것으로 알려져 있었으며, 이는 E. coli의 EPS중 하나인 colonic acid 합성에 중요한 효소인 것으로 알려져 있다. 그렇기 때문에 화상병균에서 wcaG gene의 역할 또한 EPS 합성에 관련되어 있을 것이라 추측된다. 또한 exodeoxyribonuclease V subunit beta를 암호화하는 recB는 인체 병원균인 Salmonella enterica의 병원성과의 관계가 보고되어 있었다(Cano et al., 2002). S. enterica의 병원성에서 recB의 역할은 대식세포 내에서 손상된 유전체의 회복을 유도하여 세포 분열을 가능하게 하는 것으로 확인되어 이었다. 하지만 식물의 면역과 인체의 면역은 확연하게 다른 시스템을 가지고 있기 때문에 화상병균의 병원성과 recB gene과의 연관성에 대해서는 추가적인 연구가 필요할 것이다. SUFU gene은 진핵생물에서 배아세포의 분화와 관련된 hedgehog signaling pathway의 조절유전자로 알려져 있다. 하지만, 원핵생물에서 SUFU gene에 대한 연구는 되어 있지 않았기 때문에 화상병균의 병원성과 관련하여 조사해볼 필요가 있다.
Conclusion
식물병 발생을 방제하기 위해서는 해당 병원균의 생활사 또는 감염 및 발병 메커니즘에 대한 이해가 필수적으로 요구된다. 본 연구에서는 전이인자(transposon)를 사용하여 제작된 화상병균 변이체들을 유과에 접종하여, 병을 내지 못하는 변이체들의 선발을 통해 화상병 발생과 직접적으로 연관된 다양한 유전자들을 확인하였다. 기존에 알려지지 않은 병원성 인자의 확인도 본 연구에서 중요한 결과이며, 이런 발견을 통해 화상병균의 새로운 감염 및 발병 메커니즘의 발견을 이끌어낼 수 있다. 또한, 분석 과정 중 확인된 다양한 변이체들을 방제 연구에서 적극적으로 활용·응용하며 해당 병원성 인자들의 역할 또는 기능을 면밀히 분석한다면 화상병균의 생활사 또는 병발생 메커니즘 대한 이해도를 높일 수 있을 것으로 기대된다.
Authors Information
Seung Yeup Lee, https://orcid.org/0000-0002-8768-7276
Hyun Gi Kong, Department of plant medicine, Chungbuk National University, Professor
In Jeong Kang, https://orcid.org/0000-0001-6689-0024
Hyeonseok Oh, https://orcid.org/0000-0002-1673-5170
Hee-Jong Woo, https://orcid.org/0000-0003-0922-410X
Eunjung Roh, https://orcid.org/0000-0003-2999-5817