Introduction
최근 지구의 환경 온도는 급격하게 상승되고 있으며, 전 세계 열대 및 아열대 지역의 농업 분야에 심각한 영향을 주고 있다(Nawaz et al., 2021). 환경 온도의 점진적인 상승은 유기체의 체온 정상 범위(thermo-neutral zone)를 벗어나게 하고, 이로 인해 정상적인 생리 기능을 방해하며 세포 손상을 유발한다(Nawaz et al., 2021). 최종적으로 주변 환경 온도의 상승은 사료효율 및 성장 저하로 인해 생산성이 감소되고 신체 내 불균형과 같은 스트레스 관련 문제가 발생한다(Renaudeau et al., 2012; Nawab et al., 2018). 특히, 가금은 깃털로 덮여 있고 땀샘이 없어 체외로 열을 쉽게 발산하지 못해 고온에 매우 취약하다(Park et al., 2022). 이러한 이유로 고온 스트레스(heat stress)는 가금 산업에서만 연간 1억 2,800만 달러에서 1억 6,500만 달러의 경제적 손실이 발생하고 있으며(Nawab et al., 2018), 이에 고온 스트레스를 효과적으로 완화시킬 수 있는 방안이 필요하다(Nawab et al., 2018; Goel, 2021).
닭의 장 건강은 영양소 소화 및 흡수에 중요한 역할을 하며, 장 상피는 병원성 물질 투과에 대한 보호 기능도 한다(Goel, 2021). 하지만, 육계가 고온 스트레스에 노출되면 장 점막과 미생물의 손상 및 장의 형태학적 변화로 영양분 흡수가 저하되고, 장누수증후군(leaky gut syndrome)에 의한 병원균 침투가 증가해 염증반응이 높아진다(Goel, 2021; Wang et al., 2022), 또한, 단백질 소화 능력 저하로 소장 내 필수아미노산의 흡수가 감소했으며(Wang et al., 2022), 맹장 내 소화되지 않은 단백질의 침착은 병원성 세균의 증식으로 인한 괴사성 장염 발생을 높여 면역력을 저하시켰다(Cardinal et al., 2019). 이러한 이유로 최근 가금 사료에 아미노산을 첨가하여 고온스트레스를 완화하기 위한 연구가 진행되고 있다. 고온 환경에서 육계의 사료 내 글루타민(glutamine)의 첨가는 첨가 수준에 따라 증체량, 사료섭취량 등 생산성이 선형적으로 증가하였으며 계육 품질도 개선시켰다(Dai et al., 2009). 또한 트립토판(tryptophan)의 첨가는 고온 환경의 육계 가슴육 품질 개선과 스트레스 지표인 HSP (heat shock protein) 70과 corticosterone 수준을 낮추고 장내 병원균 수가 감소되는 것으로 보고되었다(Bello et al., 2017).
글리신(glycine, Gly)은 중요한 비필수 아미노산 중 하나로 많은 동물의 영양과 신진대사에 중요한 역할을 한다(Razak et al., 2017). Gly은 글루타치온, 포르피린, 퓨린 및 크레아틴과 같은 중요 대사 산물의 전구체이며 중추신경계에서 신경전달물질로 작용하여 항산화, 항염증, 면역조절 등 중요한 기능에 관여한다(Razak et al., 2017). 또한 일반적인 단백질 합성 역할 외 간에서 세린 하이드록시메틸트랜스퍼라제(serine hydroxymethyltransferase)의 활성을 증가시켜 세린(serine)으로도 전환될 수 있다(Yuan et al., 2012). 특히, 병아리 시기에 Gly은 체중과 사료 효율 개선에 기여하는 필수 아미노산으로 알려져 있다(Yuan et al., 2012). 하지만 아직까지 가금 사료 내 Gly을 첨가하여 고온 스트레스 완화 효과를 조사한 사례가 적다.
따라서, 본 연구는 고온 환경에서 육계 사료 내 Gly을 수준별 첨가하였을 때 생산성, 계육 품질, 혈액 성상, 스트레스 지표 및 깔짚 상태에 미치는 영향을 조사하고자 수행하였다.
Materials and Methods
시험 설계 및 사양관리
본 연구에서 총 760 수의 1일령 수컷 Ross 308 육계를 공시하였다. 시험 사료는 육계의 영양 요구 사항을 충족하고 옥수수, 대두박 기반으로 한 상업용 사료를 사용하였으며, 처리구별로 Gly (99%, Samin Chemical Co., Korea)의 첨가 수준을 달리하여 첨가 및 배합하였다. 글리신의 첨가 수준은 Siegert 등(2015)과 Won 등(2023)의 연구를 고려하여 3처리(Gly 0.1%, Gly 0.2%, Gly 0.3%)로 설계하였으며 무첨가구(control, CON)를 포함한 총 4처리, 처리구당 5반복, 반복당 38수를 임의 배치 하였다. 시험기간은 총 5주간 수행하였다.
각 반복구는 크기가 같은 pen (1.0 m × 2.0 m)에 사육밀도를 동일하게 하여 수용하였다. 시험기간동안 자유 섭취 및 음수하도록 하였으며, 점등프로그램은 23L : 1D (L, light; D, dark)를 유지하였다. 본 시험은 국립축산과학원 가금연구소 실험동물 관리 및 연구윤리위원회의 규정과 허가(승인번호: 2020-470)에 따라 실시하였다.
고온 환경 조성
1일령부터 21일령까지의 계사 내 환경은 Ross 308 사양관리 매뉴얼(Aviagen, 2018)에 따라 수행하였으며, 1일령에 33℃로 설정한 후, 주마다 약 2 - 3℃를 낮춰 21일령까지 사육 온도가 21℃가 되도록 설정하였다. 22일령부터 가스온풍기를 이용해 계사 내 온도를 시간당 2℃씩 서서히 올렸으며, 최종 온도로 32 ± 1℃, 습도는 60 ± 5%를 유지하였다. 고온 환경은 2주동안 지속하였고, 로그 온습도계를 설치하여 사육환경을 관리하였다.
조사항목 및 방법
생산성
생산성 분석 항목으로 체중(body weight, BW), 증체량(body weight gain, BWG), 사료섭취량(feed intake, FI), 사료 요구율(feed conversion ratio, FCR)을 조사하였다. 체중과 사료섭취량은 매주 측정하였으며, 체중은 반복구 내 모든 수수의 무게를 측정한 후 각 반복에 대한 평균 무게 및 증체량을 구하였다. 사료섭취량은 매주 반복별 사료 잔량을 측정하여 구하였으며, 사료 요구율은 사료섭취량 대 증체량 비율로 계산하였다.
시료 채취
시험 종료 시, 반복별 2수씩 무작위로 선별하여 시료(가슴육, 혈액 및 공장)를 채취하였다. 혈액은 익하정맥 채혈법을 이용하였으며, 채취한 5 mL의 혈액은 EDTA (ethylenediaminetetraacetic acid)가 처리된 tube와 serum separator tube (Becton, Dickinson and Company, USA)에 나누어 주입하였다. Serum separator tube는 4℃, 3,000 rpm 조건으로 15분간 원심분리(Vision Scientific Co., Ltd., Korea)하여 혈청을 수집하였으며, 분석 전까지 -70℃에 보관하였다. 가슴육은 도축 직후 품질 분석 전까지 4℃에서 보관하였다. 공장의 형태학적 특성을 분석하기 위하여 공장의 중간 지점을 기준으로 약 8 cm 크기로 적출하여 식염수로 세척한 후 0.1 M PBS (phosphate buffer, pH 7.0)로 희석한 10% formalin에 고정시켰다.
혈액 내 혈구, 생화학 특성 및 corticosterone 분석
혈구분석은 EDTA가 처리된 튜브를 이용하였으며, 혈액 채취 후 24시간 이내 자동 혈구 분석기(Hemavet ® HV950FS, Drew Scientific Inc., USA)를 사용해 측정하였다. 혈청 내 생화학 분석은 자동 혈액 생화학 분석기(AU480 Chemistry Analyzer, Beckman Coulter Inc., USA)를 이용하였으며, 분석 항목으로는 TCHO (total cholesterol), TG (triglycerides), GLU (glucose), TP (total protein), ALB (albumin), AST (aspartate aminotransferase), ALT (alanine aminotransferase), Ca (calcium), IP (inorganic phosphorus), CRE (creatinine) 및 LDH (lactate dehydrogenase)을 측정하였다. Corticosterone 분석은 corticosterone ELISA kit (K014-H, Arbor Assays Inc., USA)를 이용하여 분석하였다.
공장의 형태학적 분석
10% formalin에 고정시켜둔 시료는 paraffin으로 고정시켜, 5 μm 두께로 절편한 뒤 H&E (hematoxylin and eosin)로 염색하였다. 염색한 절편은 40배 배율에서 형광현미경(TE2000, Nikon Corporation, Japan)을 통해 융모 높이(villus height, VH), 음와 깊이(crypt depth, CD)를 측정하였으며,, 융모 높이와 음와 깊이의 비율(VH/CD)은 각 항목을 나누어 계산하였다.
가슴육 품질 분석
육색 분석은 colormeter (CR-300, Minolta Co., Japan)를 이용하여 각 시료 표면을 측정하였으며, 항목으로 L* (lightness), a* (redness), b* (yellowness)를 분석하였다. 가슴육의 pH는 계육과 증류수를 1 : 10로 혼합, 균질한 후 pH meter (pH-K21, NWK-Binar GmbH, Germany)를 이용하여 측정하였다. 가열감량은 가슴육을 일정 모양으로 성형한 후, 폴리에틸렌 백에 넣고 water bath (VS-310SWR, Vision Scientific Co., Ltd., Korea)에서 75℃, 30분간 가열하였다. 그 후 30분간 방냉하였으며, 가열전과 가열 후의 중량 차이를 비교해 중량 손실을 계산하였다.
전단력은 시료를 2 cm 두께로 절단하여 75℃ 수조에서 30분간 가열, 실온에서 30분간 냉각시킨 후 직경 1.27 cm의 코어를 사용하여 시료를 준비하였다. 준비한 시료는 V blade를 이용하여 물성 분석기(Texture Analyzer TA 1, Lloyd Instruments, UK)로 측정하였다. 보수력은 0.5 g의 가슴육을 시험관에 측량하여 75℃의 수조에서 20분간 가열하였다. 이후 실온(22 ± 2℃)에서 방냉하였으며, 방냉 후 원심분리(3,000 rpm, 20분, 4℃) 하였다. 원심분리 이후에 수집한 시료의 무게를 측정하여 다음의 식(1)을 이용해 보수력을 측정하였다.
가슴육내 항산화 특성
가슴육의 항산화 특성을 조사하기 위하여 DPPH (2,2-diphenyl-1-picrylhydrazyl) 라디칼 소거능, FRAP (ferric reducing antioxidant power)과 TBARS (thiobarbituric acid reactive substance)를 분석하였다.
가슴육 내 DPPH 라디칼 소거능 측정을 위해 Blois (1958)의 방법을 이용하였다. 메탄올로 용해시킨 0.2 mM DPPH 100 μL에 각 시료를 100 μL씩 혼합하였으며, 실온(22 ± 2℃), 암실에서 30분간 반응시켰다. 이후 517 nm에서 microplate reader (Epoch 2, BioTek Instruments Inc., USA)를 이용하여 흡광도를 측정하였다. DPPH 라디칼 소거능은 아래의 식(2)에 따라 계산하였다.
TBARS는 TBA (thiobarbituric acid)와 반응시켜 적색 영역의 흡광도를 측정하는 방법으로 수행하였다(Buege and Aust, 1978). 시료 5 g에 증류수 15 mL을 혼합한 후 균질하였으며, 균질액 1 mL에 7.2% BHA (butylated hydroxyanisole) 50 μL과 TBA-TCA (trichloroacetic acid)을 2 mL을 첨가하였다. 혼합물은 교반한 뒤, 90℃의 수조에서 15분간 가열하였으며 10분간 10분간 ice에서 방치하였다. 이후 2,000 × g에서 10분간 원심분리하였으며, 원심분리 후 상층액을 microplate reader (Epoch2, Biotek Instruments, Winooski, VT, USA)를 이용하여 531 nm에서 흡광도를 측정하였다. TBARS 값은 흡광도 수치에 5.88을 곱하여 나타내었으며, 계육 1 kg당 MDA (malonaldehyde, mg)로 식(3)으로 산출하였다.
FRAP assay는 Benzie와 Strain (1996)의 방법을 이용하여 측정하였다. FRAP solution은 sodium acetate buffer (pH 3.6) 300 mM에 40mM HCl로 용해시킨 2,4,6-tripyridyl-S-triazine 10 mM 및 FeCl3 ·6H2 O 20 mM을 10 : 1 : 1 (v : v : v)로 혼합하여 사용하였다. 시료 25 μL와 FRAP solution 175 μL를 혼합한 후, 37℃에서 30분간 방치하였다. 용액의 흡광도는 590 nm에서 측정하였으며, 각 샘플의 FRAP 값은 trolox(TE)를 표준물질로 하여 standard curve를 계산하였으며, uM TE/g dry matter (DM)로 표시하였다.
통계처리
본 연구에서 수집한 모든 데이터는 SAS (version 9.4, 2014, SAS Institute Inc., USA)의 GLM (general linear model) procedure를 이용하여 분석하였다. 처리구 간의 유의한 차이는 Duncan’s multiple-range test에 의해 결정되었으며, 유의 수준 p < 0.05에서 검정하였다. 생산성과 깔짚 내 수분 함량은 각 펜을 실험 단위로 고려하였으며, 각 펜에서 선별한 개체는 계육 품질, 혈구 및 혈액 생화학 특성에 대한 실험 단위로 사용하였다. 또한 orthogonal polynomial contrasts test를 이용하여 사료 내 Gly 첨가량에 따른 1차(linear, L), 2차(quadratic, Q) 및 3차(cubic, C) effect를 평가하였다.
Results and Discussion
생산성
사료 내 Gly의 첨가 수준에 따른 육계 생산성에 대한 결과는 Table 1에 나타내었다. 적정 환경에서 사육된 3주차 증체량은 Gly의 첨가 수준에 따라 선형적으로 증가하였으며(linear, p < 0.05), 2주간의 고온 환경에 노출된 5주차의 체중은 Gly 0.1 및 0.3% 처리구에서 가장 높게 나타났다(cubic, p < 0.05). 또한 Gly 0.1% 그룹은 고온 환경에서 가장 많은 증체량을 보였다(cubic, p < 0.05). 전반적으로 Gly의 0.1% 및 0.3% 첨가는 높은 증체량과 사료섭취량을 보이며, 육계의 생산성에 긍정적인 영향을 나타내었다(cubic, p < 0.05). 고온 환경은 가축의 사료 섭취량 및 에너지, 영양소 이용 효율 감소와 산-염기 균형 손상, 장 장벽 기능 감소, 산화 스트레스 증가로 인해 생산 능력을 저하시키는 것으로 보고되고 있다(Won et al., 2023). 특히 스트레스 조건에서 아미노산의 산화를 가속화시키고 더 많은 에너지를 요구하며(Kim et al., 2022), 이 과정에서 생성되는 요산(uric acid, UA)이 증가함에 따라 UA의 구조 분자인 Gly의 요구량을 증가시킨다(Won et al., 2023). 이러한 환경에서 불충분한 Gly의 공급은 체내 독성 암모니아가 축적되게 되며 가금의 성장 능력이나 건강에 해로운 영향을 주게 된다(Won et al., 2023). Awad 등(2017)의 연구에서는 고온 환경 내 낮은 CP (crude protein) 수준의 육계 사료에 Gly을 보충하였을 때, 증체량, 사료섭취량, FCR 등 생산성이 개선되었으며, Won 등(2023)의 연구에서도 고온 환경에서 Gly을 첨가하였을 때, 성장 능력이 개선되었다. 우리의 연구에서도 사료 내 Gly 0.1% 첨가가 증체량과 사료 섭취량을 증진시키며 고온 환경에서의 육계 생산성에 긍정적인 영향을 주었다. 이러한 결과는 Gly의 보충이 고온 환경의 육계 생산성을 향상시키는 잠재적인 수단이 될 수 있으나, 현재까지 보고된 사례가 부족하여 추가 연구가 필요할 것으로 보인다(Won et al., 2023).
가슴육 품질
Gly 첨가 수준에 따른 계육 품질 비교 결과는 Table 2에 나타내었다. 사료 내 Gly의 0.1% 첨가는 무첨가구 대비 가슴육의 pH가 높게 나타났으며(quadratic, p < 0.05; cubic, p < 0.05), 가열감량과 보수력, 육색에는 모든 처리구가 비슷하였다. 전단력은 무첨가구보다 Gly 0.1% 그룹이 유의적으로 낮았으나 Gly 첨가 그룹 (Gly 0.1%, Gly 0.2%, Gly 0.3%) 사이에서는 모두 비슷하였다(quadratic, p < 0.05). 고기의 pH 특성은 근육 내 젖산 함량을 나타내며, 보수력, 육색 및 전단력 등에 영향을 미친다(Dai et al., 2009). 육색, 냄새 등 고기의 외관 품질은 고기의 신선도를 나타내며,
Table 1
Effects of dietary glycine supplementation levels on performance of broilers under high temperature.
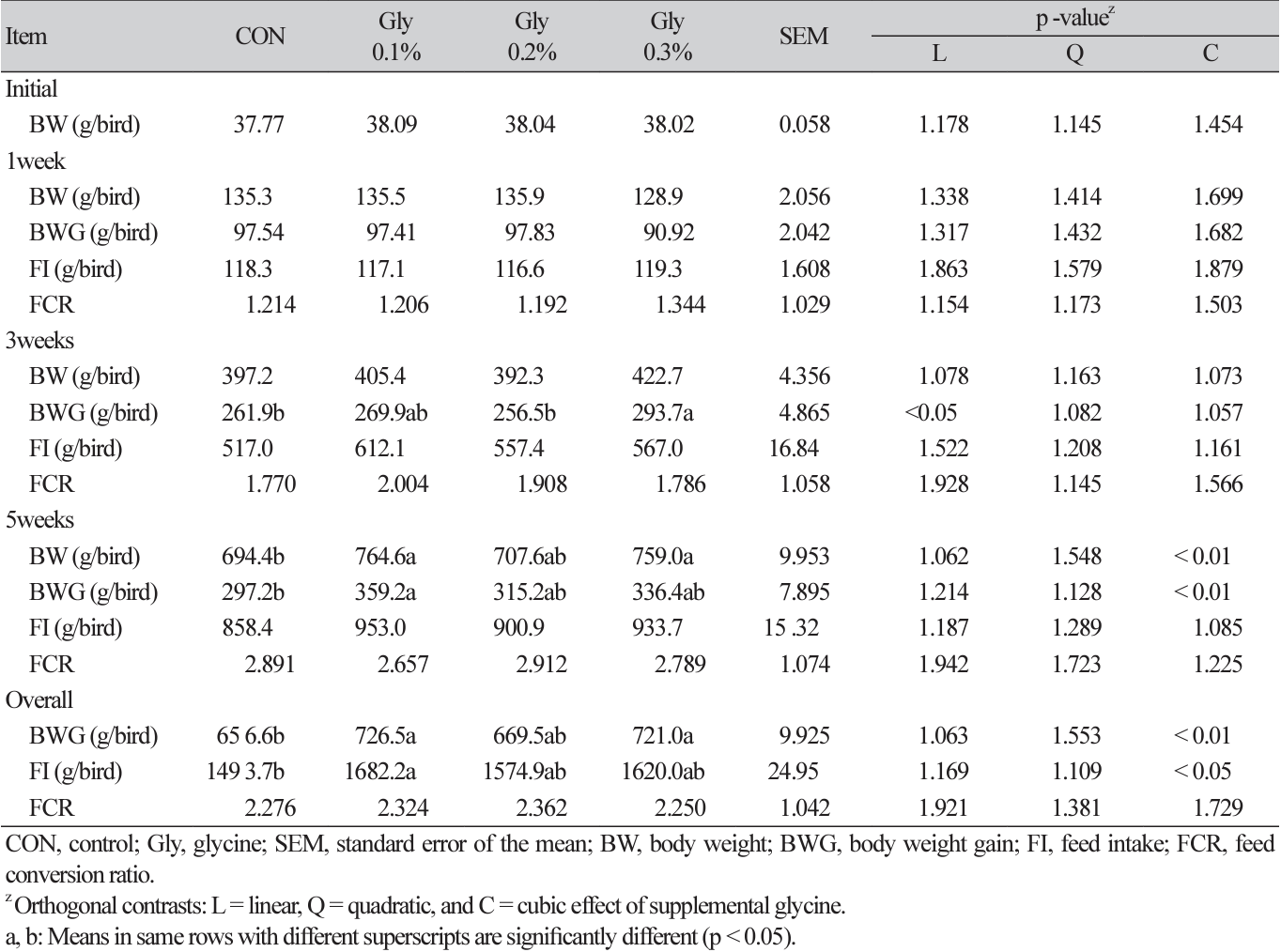
Table 2
Effect of dietary glycine supplementation levels on the meat quality of broilers under high temperature.
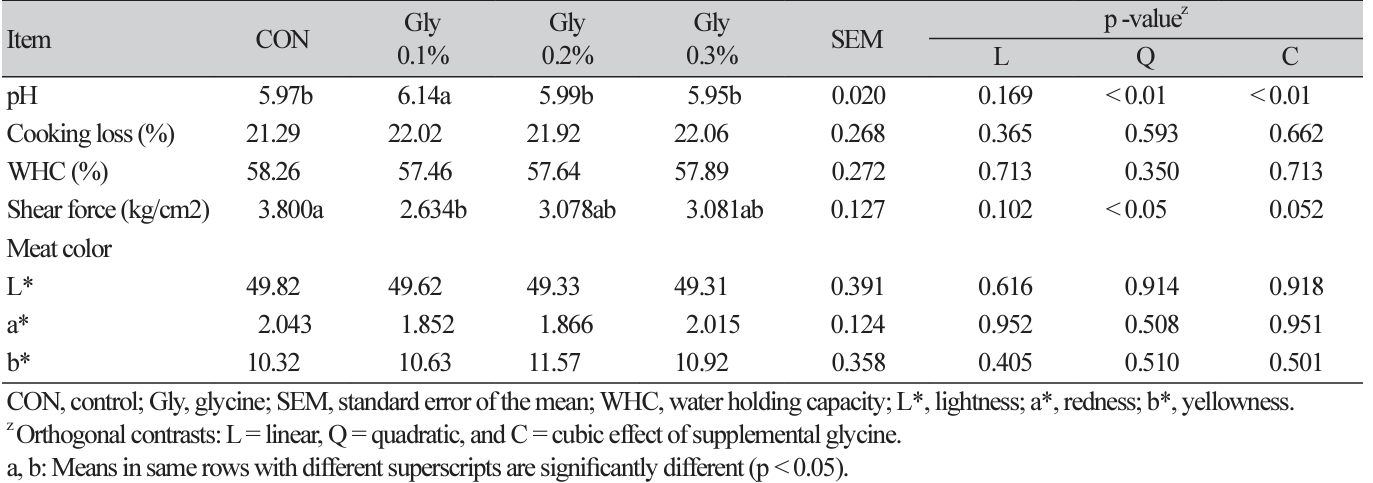
소비자의 구매결정과 선호도에 영향을 주는 특성으로 사료 내 첨가 물질에 영향을 받을 수 있다(Lee et al., 2022). 스트레스를 받으면 계육 내 젖산의 축적이 높아져 pH가 낮아지며, 이는 myosin 등의 단백질을 변성시켜 보수력이 감소하고 육색의 L*값이 증가해 PSE육 (pale, soft, exudative) 특성을 보인다(Hu et al., 2016; de Freitas Dionizio et al., 2021). 단백질의 기본 구성 요소인 아미노산의 산화 안정성 및 항스트레스의 효과가 보고되고 있다(Sifa et al., 2018). 육계의 사료 내 테아닌(theanine) 첨가는 계육 내 SOD (superoxide dismutase), GSH-PX (glutathione peroxidase) 등 항산화능 활성을 증가시켰으며, 무첨가 대비 계육의 pH가 증가하고 전단력이 낮아져 육질 개선 효과를 보였다(Saeed et al., 2018; Zhang et al., 2020). 또한, 글루타민(glutamine)을 고온 환경의 육계에 1.0% 첨가 급이하였을 때, 가슴육의 pH와 보수력, 전단력 및 육색이 개선되었다고 보고하였으며(Dai et al., 2009), Meyer와 Bobeck (2023)은 육계의 아르기닌(arginine) 급여가 혈관 확장제 역할을 함으로써 혈류와 산소 공급을 개선해 woody breast 생성 방지 등 계육 품질을 개선하는 것으로 보고하였다. 본 연구에서 Gly 0.1% 첨가는 근육 내 항산화능을 활성화시키고, 육계의 고온스트레스로 인한 계육 품질 저하를 완화시킨 것으로 판단된다.
가슴육 내 항산화 특성
Gly의 사료 내 첨가량에 따른 육계 가슴육의 FRAP, TBARS 및 DPPH 라디칼 소거능에 대한 결과는 Table 3과 같다. DPPH 라디칼 소거능과 TBARS는 사료 내 Gly 첨가량에 따라 유의적인 차이를 보이지 않았다. FRAP의 경우 Gly 0.1% 첨가구에서 가장 높았으나, 첨가량이 증가함에 따라 FRAP 수치는 점차 감소하였다(quadratic, p < 0.01; cubic, p < 0.05). 계육은 일반적으로 지질산화에 의해 품질이 저하되며, 지질 산화는 동물의 방어 시스템에서 산화 촉진제와 항산화제의 불균형에 의해 발생한다(Aslam et al., 2020). 항산화 기능이 있는 사료첨가제의 사용은 축산물의 산화 균형을 향상시킬 수 있는 가장 효과적인 방법으로(Aslam et al., 2020), 최근 여러 연구에서 기능성 사료 첨가제의 항산화력 및 육질 향상 효과가 보고되었다(Zhang et al., 2018; Aslam et al., 2020). Kopec 등(2016)은 칠면조의 사료 내 히스티딘(histidine)을 보충한 결과, 가슴육의 DPPH 라디칼 소거능이 증가되었으며, Zhang 등(2020)은 L-theanine의 첨가가 계육의 MDA와 PC (protein carbonyl)를 감소시켜 산화적 손상이 낮았음을 보고하였다. 또한 고온 스트레스를 받은 육계는 낮은 TAC (total antioxidant capacity)를 나타냈으나, 메티오닌(methionine)을 보충한 처리구는 유의적으로 높은 TAC가 확인되었다(de Freitas Dionizio et al., 2021). 이는 methionine이 독성 산화물질을 제거하고 자유 라디칼의 유해한 영향을 완화시키고 분자 및 세포 수준에서 항산화 효과에 기인한 것으로 보고되었다(de Freitas Dionizio et al., 2021). 한편, Gly은 글루타메이트(glutamate) 및 시스테인(cysteine)과 상호작용함으로써 강력한 항산화 분자인 글루타치온(glutathione) 합성에 관여하며 항산화 시스템을 조절한다(Abbasi et al., 2023). 이를 볼 때, 우리의 연구에서도 사료 내 Gly의 추가 첨가가 체내 항산화 작용을 개선하여 계육의 FRAP 수준에 영향을 준 것으로 판단된다.
혈구 조성 및 혈액 생화학 특성
사료 내 Gly 첨가에 따른 혈구 및 혈액 생화학 성분 분석 결과는 각각 Table 4, 5에 나타내었다. 혈구 분석 항목 중, Gly 0.3% 첨가구는 Gly 0.1% 첨가구에 비해 HE (heterophil)와 LY (lymphocyte) 비율이 유의적으로 높았으며(cubic, p < 0.05), 그 외 다른 항목은 모두 비슷하였다. 혈액 내 생화학 성분 분석 결과는 Gly의 첨가에 따른 유의적 차이가 관찰되지 않았다(p > 0.05). 혈액 특성을 분석하는 것은 동물의 건강 상태를 평가할 수 있는 중요한 지표이며, 사육
Table 3
Effect of dietary glycine supplementation levels on the antioxidant capacity in breast meat of broiler under high temperature.
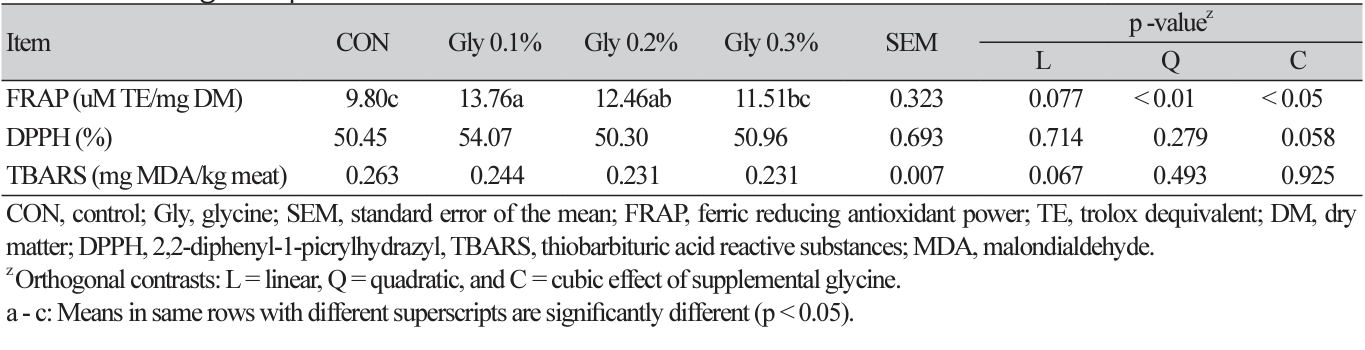
Table 4
Effects of dietary glycine supplementation levels on blood composition of broilers under high temperature.
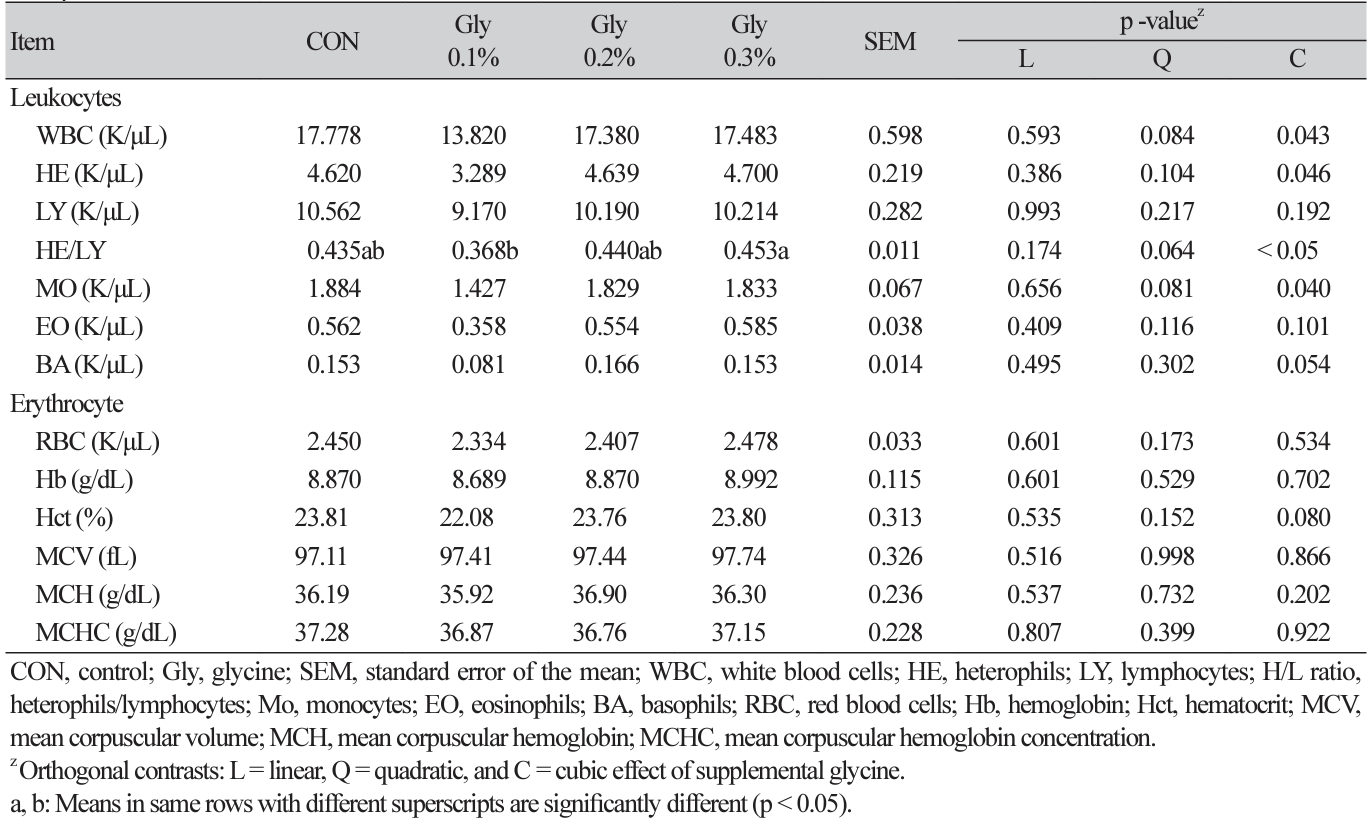
Table 5
Effect of dietary glycine supplementation levels on blood biochemical parameters of broilers under high temperature.
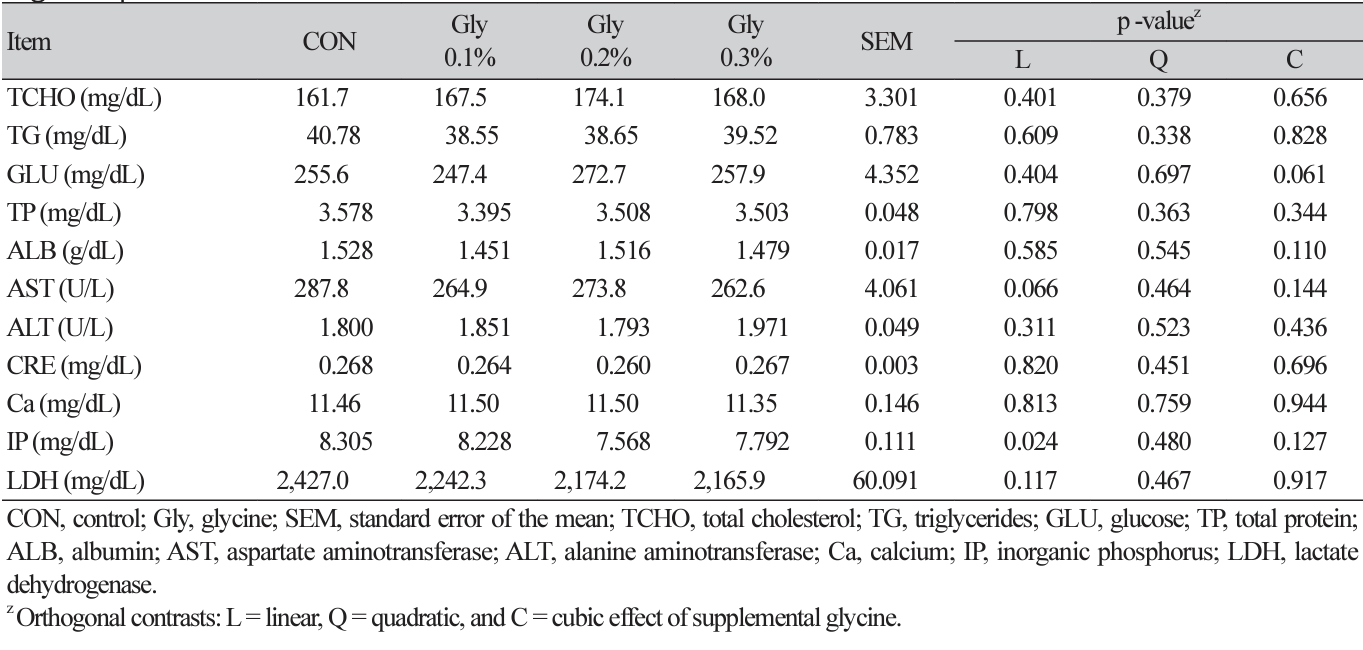
환경이나 사료 내 영양성분에 따라 영향을 받는 것으로 알려져 있다(Lee et al., 2022; Son et al., 2022). 보고에 따르면, glutathione의 전구체인 Gly의 첨가는 혈장 내 WBC (white blood cells), lysozyme을 개선시키며 RBC (red blood cells)의 산화스트레스를 예방하고 높은 RBC와 용혈 저항성에 도움을 줄 수 있다(Abbasi et al., 2023). 또한 가금에서의 HE/LY 비율은 스트레스 요인에 의해 영향을 받는 지표로, 사료를 제한하는 등의 스트레스 환경에 비율이 증가한다(Mahboub et al., 2004; Won et al., 2023). Won 등(2023)의 연구에서 Gly의 식이 보충은 혈중 HE/LY 비율을 낮췄으며, 이는 Gly이 체온 조절 기능이 있는 베타인(betaine)의 대사와 밀접한 관련이 있어 스트레스 완화에 긍정적인 효과가 나타난 것으로 보고하였다. 본 연구에서도 Gly 0.1% 첨가가 HE/LY 비율을 낮추었으며, 이는 Gly이 육계의 고온 스트레스 완화에 도움이 되는 것으로 보여진다.
한편, Gly은 체내 UA 및 CRE의 배설을 증가시킴으로써 혈중 내 UA, CRE 수준을 낮추는 것으로 알려져 있다(Oshima et al., 2019). 이러한 이유로 Gly은 UA 배출 불균형에 의해 생기는 고요산혈증, 통풍을 치료하기 위해 널리 사용되고 있다(Oshima et al., 2019). Shafiekhani 등(2019)의 연구에서 납에 노출시킨 쥐에게 Gly을 첨가하였을 때 혈청 내 BUN (blood urea nitrogen)과 CRE 수준을 감소시켰으며, 당뇨병 처리가 된 mice의 경우 다른 분석 지표에는 차이가 없었으나 UA와 CRE 수치가 유의하게 낮아졌다(Wang et al., 2019). 반면, Gly의 첨가는 산란계 혈중 내 높은 TG와 낮은 LDL (low-density lipoprotein) 수준을 보였으나 ALT, TP, ALB, TCHO에 영향을 주지 않았다(El-Atty et al., 2020). 고온 환경의 육계 사료에서도 betaine과 Gly을 첨가하였을 때 AST 수준은 낮아졌으나 ALT, CRE 및 UA에는 어떠한 영향을 주지 않았다(Won et al., 2023). 또한, 혈장 내 glucose 수준은 스트레스를 받을 때, 주로 간의 글리코겐 분해로 인해 증가한다고 보고되고 있다(Yu et al., 2022). 하지만, 본 연구에서 생화학 분석 지표에 대한 Gly의 첨가 효과를 관찰하지 못하였으며, 이에 가금에 있어서 Gly의 UA 배출 및 다른 지표의 영향에 대한 추가 연구가 요구된다.
혈액 내 corticosterone 수준
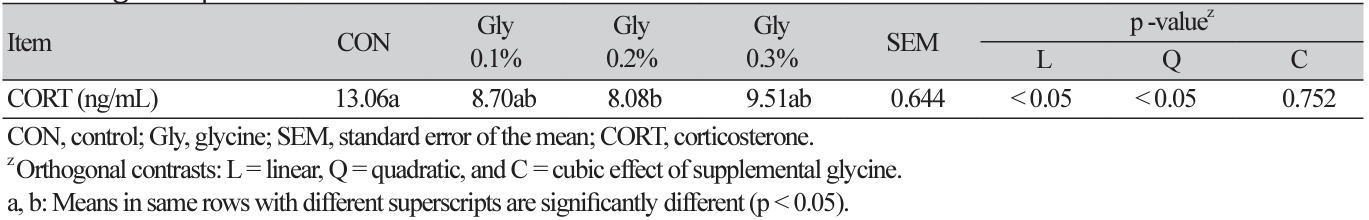
육계 사료 내 Gly의 첨가 수준에 따른 스트레스 반응 지표 corticosterone의 차이는 Table 6에 나타내었다. 사료 내 Gly의 첨가 수준이 증가함에 따라 혈액 내 corticosterone은 직선적으로 감소하는 경향이 나타났으며, Gly 0.2% 처리구가 무첨가구에 비해 유의적으로 낮은 수치를 보였다(linear, p < 0.05; quadratic, p < 0.05). 혈액 corticosterone 지표 분석은 동물의 복지를 평가할 수 있는 방법 중 하나이며, 높은 corticosterone 농도는 고온 스트레스 환경과 연관이 있다(Son et al., 2022). 이에 생균제, 약용식물 및 추출물 등 첨가제에 대한 corticosterone 감소 효과가 보고되고 있으나 아미노산 첨가에 대한 연구는 부족한 상황이다. Hwangbo 등(2013)은 methionine과 라이신(lysine)을 첨가하였을 때 고온 환경의 육계 corticosterone 수치를 낮추었으며, tryptophan의 첨가 또한 유의적인 감소 효과를 보였다(Badakhshan et al., 2021). 반면, Magnuson 등(2020)은 methionine의 첨가가 고밀도 환경에 노출된 육계의 혈액 내 corticosterone 수준에 영향을 주지 않았으며, Won 등(2023)의 연구에서도 Gly의 첨가에 따라 모든 처리구가 비슷한 수준을 보였다. 우리의 연구에서는 Gly의 첨가가 고온 환경의 육계 corticosterone을 낮추며 스트레스 완화 효과를 보였다.
공장의 형태학적 특성
Gly 첨가 수준이 육계의 공장 융모에 미치는 영향은 Table 7에 나타내었다. 사료 내 Gly 수준에 따른 융모의 높이는 차이가 없었으나, 음와 깊이에 영향을 미쳤으며(cubic, p < 0.01), Gly 0.2%에서 가장 낮게 나타났다. 장의 형태학적 특성은 장 건강을 나타내는 지표로(Mustafa et al., 2021), 고온스트레스에 노출되면 장 세포에 산화스트레스를
Table 6
Effect of dietary glycine supplementation levels on the content of corticosterone in blood of broilers under high temperature.
유발해 점막 상피세포 손상, 융모 위축, 장 점막 손상 등 장 건강 발달에 부정적 영향을 미치는 것으로 알려져 있다(Mazzoni et al., 2022). 이는 장관벽 파괴로 인해 병원체 등의 투과성을 높이며, 소화능력 저하 등을 야기한다(Santos et al., 2015; Mazzoni et al., 2022). 최근 여러 연구는 스트레스 조건에서 사료 내 아미노산의 첨가가 장 형태 및 기능에 긍정적인 영향을 주는 것으로 보고되었다(Valizadeh et al., 2014; Xue et al., 2018; Zhang et al., 2018; Oxford and Selvaraj, 2019). 크레아틴(creatine)의 전구물질인 아르기닌(arginine)은 콕시듐증이 유발된 육계의 장 융모 및 배상 세포(goblet cell) 손상을 완화하고 장 형태를 개선하는 것으로 보고되었으며(Zhang et al., 2018), 트레오닌(threonine)은 살모넬라증의 육계 장 건강을 유지하였다(Valizadeh et al., 2014). Xue 등(2018)과 Oxford와 Selvaraj (2019)은 glutamine을 첨가하였을 때, 육계의 융모 및 음와 길이가 개선되면서 생산성이 향상된 것을 확인하였다. 또한 LPS (lipopolysaccharide) 처리된 돼지에 Gly을 첨가하였을 때, 공장의 음와 깊이가 감소한 것은 우리의 연구 결과와 일치하였다(Xu et al., 2018). Gly의 첨가는 고온 환경 내 육계의 장 건강에 긍정적인 영향을 주었으나 적정 첨가량과 작용 메커니즘에 대해 추가 연구가 필요하다.
깔짚 내 수분함량
고온 환경에서 육계 사료 내 Gly 첨가량에 따른 깔짚 수분 함량은 Table 8에 나타내었다. Gly의 첨가 수준은 깔짚 내 수분 함량에 영향을 주지 않았다. 깔짚의 품질을 조사하는 것은 육계 사육 복지 평가에 있어서 중요한 지표이다(Bessei, 2006). 젖은 깔짚은 발바닥 피부염(footpad dermatitis, FPD), 무릎 화상(hock burn) 등을 일으키는 주요 원인이 되며, Campylobacter 감염과 양의 상관관계가 있다(Hu et al., 2022). 통증이 발생하면 상처가 치유될 때까지 움직임이 제한되고 사료 및 수분 섭취의 감소로 증체량, 사료효율 및 계군의 생산성에 부정적 영향을 준다(Koshchaev et al., 2020). 또한, 육계는 체중이 증가함에 따라 깔짚과 피부가 접촉하는 면적이 넓어지며, 이에 젖은 깔짚에 장기간 노출되면 유방 물집(breast blisters)과 같은 피부 질환을 일으킨다(Bessei, 2006). 한편, 가금의 사료 조성 및 사료 첨가제의 사용은 깔짚 품질에 영향을 주는 중요한 요소임이 보고되었다(Swiatkiewicz et al., 2017). 그 중 Hussein등 (2023)의 연구에서 복합 아미노산(threonine, arginine 및 glutamine) 첨가구에서 깔짚의 수분함량을 유의적으로 낮았으며, Ospina-Rojas 등(2014)도 methionine, lysine, threonine, 발린(valine), 및 Gly의 보충에 의해 육계의 깔짚 내 질소, 암모니아 배출이 감소하는 것을 보고하였다. 하지만, methionine과 lysine의 첨가는 깔짚의 품질과 발바닥 피부염 저감에 영향을 주지 않았다(El-Wahab et al., 2015). 본 연구에서도 Gly의 첨가량에 따라 깔짚 품질에는 영향이 없었다.
Conclusion
본 연구는 고온 환경 내 육계의 사료에 Gly의 첨가 수준을 달리하여 생산성, 계육 특성, 혈액 성상, 스트레스 지표, 장 특성 및 깔짚 품질에 대해 조사하였다. 1일령 육계(Ross 308) 수평아리 760 수를 공시하였으며, 처리구는 무첨가구(CON)와 Gly 0.1, 0.2, 0.3%로 총 4처리구(처리 당 5 반복, 반복 당 38 수)로 설계하였다. 1일령부터 21일령까지 사육환경은 육계 사육 기준에 준하여 유지하였으며, 22일령부터 실험 종료시까지 고온 환경(32 ± 1℃, 60 ± 5%)을 제공하였다. 시험기간동안 Gly의 첨가에 따라 증체량은 증가하였으며, 고온 환경에서도 Gly 0.1% 및 0.3% 처리구에서 높은 체중을 보였다(p < 0.05). Gly 0.1%의 첨가는 계육의 높은 pH와 FRAP의 수준을 나타내었으며(p < 0.05), 이는 계육의 항산화 활성에 긍정적인 영향을 주는 것으로 나타났다. 또한, 혈구 조성에서는 Gly 0.1% 첨가구가 HE/ LY 비율이 낮게 나타났으며(p < 0.05), 혈청 corticosterone은 Gly 0.2% 처리구에서 가장 낮게 나타났다(p < 0.05). 공장의 특성은 Gly 0.2% 첨가구에서 음와 깊이가 개선되는 효과를 보였으며(p < 0.05), 깔짚 수분 함량을 보았을 때 사육환경 개선 효과는 없는 것으로 판단되었다. 결론적으로, 사료 내 Gly의 첨가는 육계의 생산성과 계육 품질, 항산화능 개선 및 스트레스 수준 완화 효과가 있었으나, 적정 첨가 수준과 체내 작용 메커니즘에 대한 추가 연구가 필요하다.
Acknowledgements
본 연구는 2023년 농촌진흥청 국립축산과학원 전문연구원 과정 지원사업과 농촌진흥청의 공동연구사업(과제번호: PJ01502303)에 의해 이루어진 것으로 이에 감사드립니다
Authors Information
Jiseon Son, https://orcid.org/0000-0002-5285-8186
Hee-Jin Kim, https://orcid.org/0000-0002-6959-9790
Hwan-Ku Kang, https://orcid.org/0000-0002-4286-3141
Eui-Chul Hong, https://orcid.org/0000-0003-1982-2023
+Hyunsoo Kim, https://orcid.org/0000-0001-8887-1318
Woo-Do Lee, https://orcid.org/0000-0003-4861-4637
Yeon Seo Yun, National Institute of Animal Science, RDA, Researcher