Introduction
최근 농업은 세계 인구 증가와 기후 환경 변화에 따른 미래 식량 부족에 대응하기 위한 농축산물의 양적 증가와 함께 안정성 및 국제 경쟁력 확보를 위한 질적인 향상에 박차를 가하고 있다. 특히 우리나라의 국민소득 증대에 따라 곡물의 소비는 둔화되고, 육류의 소비가 급증하였는데, 이러한 식생활의 변화는 더욱더 가속화 될 것으로 생각된다. 이에 따라 우리나라 축산업은 축산의 생산성을 향상시키기 위해 출하시기를 단축하고, 사료효율을 증가시키기 위한 연구를 중점으로 육종 및 영양생리 전반에 관련된 연구를 진행해 왔다(Cho et al., 2004). 특히, 양돈의 경우 생산성을 향상시키기 위해 위축돈 관리에 대한 중요성을 강조하고, 올바른 자돈 관리를 통해 이유체중을 늘리고, 이유 후 증체효율을 높여서 출하시기를 당기기 위한 돼지의 사양관리 기술의 향상을 위한 연구가 수행되어왔다.
최근에는 구조 유전체학(structural genomic)의 단계를 지나 기능 유전체학(functional genomics)의 단계로 접어들면서 생명체를 구성하고 있는 수많은 유전자들의 기능을 이해하고 유전체내에 잠재되어 있는 유전정보의 능동적 활용을 통한 생산성의 증대가 더욱 강조되고 있다(Rajender et al., 2011). 이러한 상황에서 현재의 유전자 연구는 관련유전자의 발굴뿐만 아니라 유전자의 작용기전을 밝히는 한 자원 높은 방향으로 나아가고 있으며, 국내양돈 연구도 이에 발맞추어 나아가야 할 것이다. 따라서 태아시기에 접하는 다양한 자극에 의한 성장과 발달이 생후 돼지의 사양성적에 미치는 영향에 대한 더 많은 연구가 필요할 것으로 생각된다. 따라서, 임신돈 또는 신생자돈 시기에 대사적인 처리가 돼지의 성장과 발달에 미치는 영향을 살펴보고자 한다.
Results and Discussion
대사적 각인
‘대사적 각인(metabolic imprinting)’이란 어린 시기 또는 아주 예민한 시기에 받은 영양·생리적인 자극이 형질을 변화하고 그 영향이 오랜 기간 지속되는 현상을 말한다(Davies and Norman 2002). 돼지에서는, 대사적 각인에 의한 자궁 내 태아의 성장 및 발달이 임신 유지를 위한 모돈의 구조·대사적인 지원에 따라 매우 세밀하게 변화되는데, 이러한 과정들은 매우 복잡하고 섬세하게 이루어져 그 영향이 성돈에까지 미치게 되는 것이다. 좋은 예로 사람의 태아가 모체로부터 충분한 영양을 공급받지 못하면 생후 성장과 발달에 큰 악영향을 받는다는 연구 결과가 있다(Barker and Clark 1997). 이 역학 조사 연구에서는 태아시기 성장과 발달이 잘 되지 않으면 성인시기에 심장질환 또는 제2형 당뇨에 걸릴 확률이 더 높은 것으로 나타났다.
위축돈의 생산
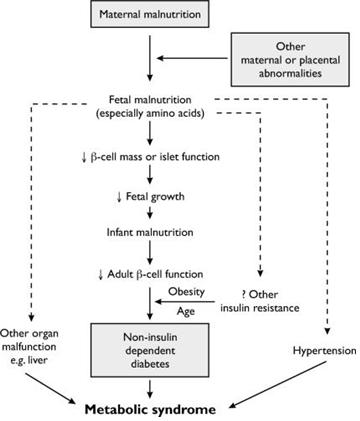
모체가 섭취하는 영양은 자궁 내 태아에 공급되어, 태아가 발달하는데 큰 역할을 하게 된다. 수정란의 세포 분열과 태아 발달이 잘 이루어지기 위해서는 균형 있는 아미노산, 지방산 및 탄수화물의 섭취가 중요한데, 임신기간과 포유기간에 태아가 모체에서 충분한 영양을 공급받지 못하면 한정된 영양분을 효율적으로 활용하기 위해 생존에 필수적인 기관 발달에 집중하도록 대사기전이 변화되고, 자궁 내 성장제한(intrauterine growth restriction, IUGR)에 의해 결과적으로 돼지에서는 위축돈이라 불리는 절약형질(thrifty phenotype)이 태어나게 된다. 이러한 가설에서는 성인기 대사성 질환은 태아기의 영양결핍의 결과로 보고 있으며 이에 대한 자세한 설명은 Fig. 1에 나타나있다(Hales and Barker 2001). 위축돈은 낮은 생존율과 출생 후 생산성 저하 때문에 양돈 산업에서 큰 경제적 손실을 야기하고 있다. 이러한 손실은 성장 저해, 사료 섭취량 감소, 낮은 사료 요구율, 낮은 육량 등 근육 섬유의 수적 감소와 관련된다(Oksbjerg, 2013).
태아시기의 영양결핍은 당과 인슐린 대사에 치명적인 손상을 입힌다. 따라서, 생후 비만과 당뇨를 유발할 수 있고, 어린 시기 신경계의 발달이나 면역 체계에도 악영향을 받을 수 있다(Levin 2006). 이 시기에 체중 및 내분비계 등이 영향을 받고, 자궁 내 영양 상태에 따른 칼슘, 엽산, 마그네슘, 단백질 및 아연 등의 함량 변화는 성장 후 여러 질병과도 밀접한 관계가 있다. 또한 어린 시기 영양과 생후 혈압에 대한 연구결과에서도 이러한 대사적 각인의 증거들을 접할 수 있는데, 모돈의 사료 내 단백질 수준에 따른 자돈의 사료 요구율이 변화된다. 임신돈의 사료 내 단백질 수준이 낮을 때 평균 수준의 단백질을 급이한 경우 보다 자돈의 사료 요구율이 증가됨이 밝혀졌다(Nissen, 2011). 이러한 각인의 효과는 그 정도보다는 어느 시기에 받느냐에 따라 더 커진다고 알려져 있다. 하지만 이 경우에도 오랜 시간이 지나면 형질변화에 대한 효과는 크게 줄어든다고 한다.
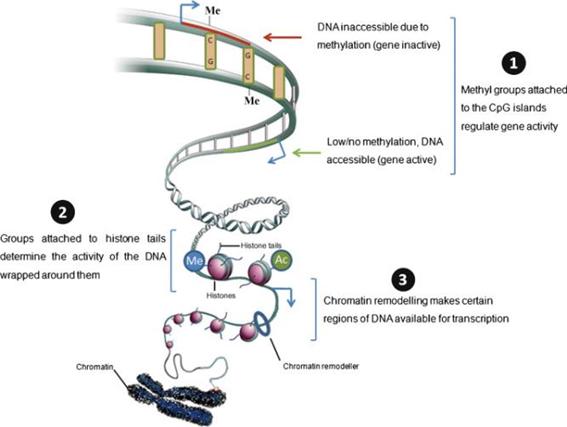
낮은 수준의 영양 사료에 대한 적응은 많이 연구되어왔는데, 영양결핍이 발생되면 손실을 최소화하기 위해 흡수율 및 이용률을 높이게 된다. 식품 영양회에서 미국 성인을 대상으로 한 연구 결과에 따르면 성인 하루 칼슘허용치를 800 ㎎으로 책정했지만, 칼슘이 결핍된 식생활을 하는 페루 인은 칼슘 항상성을 유지하기 위한 하루 칼슘 요구량이 100-200 ㎎ 에 지나지 않았다(Hegsted et al. 1952). 이처럼, 대사적 각인을 유발하는 것은 세포 내 유전자 및 대사인자들과 상호작용을 하는 영양소들이며, 이들은 성장 및 유전자 발현의 패턴을 변화 시킨다. 또한 위축돈은 정상체중의 자돈과 비교하였을 때, 단백질 합성과 분해에 관여하는 단백질이 하향 조절 되는 것으로 확인 되었다(Oksbjerg, 2013). 이러한 환경 또는 사료 내 영양소가 전사(transcription), 번역(translation)및 단백질 발현에 미치는 영향을 분석하기 위해서는 유전형질분석(genotyping), 전사체학(transcriptomics), 단백질체학(proteomics), 대사체학(metabolomics), 생물정보학(bioinformatics) 등을 포함하는 systems wide level의 정보가 필요한데, 이러한 연구를 ‘영양유전체학(nutrigenomics)’이라 한다. 영양대사의 총체적 해석을 위해서는 전통영양학을 중심으로, 다양한 학문의 유기적인 협력연구가 필수적이다. 이러한 환경·영양적 처리에 의한 대사형질의 변화가 일어나는 것은 DNA의 구조적 변화로 인한 것이 아니라 DNA methylation, histone modification 및 non-coding RNA 등의 기전에 의한 후성유전체학(epigenetics)에 기인하는 것으로 설명된다(Fig. 2; Rajender et al., 2011).
DNA 염기 서열은 환경이나 영양성분에 의해 바뀌지 않기 때문에 유전자 발현이나 표현형의 변화는 유전정보의 발현에 있어서 후성유전체학(epigenetics)에 의한 것으로 사료된다. DNA 메틸화(DNA methylation)는 4종류의 염기(아데닌, 시토신, 구아닌 및 티민) 가운데 시토신 염기의 5번째 탄소에 메틸기가 결합하여 발생되는데, 대부분의 메틸화는 시토신과 구아닌의 비율이 높은 CpG island에서 많이 일어난다. DNA 메틸화(DNA methylation)은 염기가닥이 응축되어 전사가 일어나지 않는 이질염색질(heterochromatin)의 형성과 X염색체의 비활성화 및 유전자의 각인과 같이 특정 유전자의 발현은 억제하는 역할을 하는 것으로 알려져 있다. 그 좋은 예가 Agouti mice인데, 근친교배를 통해 동일한 유전자형을 가지고 있는 Agouti mouse 자손은 표현형이 동일할 것으로 예상되었으나, 모색 및 체중이 달랐으며 대사성 질병에 대한 저항성도 다르게 나타났다(Yen et al., 1994). Agouti 유전자 프로모터 부위에 methylation이 많이 발생하여 Agouti 유전자 발현이 저해된 쥐들은 갈색 모에 정상체중을 보이고, 질병에 대한 저항성은 크지만 methylation 정도가 낮은 노란색 쥐들은 과체중 및 당뇨 등의 대사성 질병에 잘 걸리는 형질을 보였다. 2 미터가 넘는 DNA는 염색질의 기본단위인 뉴클레오좀으로 응축되는데, 이 뉴클레오좀은 H2A, H2B, H3, 및 H4 히스톤 단백질 이량체가 결합하여 core particle을 형성하고, 그 주위를 DNA가 감고 있다. 뉴클레오좀은 히스톤 단백질 말단부에 변형이 일어나는데, 아세틸화, 리신 및 아르기닌의 메틸화, 유비퀴틴화, 인산화, 수모화, ADP-리보실화(ADP ribosylation), 탈 아미노화 및 프롤린 이성체(proline isomerization) 등이 그에 해당된다. 이러한 크로마틴의 변형은 유전자발현조절, 세포증식, DNA 복제 및 염색체 응축 등에 있어 매우 중요한 역할을 하는데, 이 크로마틴 변형이 정상적으로 이루어지지 않으면 암을 포함한 여러 질병이 유발되는 것이다. 후성유전체학(epigenetics)의 또 다른 기전은 non-coding RNA (ncRNA)에 의해 이루어진다.
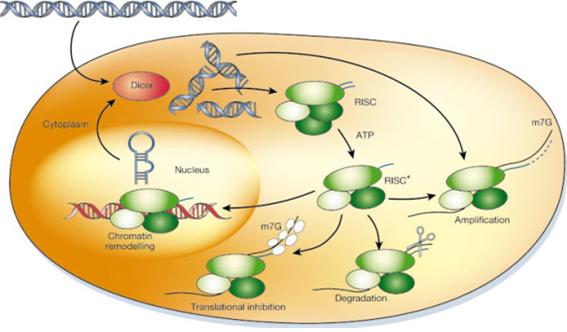
전사된 RNA 중에서 단백질로 translation 되지 않는 transfer RNA (tRNA), ribosomal RNA (rRNA), micro RNA (miRNA), 및 short-interfering RNA (siRNA) 등을 non-coding RNA (ncRNA)라 하는데, 이들이 유전자의 발현에 영향을 미친다. miRNA는 약 20여개의 염기로 이루어지는데, 일반적으로 target 유전자의 mRNA 3’ UTR 부위에 결합하여 mRNA를 파괴하거나 translation을 억제한다(Phillips, 2008). 먼저 두 가닥으로 이루어진 RNA interfering (RNAi)가 세포로 들어가면 Dicer가 인식을 하여 RISC (RNA-induced silencing complex)로 하여금 두 RNA 가닥을 풀고, chromatin remodeling이나 translation inhibition 등의 작용을 통해 유전자 발현을 조절하게 된다(Fig. 3; Hannon, 2002). 이러한 ncRNA는 세포증식, 혈액생성, 당과 인슐린 대사, 및 면역반응 등에 영향을 준다. Epigenetics는 유전체 연구에 비해 그 역사가 짧지만, 발달된 생명공학 기술을 통해 현재 비약적인 발전을 하고 있고, 더 나아가 동물의 대사와 성장에 관련된 연구도 활발히 이루어 져야 하겠다.
앞서 언급한 자궁 내 성장지연(intrauterine growth retardation, IUGR) 현상은 임신여성이 필요한 영양소의 약 50% 미만을 섭취할 경우 발생하는데, 주로 미개발 국가의 저소득층 또는 사료자원이 매우 부족한 나라의 가축들에서 보고되었다. 따라서, 이미 영양적 균형이 정착된 우리나라의 양돈 급여시스템에서는 IUGR에 의한 성장지연이 불가능하다. 하지만 유전적 선발에 의한 자돈 수의 증가는 자궁 내에서 한 마리의 자돈이 차지할 수 있는 공간뿐만 아니라 공급되는 영양분까지 감소하게 된다. 이러한 요인으로 인해 현재에도 미성숙 자돈의 숫자가 줄어들지 않고 있는 것으로 생각된다. 자궁 내 성장지연에 대한 과학적인 고찰과 정확한 메커니즘의 이해가 미성숙 자돈의 발생 저하와 더불어 돼지의 생산성을 향상시킬 수 있을 것이다.
돼지에서 발생하는 자궁 내 성장지연은 자돈의 생시 체중을 감소시키고 생존율 또한 줄어들게 하는 요인으로 지목되고 있다(Milligan et al. 2002). 뿐만 아니라, 자돈의 감소된 생시 체중은 출하 시 까지 낮은 일당증체량을 보이고 결과적으로 정상체중의 자돈보다 낮은 도체중을 보인다(Nissen, 2011). 이러한 결과들은 어린 시기, 특히 자궁 내 태아시기가 생후 성장 및 발달에 큰 영향을 미치며 어미로부터 공급받는 영양의 질과 양에 따라 오랜 기간 영양대사 및 표현형이 좌우된다는 것을 시사해준다. 어미의 자궁 내 환경에 따라 자돈의 여러 조직의 성장과 발달이 영향을 받는데, 특히 근육 내 근섬유의 성장에서 자돈의 생시 체중에 따라 근섬유의 숫자가 변화되는 것이 밝혀졌다(Park, 2015). 임신돈에 단백질의 초과급여와 제한급여 시 자돈의 생시체중이 감소하고, 제한급여 모돈에서 생산된 자돈은 적정 단백질 수준의 자돈과 비교하여 근 섬유(primary , secondary fiber) 수가 유의적으로 낮게 나타나는 것으로 확인되었다(Rehfeldt, 2012). 일반적으로, 생후 근육의 성장은 근섬유의 크기성장에 의존한다. 그 이유는 근섬유의 숫자는 태어나면서 이미 결정되어져 있기 때문인데, 근육의 숫자를 늘리기 위해서는 근육 내 줄기세포(muscle satellite cells)의 성장과 분화가 활성화 되어야 한다. 근육줄기세포의 활성과 분화는 근육이 상처를 입는 등의 특별한 경우에 발생하며 정확한 메커니즘은 아직 구명되지 않고 있다(Allen and Rankin 1990). 지방조직의 발달 또한 어미로부터 영향을 받는데, 임신말기 20일 동안 임신돈에게 사료를 급여하지 않았을 경우 자돈 내 지방함량이 줄어들었다. 자돈의 뼈 성장 또한 임신기간의 영양 상태에 따라 영향을 받는데, 이 효과는 장기간 지속된다. 필수아미노산인 류신의 합성에 필요한 물질인 β-hydroxy-β-methylbutyrate (HMB)를 임신돈에 2주간 급여한 결과, 자돈의 체중이 증가하고 출하시기 또한 유의적으로 단축되었다. 또한 HMB를 급여한 모돈에서 태어난 자돈의 뼈 밀도와 강도가 그렇지 않은 자돈에 비해 유의적으로 높게 나타났다(Flummer et al., 2012)..
태아성장이 느려지는 원인 중 하나는 자궁의 유전적인 능력이 충분치 않은데 있다(Wu et al., 2006). 자궁의 능력이 좋지 않은 모돈에게 수정된 배반포를 이식했을 때, 자돈의 생체중은 급격히 줄어드는 것으로 나타났다(Allen et al., 2002). 반대로, 자궁 능력이 큰 모돈에 배반포를 이식했을 때에는 태아의 성장이 향상되는 결과를 보였다. 이 결과는 자궁의 크기와 영양소 전달 및 성장인자(growth factor) 분비 능력이 태아의 성장에 있어 가장 중요한 제한요소라는 것을 증명하는 것이다. 그 예로, 중국의 매산돈의 경우, 유럽이나 북미의 품종에 비해 크기가 작지만, 자궁의 능력이 좋아 더 적은 공간과 영양분으로도 태아에게 유리한 자궁 환경을 제공할 수 있어서 많은 수의 자돈을 생산한다고 한다. 자돈의 숫자와 체중을 증가시키기 위해 자궁의 능력이 좋은 모돈을 유전적으로 선발하고 개량하려는 노력이 계속되고 있지만, 실제로 가축생산과 번식에 관여하는 유전력은 후대에 전해지는 확률이 낮아 많은 노력과 시간이 소요되고 있다.
태아의 성장 및 발달은 전적으로 태반을 통해 전달되는 모돈의 영양성분에 따라 영향을 받게 된다. 임신초기에는 그 영향이 다소 적지만, 후반기에는 자돈의 영양소 요구량이 증가하기 때문에 그 영향이 극대화된다. 임신기간 동안 자궁 내 혈액순환이 증가하는 것도 이러한 이유 때문이며, 혈액순환속도나 그 양은 자돈 수에 따라 영향을 받는다고 한다. 혈관의 수축과 관련된 성분으로는 일산화질소(nitric oxide)가 있으며, 이는 태반과 태아의 발달에 큰 역할을 하는 것으로 알려져 있다(Wu et al., 2006). 일산화질소는 혈관의 이완을 유도하는데, 이는 모체에서 태아로 전달되는 영양소 및 산소의 양에 큰 영향을 미친다. 실제 이 성분들은 자궁 내 혈관의 발달을 향상시키는 것으로 알려져 있다. 폴리아민(Polyamine)은 DNA와 단백질을 조절하는 인자로서, 세포의 성장과 분화를 조절한다. 아르기닌(Arginine)은 일산화질소와 폴리아민의 전구체이며, 돼지의 요막액 안에서 높은 농도로 존재한다. 임신 30일부터 분만일 까지 높은 수준의 아르기닌을 임신돈에 급여한 결과, 총 자돈의 수에는 차이가 없었으나, 생존자돈 수는 2두 증가하였다(Mateo et al., 2007). 생존 자돈의 체중 역시 아르기닌급여에 의해 증가 하였다. 이 연구에 사용된 모돈의 개체수가 충분하지 않았고, 재현가능한지에 대한 의문이 있지만, arginine 급여가 자돈의 성장과 발달에 미치는 영향과 그 메커니즘을 구명할 필요가 있다. 향후 연구를 통하여 arginine의 급여와 자돈 성적 향상과의 관계가 구명된다면, 양돈 산업에 매우 큰 도움이 될 것이라 생각된다.
많은 연구들이 영양적으로 제한되었을 경우 태반이나 자돈의 성장에 어떤 영향을 미치는 가에 집중 되어 왔는데, 몇몇 연구에서는 더 많은 영양을 급여했을 경우 자돈 수와 생체중이 어떻게 향상되는가를 분석하였다. 특히 이러한 연구들은 실제 임신기간 동안 자돈이 어미로부터 충분한 영양 또는 특정 성분을 받을 경우 자돈의 생체중 변화와 성장하면서 이루어지는 표현형이 이러한 대사적 각인으로 인해 어떻게 영향을 받는지에 대한 분석을 한 것이다. 이러한 연구들의 목적은 위축돈을 최소화하고 생체중을 증가시켜 출하기간을 단축하고 생산성을 향상시키는 데에 있다. 앞서 언급한 arginine 연구가 바로 이러한 연구에 해당되며, 그 외에도 당, 지방, 비타민 및 여러 미네랄을 이용하여 자돈의 성장을 향상시키려는 노력들이 있다. 당은 태아가 이용하는 가장 중요한 에너지 원이다(Pere, 1995). 임신 말기에서 태아의 당 요구량이 매우 증가하기 때문에, 인간을 비롯한 여러 동물에서 임신당뇨의 증상이 관찰되고 있다. 이로 인해 어미의 조직이나 체내 지방산들이 당으로 전환되어 이용되는데, 실제 임신말기 모돈의 인슐린 민감성이 상당히 떨어지는 것으로 나타났다. 구리, 아연, 망간 및 셀레늄 등의 미네랄이나 비타민 또한 임신돈의 영양대사에 큰 영향을 준다. 이들은 수정란 및 태아의 생존과 성장에 없어서는 안 되는 요소들이며, 특히 아연, 동 및 망간은 다른 조직에 비해 태아에 가장 많이 축적되는 것으로 알려져 있으며, 이는 태아의 성장과 발달에 이러한 미량영양소들이 매우 중요하다는 것을 의미한다(Hostetler et al., 2003). 실제로 아연과 구리를 임신돈에게 급여 했을 때, 자돈 수와 체중이 향상되는 결과를 얻었다(Hostetler et al., 2003). 이러한 미량영양소들의 어미와 태아간 실제 이동 메커니즘은 아직 밝혀지지 않았지만, 태아의 막 수용체에 의한 능동수송에 의해 이뤄질 것이라는 의견이 분분하다.
임신돈 체내 성장 호르몬은 태아의 성장 및 발달에 큰 영향을 준다. Rehfeldt 와 Kuhn (2006)은 임신초기 임신돈에게 성장호르몬을 투여 한 결과, 자돈의 성장과 발달이 촉진되는 것을 발견하였고, 비록 자돈의 생체중에는 영향이 없었지만 체중 20kg과 출하시기의 등심단면적이 증가하는 결과를 얻었다. 이는 임신초기(20-40일령) 성장호르몬의 투여가 자궁의 발달과 더불어 태아의 성장 및 발달에도 긍정적인 영향을 미친다는 것을 증명하는 결과들이다. 하지만 현재 성장호르몬의 사용에 대한 규제로 인하여 실제 성장호르몬의 투여는 불가능할 것으로 판단된다. 따라서, 사료나 사료첨가제 개발을 통해 돼지 체내 성장호르몬을 자연적으로 증진시킬 수 있는 기술개발이 필요하다. 그 예로, 녹차를 돼지에게 먹였을 때 나타나는 결과를 보면 사료에 녹차 1%와 2%를 섞어 섭취 하였을 때 항생효과가 항생제를 투여했을 때 보다 상승하는 것을 볼 수 있다. 또한 녹차를 섭취하였을 때 나타나는 변화는 crude fat와 crude ash의 저하와 산패도의 저하를 볼 수 있는데, 그 결과를 보아 육질의 개선에 도움이 된다고 볼 수 있다(Sarke et al, 2010). Inserr et al. (2015) 연구에서는 corbo pulp을 돼지에 급여한 결과, 지방산의 조성을 건강에 좋은 쪽으로 개선하고, 항산화 효과 또한 확인하였다.
Conclusion
임신기간 동안 어미를 통한 영양분 흡수는 태아의 성장과 발달에 영향을 미치고, 출생 후에도 그 영향이 지속된다. 자궁에서 충분한 영양을 공급받지 못한 태아는 생체중의 감소와 발달이 지연되고, 이런 영향은 성숙해서까지도 몸속에 각인된다는 사실이 과학적으로 증명되었다. 이러한 점에서, 임신시기 또는 아주 어린 시기 태아에게 충분한 영양을 공급하여 동물에게 이로운 쪽으로 각인이 되도록 유도해야 하는데, 아직까지 효과적인 방법이 제시되지 않았다. Arginine 등의 polyamine의 급여가 자궁 및 태아의 발달을 향상시키는 결과가 있었다. 하지만, 이에 대한 정확한 기전은 밝혀지지 않았고, 좀 더 실용적인 방법들이 개발되어야 할 것으로 생각된다. 대사적 각인을 통한 돼지 생산성 향상 연구는 새로운 개념이고, 이제 시작하는 단계이다. 수정란의 배반 포에서부터 영양적인 스트레스는 그 작용을 시작한다. 태아의 성장과 발달에는 영양을 공급하는 어미의 자궁 환경이 매우 큰 역할을 한다. 따라서, 어미의 건강과 자궁 내 환경에 대한 이해와 더불어 수정란의 착상과 발달에 대한 전반적인 이해가 필요하다. 더욱이, 몸의 절반이상을 차지하고, 전체 에너지 대사 조절에 큰 역할을 하고 있는 근육의 발생과 성장, 발달과정에 관여하는 인자들에 대한 연구도 필요할 것이다. 자궁 환경과 관련된 혈관조직 형성 인자, 성장호르몬 촉진 인자, 근육줄기세포 활성화 인자 등에 대한 연구와 이들의 조화로운 활성을 위한 영양소 선발 및 이들의 상호작용에 대한 연구는 앞으로 축산연구자들이 밝혀나가야 할 것으로 사료된다.