Introduction
국제 생명 공학 응용 정보 서비스(International Service for the Acquisition of Agri-biotech Applications; ISAAA)는 2016년 기준으로 유전자변형(Genetically Modified, GM) 작물이 전 세계 26개국에서 1억 8천 5백만 헥타르에 걸쳐 재배되고 있으며, GM 작물의 상업화는 작물의 생산성 증가를 비롯하여 생물 종 다양성 보전, 농업환경 개선, 온실가스 감축, 빈곤과 기아 감소, 기후변화 완화 등에 기여한다고 보고하였다(ISAAA, 2016). 국내에서도 식물생명공학연구를 통해 다수의 GM 작물이 개발되고 있으며, 최근에는 특히 가뭄, 염분, 저온, 고온 등 비생물 환경 스트레스에 대해 내성을 갖는 GM 작물 개발이 활발하게 진행되고 있다(Jang et al., 2003; Jung et al., 2008; Im et al., 2012; Jeong et al., 2017).
Cytochrome P450 수퍼패밀리는 식물의 생장과 발달을 촉진하고, 다양한 생합성 및 무독화 경로를 통해 식물을 스트레스로부터 보호하는 역할을 한다(Xu et al. 2015). 애기장대의 cytochrome P450 유전자를 암호화하는 AtCYP78A7 유전자는 벼에서 항시 발현되었을 때 환경스트레스에 대한 내성을 증대시키고, 종자의 크기를 증가시키는 것으로 알려져 있다(Kim and Choi, 2012).
AtCYP78A7 유전자를 과발현하는 GM 벼를 일반 환경에서 재배하였을 때 아미노산과 지방산, 무기질, 비타민, 일반성분 등 주요 영양성분에서 변화가 일어나지 않았다(Nam et al., 2013). 그러나 가뭄환경에서는 일반 벼와 비교하여 구리와 칼륨의 함량이 증가하였다(Nam et al., 2014). 또한 대사체를 총체적으로 분석하는 비표적(non-targeted) 대사체 분석을 수행한 결과 출수기의 줄기에서 가뭄환경에 따른 당함량의 변화가 유도되었으며(Nam et al., 2015), 등숙기의 종자에서 가뭄환경에 의해 γ-aminobutyric acid, fructose, glucose, glycerol, glycine, aminoethanol의 축적이 촉진되었다(Nam et al., 2016).
한편, GM 작물의 상업화를 위해서는 인체 및 환경에 대한 체계적이고 광범위한 안전성평가가 필수적이다. 인체와 환경에 미칠 수 있는 위해 가능성을 사전에 방지하기 위하여 국내에서는 “유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법)”을 2008년부터 시행하고 있으며, 이에 따라 GM 작물에 대한 잡초화가능성 평가, 환경방출 모니터링, 비표적생물체에 대한 영향 평가 등이 수행되어졌다(Ko et al., 2016; Lee, 2017). 또한 GM 작물에는 기존에 식품으로 이용하지 않았던 동물, 식물, 미생물로부터 유래한 유전자가 도입되는 경우가 많으며, 따라서 GM 작물에서 새롭게 발현되는 단백질은 인류가 안전하게 이용해온 식품의 구성성분이 아니며 안전성이 규명되지 않았으므로 단백질의 안전성평가는 GM 작물 안전성평가의 핵심요소가 된다(Delaney et al., 2008).
국내에서는 환경스트레스 내성 GM 유채에서 발현되는 ß-glucosidase 1 (AtBG1) 단백질의 단회투여 경구독성 시험에서 독성이 나타나지 않았음이 보고되었고(Lee et al. 2017), 제초제저항성 감자에서 발현되는 phosphinothricin acetyltransferase (PAT) 단백질의 단회 경구투여에 의한 독성이 없다는 것이 보고된 바 있다(Lee et al., 2012). 또한 병저항성 GM 벼에서 발현되는 choline kinase 1 (OsCK1) 단백질(Kim et al., 2014)과 해충저항성 GM 벼에서 발현된 Cry1Ac1 단백질(Lee et al., 2015)의 알레르기 유발 가능성이 없다는 것이 보고되었다.
본 연구에서는 애기장대 유래의 AtCYP78A7 유전자를 과발현 하도록 형질전환한 환경스트레스 내성 GM 벼에서 발현되는 신규 단백질에 대한 잠재적 알레르기성 및 독성을 평가하기 위하여 알레르기와 독소 원인물질 데이터베이스에 의한 상동성 비교와 마우스를 이용한 단회 경구투여 독성시험을 수행하였다.
Materials and Methods
아미노산 서열 상동성 검색
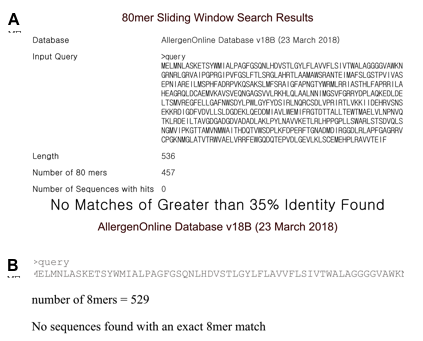
AtCYP78A7 단백질의 아미노산 서열(Fig. 1)과 기존 알레르겐 아미노산 서열과의 상동성 분석은 FAO/WHO (2001)에서 권장하고 있는 방법에 따라 80개 단위의 아미노산 서열이 35% 이상 일치하는 경우와 8개의 연속된 아미노산 서열이 일치하는 경우 상동성이 있는 것으로 판단했다. 본 연구에서는 SwissProt, WHO-IUIS, PIR, NCBI, Protein DATA Bank 등의 데이터베이스가 구축된 4개의 웹사이트를 이용해 실시했다(Allergen Online: http://www.allergenonline.org, Allermatch: http://allermatch.org, Structural Database of Allergenic Proteins (SDAP): http://fermi.utmb.edu/SDAP/, Allergen Database for Food Safety (ADFS): http://allergen.nihs.go.jp/ADFS). 또한 NCBI에 구축된 데이터베이스를 이용해 AtCYP78A7 단백질의 아미노산 서열을 BLAST 검색하여 기존 독소와의 상동성 여부를 확인했다.
GST-AtCYP78A7 단백질 제조
AtCYP78A7 단백질의 급성 경구투여 독성시험을 수행하기 위해 대장균에서 AtCYP78A7 재조합 단백질을 대량 생산한 후 정제하였다. AtCYP78A7 단백질을 코딩하는 유전자 DNA를 pGEX-4T-1 벡터와 접합해 pGEX-4T-1-AtCYP78A7 construct를 합성한 후 클로닝된 플라스미드를 E. coli BL-21 (DE3) RIPL에 형질전환했다. 형질전환된 콜로니는 액체배지에 600 nm에서의 흡광도(A600)가 0.6이 될 때까지 배양한 후 IPTG를 최종농도가 1 mM이 되도록 첨가하여 5시간 동안 배양함으로써 GST fusion protein 발현을 유도했다. 발현을 유도해 얻은 세포를 sonication하여 세포를 분쇄한 후 GST affinity column을 사용해 GST-fusion protein을 분리 정제했다. 분리 정제된 단백질은 12% SDS-PAGE로 분리했으며, Coomassie 염색법으로 확인했다.
시험물질의 제조
경구투여 시험 당일에 정제된 GST-AtCYP78A7 단백질을 전자저울(CP323S, Sartorius, Germany)로 칭량하여 유발에 넣은 다음 부형제(주사용수, 중외제약)를 일부 넣고 현탁시켰다. 유리조제병에 조제물을 옮긴 후 부형제를 가하여 규정농도(200 mg/mL)로 시험물질을 제조했다.
실험동물
본 시험은 GLP (Good Lap Practice) 기관 인증을 가진 (주)바이오톡스텍에서 비임상시험관리기준(식품의약품안전처 고시 제2014-67호)과 의약품등의 독성시험기준(식품의약품안전처 고시 제2014-136호)을 준수해 실시했다. 본 시험은 또한 동물보호법에 근거한 (주)바이오톡스텍의 동물실험윤리위원회에 의해 승인되었다(승인번호: 150298).
5주령 Institute of Cancer Research (ICR) 마우스(CrljOri:CD1(ICR), SPF, 오리엔트바이오) 수컷과 암컷 각 12마리를 입수한 뒤 7일간 순화시키며 매일 일반증상을 관찰하고, 순화기간 시작과 종료일에 체중을 측정해 실험동물에 이상이 없음을 확인했다. 스테인레스 철망사육상자(100 × 200 × 130 mm)에 1마리씩 사육했고, 사육환경조건은 온도 21.1 - 22.4℃, 상대습도 45.6 - 55.2%, 환기횟수 10 - 15회/시간, 명암주기 12시간/일, 조도 150-300 lux이었다. 실험동물용 고형사료(Teklad Certified Irradiated Global 18% Protein Rodent Diet 2918C, Harlan Laboratories, Inc., U.S.A.)를 급이기에 넣어 자유 섭취시켰다. 청주시 수돗물을 필터유수살균기로 여과 후 자외선을 조사한 뒤 음수로 자유 섭취시켰다.
실험군 구성 및 투여
순화종료일에 평균체중에 가까운 암수 각 10마리를 선발하고 각 군 평균체중이 균등하도록 무작위로 암수 각 2군, 군당 5마리로 군분리하였다. 투여시 수컷의 체중은 24.9 - 30.3 g, 암컷의 체중은 22.2 - 24.5 g 이었다. 실험동물 당 투여액량은 투여당일의 개체별 체중을 기준으로 산출하여 10 mL/kg으로 정하였다. 경구투여용 존데를 부착한 1 mL 일회용 주사기를 이용해 위내에 단회 강제 투여했다. 모든 동물은 투여 전에 4시간 이상 음수는 자유 섭취시키면서 절식시켰고, 투여 후 약 2시간에 사료를 급여했다. GST-AtCYP78A7 단백질을 대조군(G1)에는 0 mg/kg, 시험물질 투여군(G2)에는 2,000 mg/kg 용량으로 투여했다. 예비시험으로 투여용량 2,000 mg/kg, 투여액량 10 mL/kg을 암수 마우스 각 1마리에 단회 경구 투여한 결과 사망례가 관찰되지 않았다. 따라서 투여용량은 2,000 mg/kg의 농도를 단일 시험물질 투여군의 농도로 설정하였고 대조군에는 시험물질 투여군과 동일한 액량의 부형제를 투여했다.
임상증상 관찰 및 검사
모든 시험동물은 투여 시점을 기준으로 30분, 1, 2, 4 및 6시간째에 일반상태(독성징후 종류, 발현시기, 회복시기 등) 및 사망유무를 관찰했다. 투여 후 1일부터 14일까지는 매일 1회 일반증상 및 사망유무를 관찰했다. 체중은 투여당일 투여 전, 투여 후 1, 3, 7 및 14일(부검일)에 측정했다. 관찰기간 종료 후 모든 동물은 CO2 가스를 흡입시켜 배대동맥에서 방혈하여 안락사시키고 부검하였으며, 장기에 대한 육안적 검사를 통해 최종 병변 유무를 확인했다.
통계처리
투여군과 대조군의 체중의 통계분석은 SAS (version 9.3, SAS Institute Inc., USA)를 사용해 검정했다. Folded-F 검정법을 사용해 등분산성을 검정한 결과(유의수준: 0.05) 등분산인 경우 Student t-test를, 등분산이 아닌 경우 Aspin-Welch t-test를 실시해 유의성을 확인했다(유의수준: 양측 0.05 및 0.01).
Results and Discussion
아미노산 서열 상동성
식품 알레르겐과 호흡성 알레르겐 다수가 동정되었고 알레르겐의 단백질 서열이 다양한 데이터베이스에 등재되어 있다. 따라서 생물정보 도구를 이용해 신규 단백질의 아미노산 서열과 이미 알고 있는 알레르겐 아미노산 서열의 상동성을 비교함으로써 구조적 유사성을 추정할 수 있다(Ladics, 2008). 쌀은 식품 알레르기 반응에서 비교적 안전한 식품으로 알려져 있지만, 쌀에 알레르기가 있는 환자의 혈청을 이용한 실험에서 14 - 16 kDa 과 26, 33, 56 kDa의 단백질이 쌀 알레르기 유발물질로 확인된 바 있다(Matsuda et al., 1991; Usui et al., 2001). 본 연구에 사용된 환경스트레스 내성 GM 벼에서 발현되는 AtCYP78A7 단백질은 536개의 아미노산으로 구성되어 있으며, 아미노산 서열을 80개 단위로 구분하여 35% 이상의 서열 상동성을 갖는 알레르겐에 대한 FASTA 검색을 실시한 결과 35% 이상의 서열 상동성을 갖는 알레르겐은 없는 것으로 나타났다(Fig. 2A). 다음으로 연속된 일련의 아미노산 서열 유사성을 확인하기 위해 pattern match 검색을 실시한 결과 8개의 연속된 아미노산 서열에 일치하는 경우는 없는 것으로 나타났다(Fig. 2B). 이 GM 벼에는 hygromycin phosphotransferase (hpt) 유전자가 선발표지유전자로 도입되어 있다. 이에 따라 발현되는 hygromycin B phosphotransferase 단백질의 알레르기성은 없음이 보고되었다(Lu et al., 2007).
국제식품규격위원회(Codex Alimentarius Commission)에 의하면, 80개 단위의 아미노산에서 35% 이상의 서열 상동성이 발견되는 경우와 공여생물체가 알레르기 유발원으로 알려진 경우에는 환자 혈청반응시험을 요구하고 있다(CODEX, 2009). 그러나 AtCYP78A7 단백질은 알레르기 유발원으로부터 유래한 단백질이 아니며, 35% 이상의 서열 상동성이 발견되지 않았으므로 환자 혈청반응시험은 본 연구에서 실시하지 않았다.
AtCYP78A7 단백질 아미노산 서열과 기존 독소 아미노산 서열의 상동성 검색 결과 단백독소는 검색되지 않았고(data not shown), 식품으로 사용하고 있는 참깨, 유채, 파파야, 복사나무 등 여러 식물의 cytochrome P450 단백질과 아미노산 서열 상동성이 매우 높게 나타났다. 이상의 결과로 환경스트레스 내성 GM 벼에서 발현되는 AtCYP78A7 단백질은 알레르기 및 독성물질로 작용할 위험성이 없음을 확인하였다.
AtCYP78A7 단백질의 발현 및 정제
AtCYP78A7 단백질의 단기 독성을 평가하기 위해 대장균을 이용하여 재조합 단백질을 대량 발현한 후 정제하였다. GST-AtCYP78A7 단백질을 발현시킨 후 native condition에서 GST affinity 정제를 진행한 결과는 Fig. 3A에 나타내었다. GST-AtCYP78A7 단백질은 약 86.3 kDa 크기였으며, 전체적으로 발현되는 타겟 단백질 양은 많지 않았다. 대량 배양 조건 하에서는 25 kDa 부근에 GST로 생각되는 단백질이 함께 발현되었으며, 전체적인 purity는 높게 관찰되었다. Flowthrough에 타겟 단백질이 남아 있을 가능성이 있어 한 번 더 정제했으며 elution fraction은 모두 합쳐 농축했다. 그 후 분리 정제된 단백질을 정량한 후 12% SDS-PAGE로 분리해 Coomassie 염색법으로 GST-AtCYP78A7 단백질임을 확인했다(Fig. 3B).
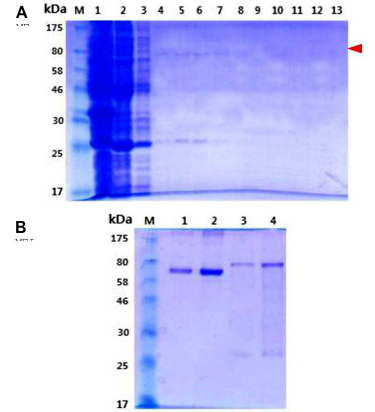
Fig. 3. Purification of the glutathione S-transferase (GST)-AtCYP78A7 protein. (A) Purification of the GST-AtCYP78A7 protein expressed in E. coli BL21 by GST affinity column chromatography. Lane M: protein marker, lane 1: total soluble protein induced in E. coli, lane 2: flow-through, lane 3: eluate by washing buffer, lane 4-13: eluate by elution buffer. (B) Confirming purity of the purified GST-AtCYP78A7 protein. Lane M: protein marker, lane 1: bovine serum albumin (BSA) 1 µg, lane 2: BSA 2 µg, lane 3: GST-AtCYP78A7 1 µg, lane 4: GST-AtCYP78A7 2 µg.
AtCYP78A7 단백질의 급성 경구독성
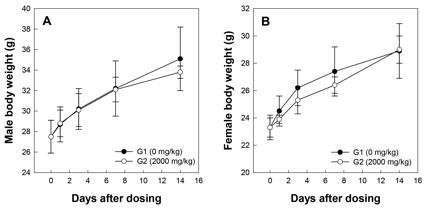
AtCYP78A7 단백질의 급성독성을 평가하기 위하여 GST-AtCYP78A7 단백질을 ICR 마우스에 2000 mg/kg의 용량으로 1회 경구 투여한 후 2주간 사육하면서 사망률, 체중변화, 일반증상 및 부검소견을 관찰하였다. 시험기간 동안 사망한 동물은 암수의 모든 시험군에서 관찰되지 않았으며(Table 1), 단백질의 투여와 관련된 특이한 임상 증상도 관찰되지 않았다(Table 2). 시험물질 투여 전과 투여 후 1, 3, 7 및 14일에 암수 대조군 및 2000 mg/kg 투여군의 체중 측정 결과 투여군과 비투여군간에 유의한 차이가 나타나지 않았다(Fig. 4). 시험 종료(투여 후 14일) 시 생존동물의 부검 결과, 암수 대조군과 2000 mg/kg 투여군에서 모두 내부 장기의 육안적 이상 소견이 관찰되지 않았으며(Table 3), 따라서 조직병리학적 검사는 실시하지 않았다.
|
Table 1. Mortality of Institute of Cancer Research (ICR) mice after single oral administration of AtCYP78A7 protein. 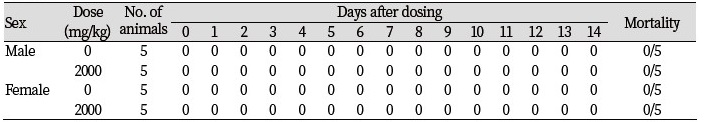
|
|
Table 2. Clinical signs of Institute of Cancer Research (ICR) mice after single oral administration of AtCYP78A7 protein. 
|
GM 작물의 안전성평가에서 독성평가는 인체에 미치는 영향을 가장 직접적으로 평가하는 유용한 방법이다. GM 작물의 독성평가는 각 국가별로 차이를 보이며, 우리나라는 LMO법 통합고시 별표 10-1에 단회투여 독성만을 제출하도록 되어 있으며, 필수 제출자료로 안전성이 확인되지 않는 경우에 한해서 아만성독성 및 육계 검정 자료도 요구될 수 있다. 본 연구에서는 환경스트레스 내성 GM 벼에서 발현되는 AtCYP78A7 단백질이 독성으로 작용할 가능성을 평가한 결과 AtCYP78A7 단백질의 마우스에 대한 단회 경구투여는 아무런 독성학적인 변화를 유발하지 않는 것으로 확인되었으며, AtCYP78A7 단백질의 ICR 마우스에 대한 최소 치사량(minimal lethal dose)은 암수 모두 2000 mg/kg을 크게 상회하는 것으로 나타났다. 본 연구의 결과를 통해 AtCYP78A7 단백질이 급성독성을 유발할 위험성은 거의 없을 것으로 판단된다.
Conclusions
본 연구는 AtCYP78A7 유전자를 과발현 하도록 형질전환한 환경스트레스 내성 GM 벼에서 발현되는 신규 단백질에 대한 잠재적 알레르기성 및 독성을 평가하기 위하여 아미노산 서열 상동성 비교와 마우스를 이용한 단회 경구투여 독성시험을 수행하였다. 본 연구결과 AtCYP78A7 단백질과 기지 알레르겐 또는 단백독소의 아미노산서열을 비교했을 때 상동성이 발견되지 않았다. 또한 pGEX-4T-1 벡터로 AtCYP78A7 단백질을 코딩하는 유전자를 클로닝하고 대장균에서 발현시켜 AtCYP78A7 단백질을 정제하였으며, 마우스에 2,000 mg/kg 농도로 정제된 단백질을 경구 투여했을 때 독성은 관찰되지 않았다. 따라서 AtCYP78A7 단백질이 알레르겐 또는 단백독소로 작용할 가능성은 낮은 것으로 판단된다.