Introduction
전 세계적으로 GM작물(genetically modified crops)은 제초제내성 GM콩이 1996년에 상업적으로 재배된 이후, 생명공학기술을 이용된 GM작물의 관련 시장이 급속하게 성장하였으며, 2017년에는 24개국에서 189.8백만 헥타르의 면적에서 재배되었으며, 세계 전체 종자시장의 30%를 차지하고 있다. 2017년 기준으로 GM작물은 40개 국가에서 29개 작물, 498개의 이벤트가 식품 및 사료, 환경 방출에 대한 승인이 이루어졌다(James, 2018). 현재까지 국내에서는 격리된 시설에서의 시험연구용 이외에는 GM작물 재배가 되고 있지 않다. 그러나, 국내에도 2017년 기준으로 식품 및 사료용 등의 용도로 약 9,601천 톤의 GM곡물이 수입되었다(KBCH, 2018). GM작물의 안전한 이용과 환경과 인체에 대한 위해성을 사전에 예방하고자 세계 각국에서 자국에 적합한 유전자변형생물체(genetically modified organism; GMO) 안전 관리 체계를 구축하고 있다. GMO에 대한 국가 간의 안전관리와 협력를 위해 바이오 안정성 의정서(Cartagena Protocol on Biosafety) 국제협약을 체결하였으나, GM작물 재배 농경지 주변의 농업 환경, 생태계 위해성 및 GM작물의 식품 섭취에 의한 인체 안전성에 대한 우려도 꾸준히 문제시 되고 있다(Lee and Suh, 2011).
국내에서도 경제적으로 중요한 벼, 잔디, 콩, 고추, 배추, 감자 등을 중심으로 다양한 기능의 유전자도입이 시도되어 왔으며, 이중 일부 GM작물의 이벤트 계통들에 대한 안전성심사가 진행 중이나 아직 실용화단계에는 이르지 못하고 있는 실정이다(Oh et al., 2017). GM작물 상업화를 위해서는 환경위해성 및 인체 안전성평가가 필수적이며, 특히 도입 유전자 산물에 대한 표적 및 비표적 생물체에 미치는 영향, 유전자 이동성, 잡초화 등 안전성에 대한 입증이 필수 요소이다.
국제적인 미생물 기준에 따라 비병원성 세균으로 분류되는 Bacillus thuringiensis (Bt)는 살충성으로 인하여 1961년 이후부터 상업적으로 삼림, 농경과 모기 방제 등을 위한 생물 농약으로 이용되었다. 주요 농작물들의 해충에 의한 피해를 방제하기 위하여 Bt유래의 다양한 Cry 유전자들을 작물에 도입함으로써 생명공학 기술을 이용한 해충 방제가 시도 되어왔다. 1981년에 최초로 Cry 유전자가 분리된 이래로 총 314종의 Cry 유전자가 발견되었다(Schnepf and Whiteley, 1981; OECD, 2007). 현재까지 약 100종 이상의 Bt을 이용한 상품이 등록되어 있으며(USEPA, 2007), Bt를 살포한 작물에서는 표적하는 해충에 특이적으로 살충 효과를 나타내고 반면 포유류에 무해한 것으로 보고되고 있다(Betz et al., 2000). 살충효과는 농작물의 표적 해충군에 특이적이며, 결정성 내독소 단백질(crystal [CRY] δ-endotoxin)에 의한 것으로 보고되었다(Schnepf and Whiteley, 1981). 수년간 역학 조사 연구 결과, 생물 농약은 동물이나 인체에 미치는 위험성이 낮으며, 어떤 심각한 감염이나 식중독을 일으킨다는 증거가 아직 보고되지 않았으며, B. thuringiensis 박테리아 생물 농약은 현재까지 안전하게 이용되고 있다(Rosenquist et al., 2005). 하지만 Bt작물 방어의 특이성뿐만 아니라 Cry 단백질의 표적 또는 비표적 생물체에 대한 작용기작도 완벽하게 이해되지 않고 있으며(Bravo et al., 2007), 광범위한 면적에서 경작되고 있음에도 불구하고 비표적 생물체에 미치는 영향을 과학적으로 분석한 예는 많지 않은 실정이다. 따라서 환경위해성 평가 요소 중에 하나인 비표적 생물체에 대한 영향 평가에 대한 체계적인 입증이 필요하다.
GM작물에 도입된 유전자의 발현단백질은 식물체 내에서 복잡한 유기화합물 상태로 되어있으며, 식물체내의 발현물질들 상호간의 작용에 대한 예측을 위해서는 발현단백질이 생물체의 생체 기능의 상실이나 치사, 번식, 신진대사의 감소 등에 미치는 영향을 분석함으로써 유해성을 검사하는 환경생물 독성시험이 생태계 측면에서 합리적인 방법으로 알려져 있다(Kim et al., 2010). 환경생물 독성시험에는 다양한 수서생물종이 사용되는데 무척추동물로는 가재(crayfish), 옆새우(Gammarus), 완미윤충류(Brachionus), 물벼룩(Daphnia, Daphnia magna), 어류로는 자브라피쉬(zebra fish, Brachydanio rerio), 미꾸리(Misgurnus anguillicaudatus), 잉어(Cyprinus carpio), 무지개송어(Oncorhyunchus mykiss), 그리고 조류로는 Selenastrum, Chlorella, microsystis, Navicula 등이 일반적으로 사용되고 있다(Versteeg et al., 1997).
본 연구에서는 토양 세균인 Bacillus thuringiensis 에서 유래한 해충저항성 유전자(mCry1Ac1)를 일미벼에 도입시킴으로써 혹명나방(Cnaphalocrocis medinalis)에 대하여 살충성을 나타내는 해충저항성 Bt벼(Lee et al., 2016)가 물벼룩에 미치는 급성독성 여부를 분석하기 위하여 mCry1Ac1 유전자의 도입과 mCry1Ac1 단백질 발현량을 확인한 후, 모본으로 사용된 일미벼와 함께 환경위해성 평가 항목 중 비표적 생물체인 물벼룩에 미치는 영향을 조사함으로써 안전성 자료 생산용 급성독성 평가를 수행하였다.
Materials and Methods
시료 제조
해충저항성 Bt벼(Bt-9, T6)와 비형질전환 모품종인 일미벼를 국립농업과학원 LMO 격리 포장(2017년, 전라북도 전주시, RDA-가AB-2013-041)에서 재배하였으며 출수기에 줄기와 잎을 수확하여 동결건조기(FD8518, IlsinBioBase, Yangju, Korea)를 이용하여 건조한 후, 분쇄기(HMF-3100S, Hanil Electric, Seoul, Korea)를 이용하여 분쇄하였다. 분쇄된 시료는 표준망체(Chunggye sang gong sa, Seoul, Korea) 600 μm를 이용하여 선별한 후, 부형제인 M4 배지(Sigma Aldrich, Germany)에 현탁하여 물벼룩 급성독성 분석용 시료로 사용하였다.
Genomic DNA 분리 및 PCR 검정
일미벼와 해충저항성 Bt벼(Bt-9) 식물체의 시료를 각 1 g씩을 취하고, 막자사발을이용하여 분말화한 후 DNeasy Plant kit (Qiagen, USA)을 사용하여 일미벼와 해충저항성 Bt벼(Bt-9)의 genomic DNA를 분리하였다. 추출된 DNA를 정량은 NanoDrop Spectrophotometer ND-1000 (NanoDrop Technologies Inc., Wilmington, USA)를 이용하여 260/280 nm 측정값이 1.8 - 2.0 사이인 DNA 시료를 실험에 이용하였다. 해충저항성 Bt벼(Bt-9) 도입된 운반체의 유전정보를 기반으로 mCry1Ac1, Bar (Phosphinothricin acetyltransferase), SPS (Sucrose-phosphate synthase)유전자 확인용 특이적 프라이머를 제작하였다(Table 1). PCR 검정을 위하여 template genomic DNA 20 ng에 10X PCR buffer 4 μL, 프라이머, dNTP (10 mM) 4 μL, 각 20 μM, f-Taq DNA polymerase 1 unit (Solgent, Daejeon, Korea)을 첨가한 후 최종 반응 용량을 40 μL로 하였다. PCR 반응조건은 94℃ 5분 후, 94℃ 30초, 55℃ 30초, 72℃ 1분의 조건에서 30 사이클로 증폭한 뒤 72℃에서 5분간 반응을 순차적으로 실시하였다. 증폭된 PCR 산물은 1% agarose gel에서 전기 영동한 후 확인하였다.
|
Table 1. Primers list used for PCR (Polymerase chain reaction) analysis. 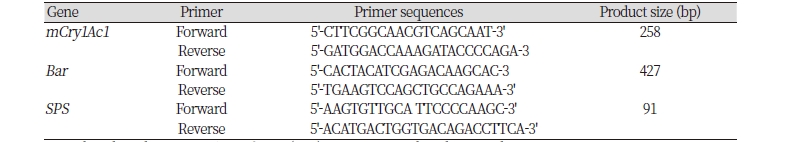
|
|
|
Bar, phosphinothricin acetyltransferase (PAT); SPS, sucrose-phosphate synthase. |
|
mCry1Ac1 단백질 발현 분석
mCry1Ac1 유전자의 발현 검정을 위하여 immunostrip 검정(lateral strip test)을 실시하였다. 일미벼와 해충저항성 Bt벼(Bt-9)의 시료를 추출액과 함께 마쇄하여 단백질을 추출한 후, mCry1Ac1 및 bar 유전자의 발현을 CryIAc1 ImmunoStrip Test (Agdia, Elkhart, USA)와 Trait LL Test Strip (Strategic Diagnostics Inc, Newark, USA)을 이용하여 각각 immunostrip 검정을 수행하였다. 일미벼와 해충저항성 Bt벼(Bt-9)의 mCry1Ac1 단백질의 농도를 측정하기 위하여 각 시료들을 마쇄한 후 PBST용액과 함께 균질화 한 후 저온처리(얼음에서 5분) 및 원심분리(5,000 g, 5분)하여 단백질을 분리, 추출한 후 Bt-Cry1Ab/1Ac ELISA Kit (Agdia, Elkhart, USA)를 이용하여 ELISA (enzyme-linked immunosorbent assay)분석을 실시하였다. 모든 시료들은 상온에서 2시간 반응한 후 ELISA reader (Multiskan EX, Thermo Scientific, USA)를 이용하여 450 nm 파장에서 흡광도를 측정하였다.
물벼룩 배양 조건
수서환경의 비표적생물체인 물벼룩(Daphnia magna)은 한국화학융합시험연구원(Hwasun, Korea)에서 사육된 것을 사용하였다. 장방형 수조(1 L 용량)에서 광조건 16시간, 암조건 8시간, 수온 19 - 21℃의 환경조건에서 사육하였으며, 사육수조 내 수온과 사육실의 온도는 자동온도측정기로 매 30분마다 측정하였다. 물벼룩의 먹이원으로 Chlorella vulgaris (ATCC, Manassas, USA)을 순수 배양하여 매일 1회 공급하였으며, 용수는 ‘Daphnia sp., Acute Immobilisation Test, Annex 3 Elendt M7 and M4 medium’(OECD, 2004)에 제시된 M4 배지를 제조하여, 사용하기 전 2시간 이상 강하게 폭기 시킨 후 물벼룩 사육 용수로 이용하였다. 수질의 측정은 물벼룩 시험 용수의 조제 당일 경도는 한국산업규격 KSI3206의 Inductively coupled plasma emission spectroscopy에 의한 알칼리도는 Standard method (21th edition, APHA, AWWA, WEF, USA)의 염산 적정법으로 분석하였다.
물벼룩에 대한 시료 처리조건
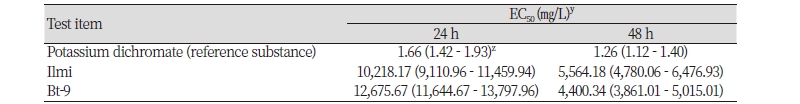
일미벼와 해충저항성 Bt벼(Bt-9)의 각 시료에 대한 48시간 동안 유효농도 분석 결과 EC50값이 500 - 17,006 mg/L 범위 내에 포함된다는 예비 실험을 근거로 500, 900, 1,620, 2,916, 5,249, 9,448 및 17,006 mg/L (설정농도, 공비 1.8)의 농도조건에서 물벼룩에 대한 시료 처리를 하였다. 일미벼와 해충저항성 Bt벼(Bt-9)의 시료(0.5, 0.9, 1.62, 2.92, 5.25, 9.45 및 17.01 g)는 각각 1 L의 시험용수에 반복 처리하여 시험 용액(test solution)으로 조제하였다. 시험 용수인 M4배지를 음성 대조구로, potassium dichromate (Sigma-aldrich, USA)를 양성대조구로 각각 사용하였다. 시료처리는 생후 24시간 이내의 어린 물벼룩을 대상으로 농도 당 각 10마리씩 3반복 실시하였다. 500 mL 용량의 원통형 유리수조(115 mm φ × 65 mm H.)에 300 mL 처리하였으며, 수온은 사육조건과 동일한 20 ± 1℃를 유지하였다.
급성독성분석을 위한 조사항목
물벼룩에 대한 급성 독성 여부를 확인하기 위하여 일미벼와 해충저항성 Bt벼(Bt-9)의 농도별 처리구에 대하여 24시간 경과 후 유영저해개체 수, 일반중독증상 및 특이증상 등을 분석하였다. 유영 저해의 판정은 위해 시험용액을 가볍게 저어준 후, 약 15초간 관찰하여 물의 흐름을 벗어나지 못하거나 유영하지 못하는 개체를 영향 받을 것으로 간주하였다. 치사 개체는 유영 저해 개체에 포함시켰다. 시험기간 중 시료 처리직후와 종료 시의 각 처리구에 대하여 DO (dissolved oxygen) 및 pH를 측정하였으며, 수온은 24시간 간격으로 측정하였다. pH와 DO, 수온은 WTW 사의 Multi 9430 (WTW, Germany)를 사용하여 측정하였다. 무영향농도(NOEC, No observed effect concentration)와 EC50산출은 시험물질 처리 후 48시간의 유효성분에 대한 반수영향농도(EC50) 및 95% 신뢰한계를 probit 분석법에 의해 산출하였으며, 무영향농도는 중독증상이 없고 유영저해가 발생하지 않는 최고 시험농도로 표시하였다.
Results and Discussion
해충저항성 Bt벼의 분자생물학적 분석
급성 독성평가에 이용된 해충저항성 Bt벼(Bt-9)는 토양 세균인 Bacillus thuringiensis 유래한 해충저항성 유전자중 살충성을 보이는 주요 염기서열을 작물에 적합하도록 변형시킨 mCryIAc1 유전자를 일미벼에 도입하여 개발되었으며(Lee et al., 2016), 생물검정 결과 혹명나방 유충에 대하여 우수한 살충성을 보여 안전성 평가가 진행 중에 있다. 생물검정 결과 높은 살충성을 보인 해충저항성 Bt벼(Bt-9, T6) 와 비형질전환 일미벼를 GM격리포장(2017, Jeonju, Korea)에서 재배한 후 비표적생물체인 물벼룩에 대한 급성독성평가를 실시하였다.
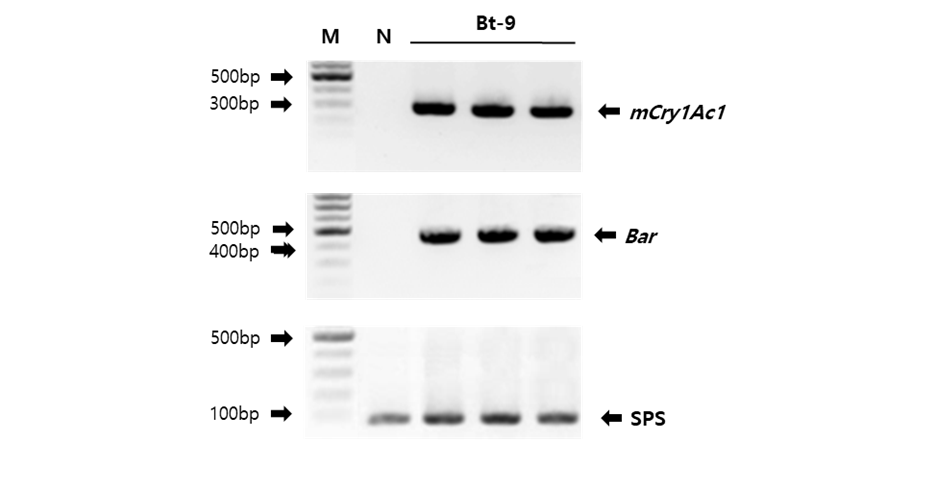
물벼룩 급성 독성 평가에 사용된 시료에 mCry1Ac1 유전자의 삽입을 확인하기 위하여 PCR 분석을 실시한 결과 해충저항성 Bt벼(Bt-9)에서만 258 bp의 반응 산물이 생성됨을 확인하였으며, 모품종인 일미벼에서는 검출되지 않았다. 선발마커인 bar (phosphinothricin acetyltransferase) 유전자도 해충저항성 Bt벼(Bt-9)에서만 427 bp 크기의 밴드가 검출되었고 일미벼에서는 밴드가 검출되지 않았으며, 벼 내재유전자인 sps (sucrose-phosphate synthase) 유전자는 해충저항성 Bt벼(Bt-9)와 일미벼 두 품종에서 모두 91 bp의 산물이 검출되었다. 이와 같은 결과는 본 실험의 물벼룩 급성 독성 평가에 이용된 해충저항성 Bt벼(Bt-9, T6)에 mCry1Ac1 와 bar 유전자가 도입되었으며, 도입유전자가 안정적으로 발현됨을 확인하였다(Fig. 1). mCry1Ac1 유전자는 본 실험에 사용된 해충저항성 Bt벼(Bt-9)에 one-copy로 삽입되었음을 Southern 분석을 통하여 확인한 바 있다(Lee et al., 2016).
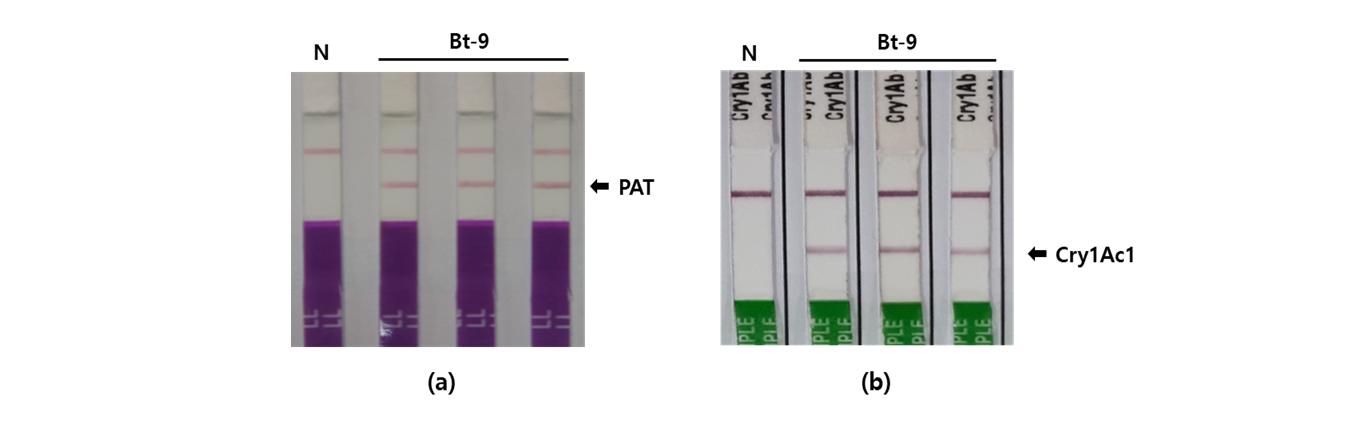
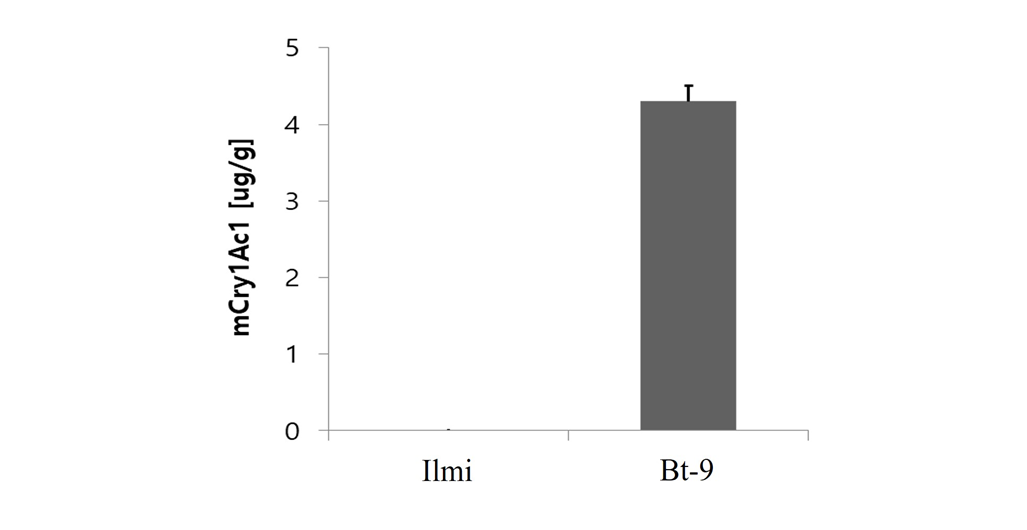
해충저항성 Bt벼(Bt-9)에서 mCry1Ac1 단백질의 발현을 검정하기 위하여 항체를 이용한 LFST (lateral flow strip test)분석을 실시하였다. 2017년 국립농업과학원 LMO 격리포장에서 재배한 해충저항성 Bt벼(Bt-9, T6)와 일미벼에 대하여, cry1Ac1 및 PAT (bar) 단백질 확인용 항체가 표지되어있는 immunostrip을 이용하여 각 단백질 발현을 분석한 결과, 해충저항성 Bt벼(Bt-9)에서만 특이적으로 단백질이 검출되었으며, 대조구인 일미벼에서는 단백질이 발현되지 않았다(Fig. 2). 또한 해충저항성 Bt벼(Bt-9)에서의 cry1Ac1 단백질 발현량을 ELISA법을 이용하여 분석한 결과 해충저항성 Bt벼(Bt-9)에서만 4.3 ± 0.2 μg/g 수준의 mCry1Ac1 단백질이 발현되었으며 일미벼에서는 발현되지 않았다(Fig. 3).
시료처리용 시험용수의 수질변화 검정
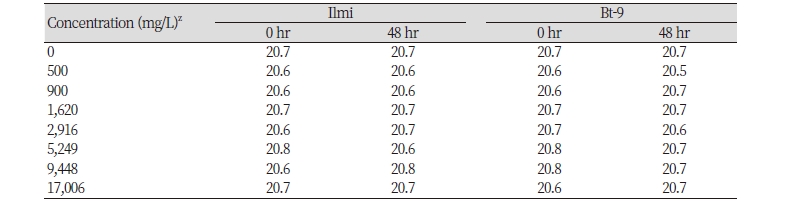
물벼룩 급성 독성 시험 분석을 위하여 시험용수의 수질 검사를 시료 처리 직후와 시험 종료 시 각 처리구별로 수조내 수온, pH 및 DO를 조사하였다. 예비시험의 측정 결과를 기준으로 DO가 포화용준산소량의 60% 이하로 내려가는 것을 방지하기 위하여 24시간 간격으로 30분간 산소를 공급하였다. 시험기간 중 시험용수 내 수온은 일미벼와 해충저항성 Bt벼(Bt-9)에 대하여 각각 20.7 ± 0.1℃ (20.5 - 20.8℃) 및 20.7 ± 0.1℃ (20.5 - 20.8℃)로 안정적으로 유지됨을 확인하였다. 환경생물 독성 시험기준과 방법(농촌진흥청 고시 제 2010-29호)에서 제시된 물벼룩 독성평가 실험 방법의 적정 실험온도인 18 - 22℃ 수준을 유지하였으며, 1℃이내의 온도 변화를 측정되어 온도에 의한 물벼룩 급성 독성 실험의 영향 요소로는 작용하지 않음을 확인하였다(Table 2). pH는 0시간 처리조건에서 일미벼와 해충저항성 Bt벼(Bt-9)의 농도별 처리구에서 각각 6.94 ± 0.28 (6.51 - 7.31) 및 6.98 ± 0.22 (6.62 - 7.36)이었으며, 48시간 처리 후 에는 각각 6.72 ± 0.37 (6.14 - 7.59) 및 6.50 ± 0.30 (6.14 - 7.61)로 음성대조구(0 mg/L)의 0시간 처리에서는 평균 7.87과 48시간후에는 7.60로 측정되었다(Table 3). 예비시험의 측정결과를 바탕으로 일미벼와 해충저항성 Bt벼(Bt-9)에 대한 물벼룩 영향 평가분석을 위하여 시험용수의 DO는 포화용준산소량의 60% 이하로 내려가는 것을 방지하기 위하여 24시간 간격으로 산소를 30분간 공급하였다.
|
Table 3. Changes of pH during cumulative immobility tests of Daphnia magna in non-genetically modified rice (Ilmi) and Bt-transgenic (Bt-9) rice. 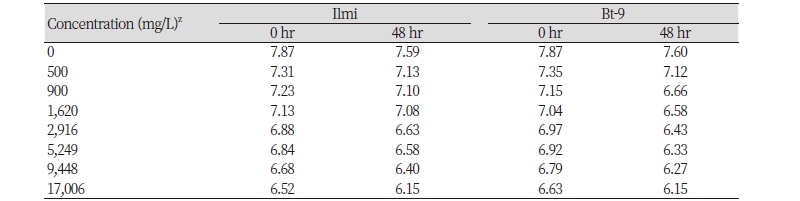
|
|
|
zActive ingredient: Ilmi; Bt-9 rice T6 100% |
|
일미벼와 해충저항성 Bt벼(Bt-9)의 처리 농도에 따른 물벼룩에 대한 유영저해 분석
물벼룩은 유기 및 무기 독성물질에 민감하게 반응하므로, 급성 독성 평가를 위해서는 일반적으로 24시간 및 48시간 후의 유영저해 분석 평가가 수행된다. 이에 일미벼와 해충저항성 Bt벼(Bt-9)의 물벼룩 급성독성시험을 48시간 동안 지수식으로 농도당 노출 물벼룩에 대한 생사수 관찰 및 일반중독증상을 조사하였다.
일미벼 처리구에서 500 - 17,006 μg/L의 시험농도에서 물벼룩 급성독성시험을 실시한 결과, 24시간 경과시 500, 900, 1,620, 2,916 μg/L 처리구에서는 유영저해 개체가 없었으나, 5,249, 9,448 μg/L 처리구에서 24시간 경과시 각각의 농도에서 10, 26.7%의 유영저해 개체가 관찰되었으며, 48시간 경과시 500, 900, 1,620 μg/L 처리구에서는 유영저해 개체가 없었으나 2,916, 5,249 및 9,448 μg/L 처리구에서는 13.3, 43.3, 83.3%의 유영저해 개체가 관찰되었다. 17,006 μg/L 처리구에서는 24, 48시간 후에 모두 100% 유영저해 개체로 관찰되었다. 해충저항성 Bt벼(Bt-9) 처리구에서 500 - 17,006 μg/L의 시험농도에서 물벼룩 급성 독성 시험을 실시한 결과, 24시간 경과시 500, 900, 1,620 μg/L 처리구에서는 유영저해개체가 없었으나, 2,916, 5,249, 9,448 및 17,006 μg/L 처리구에서 각각의 농도에서 3.3, 10, 16.7, 83.3%의 유영저해 개체가 관찰되었으며, 48시간 경과시 500, 900, 1,620 μg/L 처리구에서는 일미벼와 동일하게 유영저해 개체가 없었으나, 2,916, 5,249 μg/L 처리구에서 16.7, 63.3%의 유영저해가 관찰되었다. 48시간 경과시에 9,448 및 17,006 μg/L 처리구에서는 모두 100% 유영저해 개체가 관찰되었다. 처리 기간 중 음성대조군(0 mg/L)과 일미벼와 해충저항성 Bt벼(Bt-9)의 500, 900, 1,620 mg/L 처리구에서는 일반중독증상 및 특이증상은 관찰되지 않았다. 그러나, 일미벼와 해충저항성 Bt벼(Bt-9)의 2,916 mg/L 이상의 처리 농도 조건에서 일반중독증상인 수조 상단에서 유영하는 개체가 관찰되었다(Table 4). 일미벼와 해충저항성 Bt벼(Bt-9) 각 시험농도에서 물벼룩 유영저해 개체수의 t-test 검정결과, 2,916, 5,249, 9,448 및 17,006 μg/L 처리구에서 24시간후에는 각각 p값이 0.37, 1.00, 0.10, 0.13으로 일미벼와 해충저항성 Bt벼(Bt-9) 간 평균 유영 개체수에는 차이가 없었다. 또한, 일미벼와 해충저항성 Bt벼(Bt-9)의 48시간 처리후의 p값은 2,916, 5,249 및 9,448 mg/L 처리구에서 각각 0.51, 0.18, 0.13 이었으며 모든 처리농도에서 일미벼와 해충저항성 Bt벼(Bt-9) 간 평균 유영 개체수에는 유의적인 차이가 없었다(p > 0.05). 따라서 모든 처리구에서 해충저항성 Bt벼(Bt-9)와 모품종인 일비벼의 유영저해 개체수 차이는 없는 것으로 분석되었다. 이는 낙동벼가 모품종인 비타민 A강화벼와 병저항성 GM벼의 물벼룩 급성독성에서의 결과들과 일미벼가 모품종인 가뭄저항성(Agb0103)벼의 물벼룩 급성독성에서의 결과에서도 유사한 경향을 보였으며(Oh et al., 2012; Oh et al., 2014a; Oh et al., 2018), 또한, 전반적으로 유기물인 일미벼와 해충저항성 Bt벼(Bt-9)의 처리 시간 경과와 농도의 증가함에 따라 유영저해 개체의 변화가 유사한 경향을 보여, 해충저항성 Bt벼(Bt-9)에 의하여 물벼룩의 일반중독에 영향을 미치지 않은 것으로 추정된다.
|
Table 4. Cumulative immobility of Daphnia magna in non-genetically modified rice (Ilmi) and Bt-transgenic (Bt-9) rice. 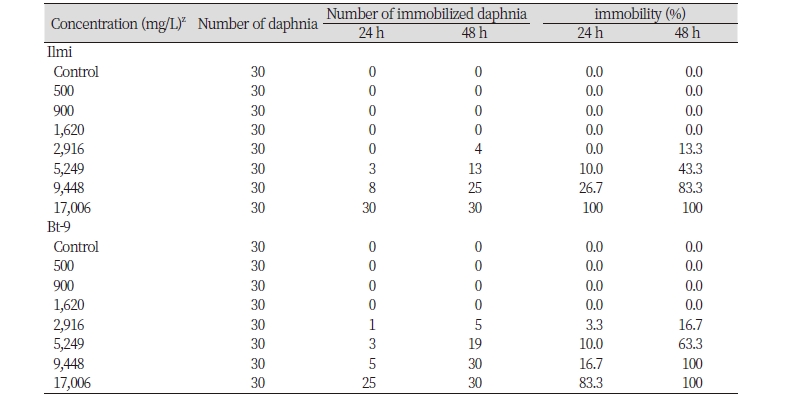
|
|
|
zActive ingredient: Ilmi; Bt-9 rice T6 100% |
|
일미벼와 해충저항성 Bt벼(Bt-9)의 급이에 의한 물벼룩에 대한 급성독성
일미벼와 해충저항성 Bt벼(Bt-9)의 물벼룩 급성 독성시험을 실시한 결과, 24시간-EC50은 일미벼는 10,218.17 μg/L, 해충저항성 Bt벼(Bt-9)는 12,675.67 μg/L로 측정되었으며, 48시간-EC50은 일미벼는 5,564.18 μg/L (95% 신뢰한계: 4,780.06 - 6,476.93 μg/L), 해충저항성 Bt벼(Bt-9)는 4,400.34 μg/L (95% 신뢰한계: 3,861.01 - 5,015.01 μg/L)로 해충저항성 Bt벼(Bt-9)가 다소 높은 급성독성을 보였으나, 95% 신뢰한계 구간 내의 차이로 유의성은 없는 것으로 나타났다(Table 5). 무영향농도는 일미벼와 해충저항성 Bt벼(Bt-9)의 두 품종에서 1,620 mg/L으로 확인되었다. 이는 mCry1Ac1 와 Bar (PAT) 유전자가 도입된 해충저항성 Bt벼(Bt-9) 및 일미벼에 의한 물벼룩 영향평가 결과, 상대적 동등성을 보였으며, mCry1Ac1 와 Bar 유전자의 단백질 노출이 물벼룩에 부정적인 영향을 미치지 않는 것으로 판단된다.
국외 GM작물 수입량 증가에 따른 수송로 주변 환경과 국내 개발 GM작물의 실용화에 따른 경작지 주변의 농업환경 생물종 설정 및 농업환경 생물종에 대한 영향 평가의 필요성이 요구되고 있다. 국내에서 개발된 GM벼인 병저항성 GM벼와 비타민 A 강화벼에 대한 미꾸리와 잉어의 영향평가 결과, 모품종과 유의함을 확인하였다(Oh et al., 2013; Oh et al., 2014b). 또한, 본 실험과 동일한 실험종인 물벼룩에 대한 비타민 A 강화벼, 병저항성 GM벼와 가뭄저항성 GM벼의 영향 평가에서도 본 실험의 결과와 같이 모품종인 일미벼와 낙동벼에서 유의적 차이가 없는 것으로 보고되었다. 모품종인 일미벼인 가뭄저항성 GM벼 실험에서 48시간-EC50은 48시간-EC50 2,243 mg/L (95% 신뢰한계: 1,858 - 2,704 μg/L)로 측정되었고, 모품종이 낙동벼인 비타민 A 강화벼 실험시 48시간-EC50은 3,655 μg/L (95% 신뢰한계: 3,156 - 4,232 μg/L), 병저항성 GM벼에서는 3,596 μg/L (95% 신뢰한계: 1,889 - 6,603 μg/L)로 측정되었다. 또한, 무영향농도는 가뭄저항성 GM벼에서는 625 mg/L, 병저항성 GM벼에서는 1,000 mg/L, 비타민 A 강화벼에서 1,800 mg/L으로 제시하고 있다(Oh et al., 2012; Oh et al., 2014a; Oh et al., 2018). 본 실험에서도 모품종인 일미벼는 기존의 일미벼와 낙동벼를 모품종으로 개발한 GM벼들과 달리 무영향 농도는 1,620 mg/L로 관측되었으며, 이는 중금속 및 농약에 대한 물벼룩의 EC50과 IC50값이 상당히 광범위 형성되어 물벼룩 급성독성 실험 시 실험 장소, 방법 및 조건의 차이가 있다는 Lee et al. (2007)의 보고와 같이 동일한 모품종임에도 불구하고 시료의 처리 조건뿐만 아니라 실험 재료의 재배 연도와 재배지의 지역적인 환경 요인 등에 의한 차이로 사료된다(Lee et al., 2007).
해충저항성 Bt벼(Bt-9)에서 발현된 mCry1Ac1 유전자는 기존의 Bacillus thuringiensis 유래 Cry1Ac 단백질과 아미노산 서열은 동일하나 벼에서 단백질 발현이 적합하도록 염기서열을 변형하였다. Cry1Ac 단백질은 알칼리성 pH와 표적 인시류 애벌레 중장의 단백질 분해효소에 의해 분해되어 살충 효과를 나타내나, 대부분의 곤충을 포함한 비표적 곤충들과 포유류에서는 Cry1Ac1을 분해할 수 없으므로 비독성 형태로 배설되게 된다(Aronson and shai, 2001). Cry1Ab 유전자가 도입된 Bt옥수수(MON810)을 이용하여 물벼룩 장기 영향 평가를 수행한 결과, 해충저항성 Bt옥수수가 비형질전환 옥수수에 비해 처리 5일차 내에서는 생존률의 차이는 나타나지 않았으나, 42일간 장기 영향 평가시에는 후세대에서의 산란수, 성숙기간, 세대전진시기 등에 차이를 나타냄을 보고하였다(Thomas et al., 2010). 본 실험은 환경생물 독성 시험기준과 방법(농촌진흥청 고시 제 2010-29호)에 준한 실험 방법으로 48시간 급성 독성 평가를 수행하였고, 이와 같은 결과는 Thomas 등의 처리 5일내의 결과와 일치됨을 확인하였다. 향후에 해충저항성 Bt벼(Bt-9)의 물벼룩에 대한 영향 평가를 42일 이상의 장기간 평가와 세대 전진에 따른 유전 독성에 대한 안전성 평가를 수행할 필요성이 있다고 사료된다.
국내 개발된 mCry1Ac1 와 Bar (PAT) 유전자가 도입된 해충저항성 Bt벼(Bt-9)가 수서 농업환경 생물인 물벼룩에 미치는 영향을 분석한 결과, 모품종인 일미벼와 유의적인 차이가 없음을 확인하였고 mCry1Ac1 단백질 노출이 물벼룩에 부정적인 영향을 미치지 않은 결과를 보였다. 따라서, 일미벼와 해충저항성 Bt벼(Bt-9)가 농경지 주변의 수로 및 하천 등의 환경에 방출되었을 때 수서생물인 물벼룩에 미치는 생물학적인 영향이 유사하다고 사료된다. 향후, 해충저항성 Bt벼(Bt-9)를 포함한 GM작물에 대한 환경위해성 평가 요소 중 농업환경 생물종에 대한 급성 독성 평가 시에 GM벼의 장기간 노출에 의한 생물종의 세대별에 따른 생식 독성 분석과 유전자 변이 평가가 수행되어야 할 것이며, 본 실험의 결과는 이를 위한 기초 자료로 활용될 수 있을 것이다.
Conclusion
본 연구는 토양 세균인 B. thuringiensis에서 유래한 해충저항성 유전자(mCry1Ac1)를 일미벼에 도입시킴으로써 혹명나방(Cnaphalocrocis medinalis)에 대하여 살충성을 나타내는 해충저항성 Bt벼(Bt-9)의 환경위해성 평가에 대한 프로토콜 및 가이드라인을 개발하고자 도입 유전자의 발현 검증과 수서 환경의 생물종인 물벼룩에 미치는 영향을 분석을 수행하였다.
해충저항성 Bt벼(Bt-9)에 도입된 mCry1Ac1 와 bar 유전자의 PCR 분석 결과, 해충저항성 Bt벼(Bt-9)에서만 특이적인 밴드가 검출되었으며, Cry1Ac1 단백질 발현을 ELISA 분석한 결과, 해충저항성 Bt벼(Bt-9)에서만 발현되었고, 발현량은 4.3 ± 0.2 μg/g 수준으로 검출되었다. 해충저항성 Bt벼(Bt-9)와 일미벼의 비표적생물체인 물벼룩에 대한 급성독성시험을 실시한 결과, 해충저항성 Bt벼(Bt-9)의 48시간-EC50은 4,400 mg/L (95% 신뢰한계는 3861.01 - 5015.01 mg/L), 무영향 농도(NOEC)는 1,620 mg/L 이었고, 일미벼는 48시간-EC50은 5,564 mg/L (95% 신뢰한계는 4780.03 - 6476.93 mg/L), 무영향농도는 1,620 mg/L 이었다. 처리기간 중 해충저항성 Bt벼(Bt-9)와 일미벼간의 급성독성에 영향을 미칠 수 있는 요인은 발생하지 않았다.
Authors Information
Myung-Ho Lim, National Institute of Agricultural Sciences, Researcher
Sung-Dug Oh, https://orcid.org/0000-0001-8574-6773
Ancheol Chang, National Institute of Agricultural Sciences, Senior Researcher
Doh-Won Yun, National Institute of Agricultural Sciences, Researcher
Yu-jin Lee, Korea Testing & Research Institute, Researcher