Introduction
암모니아(NH3)는 대기 중 황산, 질산 등과 반응하여 황산암모늄, 질산암모늄 등과 같은 2차 미세먼지(PM2.5, secondary particulate matter)를 생성하는 주요 미세먼지 원인물질이다(KEI, 2017). PM2.5는 2.5 μm 이하 크기의 미세먼지로, 10 μm 이하 크기의 미세먼지인 PM10보다 상대적으로 표면적이 넓어 질산염, 비소, 납, 수은 등과 같은 유해물질이 더 잘 흡착될 수 있다(Kim et al., 2002). PM2.5가 호흡기를 거쳐 폐 등에 침투하거나 혈관을 통해 체내로 유입되면 심장질환 및 뇌졸중과 같은 심혈관계질환 및 호흡기질환 발생에 큰 영향을 미친다(Miller et al., 2007). OECD 주요국의 PM2.5 배출량을 살펴보면 국내 배출량은 지속적인 감소 추세를 보이고 있으나 2017년 기준 25 ㎍ m-3으로 다른 선진국에 비해 여전히 높은 수준이다(HEI, 2019).
2016년 국내 NH3 총 배출량은 301,301 톤으로 추정되고 있으며, 농업부문에서 237,017 톤(78.7%)으로 가장 많이 배출되고 있다(NIER, 2019). 특히 토양에 질소질 비료인 요소를 시용할 경우 요소분해효소에 의한 가수분해가 빠르게 이루어지면서 암모늄 이온(NH4+S)을 형성하고 수산화 이온(OH-)과 반응하여 NH3로 전환되어 대기중으로 휘산된다. 일반적으로 NH3는 토양의 pH와 온도가 높을수록 발생량이 증가하며 토양 내 수분이 크게 감소할 경우 요소의 가수분해반응이 느리게 진행되어 NH3 휘산량이 감소한다(Ernst and Massey, 1960). NH4+S은 식물이 이용 가능한 양분 형태이지만 휘산 등에 의해 NH3로 전환되면서 질소 손실이 발생하게 된다. 이처럼 토양에서 발생한 NH3는 대기오염뿐만 아니라 토양내 양분 손실 등을 유발하기 때문에 이에 대한 연구의 필요성이 대두되고 있다.
Sharma and Forster (1993)에 따르면 피트모스는 200 m2g-1 이상의 넓은 표면적과 95%의 높은 공극률을 가진다. 또한 리그닌 등의 물질을 다량 포함하고 있어 알코올이나 알데하이드, 케톤과 같은 음하전 작용기를 가진다. 따라서 다량의 양이온을 흡착할 수 있기 때문에 양이온 흡착제로 사용되고 있다. Sonneveld and Voogt (2009)에 따르면 피트모스의 양이온치환용량(cation exchange capacity, CEC)은 56 - 158 cmolc kg-1 이고 pH 3.4 - 4.4로 산성을 나타낸다. 지올라이트는 삼차원 구조로 된 결정성 수산화 알루미노규산염(crystalline hydrated aluminosilicate)으로 정의된다. 이는 다공성 골격구조로 이루어져 있어 높은 CEC를 가진다. 지올라이트의 한 종류인 clinoptilolite는 상대적으로 매우 높은 CEC를 가지기 때문에 황화수소(H2S)나 이산화황(SO2)과 같은 유독가스의 효과적인 흡착제로 알려져 있다(Park and Suh, 2003). 일반적으로 지올라이트의 CEC는 40 - 120 cmolc kg-1으로 보고되고 있다(Witter and Kirchmann, 1989; Sonneveld and Voogt, 2009).
피트모스와 같은 유기물을 토양에 처리하였을 때 토양 내 물리성을 개선하고 수분 및 양분 보유능을 향상시킴으로써 토양의 개량효과를 위해 많이 이용되고 있다(Juncker and Madison, 1967; Kim and Choi, 2016). 또한 지올라이트와 같은 여러 무기물들은 안정적이고 다공성이며 수분 보유능을 향상시켜 피트모스를 대체할 수 있는 제재이다(Bigelow et al., 2004). He et al. (2002)은 clinoptilolite와 셀룰로스를 혼합처리했을 때 토양에서 발생하는 NH3 휘산량이 약 88% 감소하였고 이러한 결과는 두 제재를 처리함으로써 토양의 NH4+S 보유능을 높이고 토양 내 미생물의 질소 흡수 조건을 향상시킨 것에 기인한다고 보고하였다. 또한 피트모스와 지올라이트를 퇴비에 처리하였을 때 발생하는 NH3 휘산량을 각각 59%와 16%로 감소시켰다는 결과도 보고되었다(Witter and Kirchmann, 1989). 하지만 국내 농업부문에서 발생되는 NH3 휘산량의 정량적 평가와 저감방법에 관한 연구가 여전히 부족한 실정이다.
본 연구에서는 피트모스와 지올라이트를 토양에 처리할 경우 NH3 생성에 관여하는 NH4+S을 흡착함으로써 2차 미세먼지의 원인물질인 NH3의 휘산량을 줄일 수 있을 것으로 예상하였다. 따라서 본 연구는 가장 많이 사용되는 질소질 비료인 요소를 밭토양에 시용하였을 때, 피트모스와 지올라이트의 처리에 따른 NH3 발생 저감능을 비교하여 최적의 NH4+S 흡착제재를 선발하고자 실시되었다.
Materials and Methods
실내시험
본 연구를 수행하기 위해 경남 밀양시 부북면 오례리에 소재하는 부산대학교 부속농장 밭토양(35°30'07.6"N 128°43'16.0"E)을 공시토양으로 선정하였다. 공시토양의 pH는 6.91이었으며 총 질소 함량과 CEC는 각각 0.89 g kg-1 과 6.58 cmolc kg-1 이었다. 자세한 공시토양의 화학적 특성은 Table 1에 나타내었다.
|
Table 1. Chemical properties of the soil used in this study. 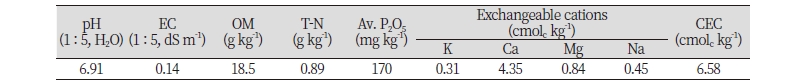
|
|
EC, electric conductivity; OM, organic matter; T-N, total nitrogen; Av. P2O5, available phosphate; CEC, cation exchange capacity. |
시판되는 피트모스와 시약용 지올라이트를 공시제재로 이용하였다. 사용된 피트모스와 지올라이트의 pH는 각각 3.59와 5.49였고 총 질소 함량은 0.93 g kg-1과 0.02 g kg-1 이었으며 CEC의 경우 60.8 cmolc kg-1과 92.9 cmolc kg-1으로 높은 수준을 나타내었다. 공시제재의 자세한 화학적 특성은 Table 2에 나타내었다.
|
Table 2. Chemical properties of the adsorbents used in this study. 
|
|
EC, electric conductivity; T-N, total nitrogen; CEC, cation exchange capacity. |
공시토양을 채취하여 풍건세토 후 2 mm 체로 걸러냈다. 200 mL 플라스틱 용기에 건조한 토양 100 g을 넣고 질소원으로서 요소를 354 N g m-2 수준으로 처리하였다. 또한 피트모스와 지올라이트를 각각 0, 1, 2, 4% (wt wt-1) 수준으로 처리한 후 토양과 고르게 섞어주었다. 토양 내 수분함량이 공극 부피의 60% 가 되도록 증류수를 첨가하였다. 수분함량을 유지하기 위해 매일 무게를 측정하여 감소한 수분을 보충하였다. 모든 처리구는 실험실 조건에서 12 일 동안 시험되었으며 3 반복 실시하였다.
NH3 가스 포집 및 측정
NH3 가스 포집을 위해 dynamic flux chamber (DFC) 장치를 모방한 실험 장치를 제작하였다(Siva et al., 1999). 공기 펌프와 유량계를 이용하여 챔버 내로 1.25 L min-1 의 공기가 연속적으로 유입되게 하였으며 챔버 내에서 발생한 NH3는 0.05 N H2SO4 용액 50 mL를 넣은 용기에 포집하였다. 요소 비료가 투입된 후 대부분의 NH3 가스가 초기에 배출되는 특성상 NH3 포집 시간을 점차 늘려갔다. NH3 가스는 시험 시작 후 5 일동안은 4 시간마다 포집을 진행하였으며, 이후 8 일차까지는 6 시간, 10 일차까지는 12 시간, 12 일차까지는 24 시간마다 포집을 진행하였다.
NH3 가스 포집 시 각 처리구의 챔버 내 온도를 측정하여 flux 계산에 이용하였다. 황산에 포집된 NH3 농도의 정량 분석을 위해 indophenol blue 법(Searle, 1984)을 통해 UV-VIS Spectrophotometer (Optizen 3200, Mecasys Co., Ltd., Korea)를 이용하여 667 nm의 파장에서 NH4+S 이온의 농도를 측정하였다.
토양 및 제재의 이화학적 특성분석
pH와 EC는 토양 및 제재와 증류수의 비를 각각 1 : 5 와 1 : 10 으로 침출하여 pH meter (Orion Star A215, Thermo Fisher Scientific, USA)로 측정하였다. 유기물 함량은 Wakley and Black법(Nelson and Sommers, 1996)을 이용하여 분석하였고 총 질소 함량은 Kjeldahl법을 이용하여 분석하였다. 유효인산의 함량은 Lancaster method (NIAST, 1988)을 이용하여 비색법으로 분석하였다. 치환성 양이온 K+, Ca2+, Na+, Mg2+을 분석하기 위해 침출액 1 M NH4OAc를 pH 7.0으로 보정한 후 침출하여 atomic absorption spectrometer (AA-7000, Shimadzu, Japan)로 측정하였다.
토양의 CEC를 측정하기 위해 토양 1 g을 centrifuge tube에 담고 1 M KCl 30 mL를 가하여 12 시간 동안 교반 한 후 원심분리하여 상등액을 따라내고 0.001 M KCl 30 mL와 증류수 30 mL를 가하여 30 분 동안 교반한 후 원심분리하여 상등액을 따라내는 과정을 각각 3 회씩 반복하여 남아있는 침출액을 씻어냈다. 1 M NH4NO3 30 mL를 가하여 12 시간 동안 교반한 후 원심분리하여 얻은 상등액을 여과하였으며 여과액 내 칼륨(K)의 함량을 atomic absorption spectrometer (AA-7000, Shimadzu, Japan)로 측정하여 CEC를 구하였다(Marcano-Martinez and McBride, 1989).
통계분석
시험토양의 pH와 CEC, NH3 휘산량의 통계 분석을 위해 Statistix 통계 프로그램(version 9.0, Analytical Software, Tallahassee, USA)을 이용하여 실시하였다. 처리간 차이를 비교하기 위하여 조사된 자료는 ANOVA 검증을 통하여 분석하였다. F-test 결과 값이 p < 0.05의 범위에서 유의한 경우에만 최소 유의차 검정(least significant difference test, LSD)을 실시하였다.
Results and Discussion
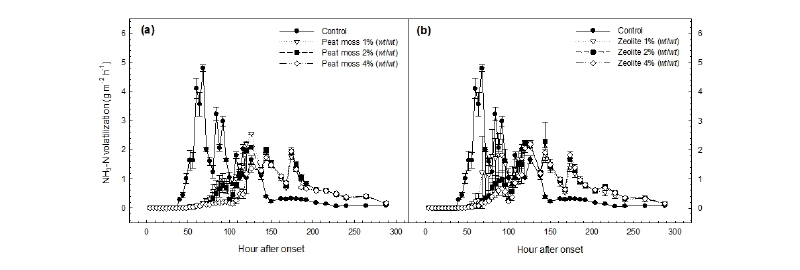
피트모스와 지올라이트를 수준별로 처리했을 때 발생하는 NH3 flux는 Fig. 1과 같다. 무처리구의 NH3 flux는 시험 시작 3 일 후에 가장 높은 값을 나타내었고 7 일 후부터 낮게 유지되었다. 반면에 피트모스 1, 2, 4% (wt wt-1) 처리구에서는 모두 시험 시작 6 일 후에 가장 높은 flux 값을 나타내었으며 8 일 후부터 낮게 유지되었다. 지올라이트 2, 4% (wt wt-1) 처리구에서는 피트모스와 동일한 경향이 나타났고 지올라이트 1% (wt wt-1) 처리구의 경우 4 일 후에 최대 flux 값을 나타내었다. 이러한 결과는 피트모스와 지올라이트의 높은 CEC의 영향으로 토양 내 NH4+S이 제재에 흡착됨으로써 초기 NH3 휘산량이 적고 최대 flux 값이 나타나는 시기가 지연된 것으로 판단된다. Kotoulas et al. (2019)은 폐수 속 NH4+S 제거를 위한 분말 형태의 지올라이트의 효과를 조사한 연구에서 90% 이상의 NH4+S-N이 24 시간 이내에 지올라이트에 흡착됨으로써 제거되었다고 보고하였다. Omar et al. (2010)은 토양에 요소 2.02 g을 sago 폐수와 함께 처리했을 때와 요소 2.02 g, sago 폐수, 지올라이트 1 g을 함께 처리했을 때 휘산량의 최대값이 각각 시험 시작 2 일과 4 일 후에 나타났다고 보고하였다.
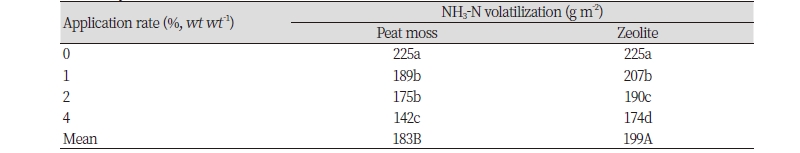
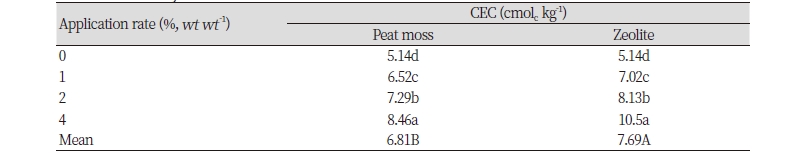
피트모스와 지올라이트의 처리량을 증가시킴에 따라 12 일간의 NH3 누적 배출량은 무처리구에 비해 유의하게 감소하였다(Table 3). 이러한 결과는 피트모스와 지올라이트가 높은 CEC를 가져 토양 내 CEC를 증가시켰고 이러한 피트모스와 지올라이트의 처리량을 증가시킴에 따라 토양 내 CEC 또한 증가하면서 NH3 누적 배출량이 감소한 것으로 판단된다(Table 2 and 4). 토양의 CEC가 높은 경우 NH4+S를 흡착함으로써 암모니아 휘산량이 감소한다고 알려져있다(Zhenghu and Honglang, 2000). 일반적으로 토양에서 요소의 가수분해반응은 다음과 같은 과정을 따른다(Hassanein et al., 2014).
CO(NH2)2 + 2 H2O → (NH4)2CO3 (1)
(NH4+)2CO3 + 2 H+ → 2 NH4+S + CO2 + H2O (2)
NH4+S + OH- → NH3 + H2O (3)
위 식과 같이 NH3는 NH4+S이 OH-과 반응하여 생성되기 때문에 NH4+S은 NH3 생성에 영향을 미치는 주요한 요인이라 할 수 있다. CEC가 높은 토양은 다량의 음전하를 가져 NH4+S과 같은 양이온이 흡착되므로 식 (3)과 같은 NH3로의 반응이 저해되는 것이다.
피트모스와 지올라이트의 누적 NH3 배출량의 평균값은 각각 183 g m-2 과 199 g m-2 이었다(Table 3). 지올라이트 처리구의 CEC가 더 높았음에도 불구하고 피트모스 처리구에서 누적 NH3 배출량이 지올라이트 처리구에 비해 유의하게 감소하였다(Table 4). 이러한 결과는 일반적으로 토양의 CEC가 증가할수록 NH3 휘산량이 감소한다는 것과 상반되는 것이었다. 따라서, 두 제재의 처리에 의해 NH4+S의 흡착이 증대되어 NH3 휘산량이 저감된 것 외에 다른 요인이 NH3 휘산량 저감에 영향을 미쳤음을 의미한다.
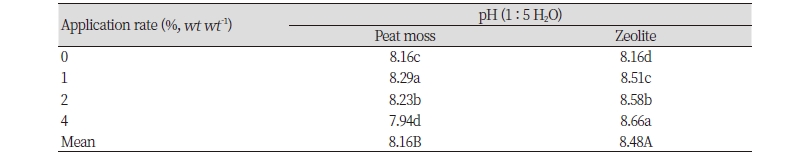
시험 후 토양의 pH를 측정한 결과를 Table 5에 나타내었다. 피트모스의 처리량을 증가시킴에 따라 처리구 내 토양의 pH가 감소하는 경향을 나타내었고 지올라이트의 경우 반대로 증가하는 경향을 나타내었다. 지올라이트를 처리했을 때 pH가 증가하는 것은 토양 내 CEC가 증가함에 따라 토양용액 내 수소 이온(H+)이 지올라이트 표면에 흡착되었기 때문이라고 판단된다. 이것은 토양에 지올라이트 1, 5, 10% (wt wt-1)를 처리했을 때 토양 내 CEC와 pH가 함께 증가했던 다른 연구와 일치하였다(Tsadilas et al., 1997). Lee et al. (2004)은 피트모스로부터 휴믹산, 풀빅산, 휴민을 순수분리하였을 때 각 성분이 피트모스 전체 유기물 함량의 각각 76, 18, 3%로 분포한다고 보고하였다. 피트모스를 처리했을 때 토양의 pH가 감소한 것은 이와 같은 휴믹물질들에 기인한 것으로 판단된다. 따라서 피트모스와 지올라이트를 처리했을 때 pH 평균값은 각각 8.16과 8.48로 지올라이트 처리구에서 더 높았으며 유의한 차이를 나타내었다. Ernst and Massey (1960)에 따르면 토양의 pH가 증가할수록 식 (3)과 같이 NH4+S이 OH-과 결합하여 NH3를 생성하므로 NH3 휘산량이 증가한다. 이에 따라 토양의 pH가 비교적 낮은 피트모스 처리구에서 암모니아 누적량이 지올라이트에 비해 감소한 것으로 판단된다. 이러한 결과와 비슷하게 황산을 이용하여 돼지와 소의 슬러리의 pH를 각각 6.0과 5.5로 조절하였을 때 NH4+S에서 NH3로의 반응이 저감됨으로써 슬러리에서 발생하는 암모니아 휘산량이 80% 저감되었다고 보고되었다(Stevens et al., 1989).
Conclusion
실내시험 기간 동안 요소 처리에 따른 NH3 휘산량은 무처리구에 비해 피트모스와 지올라이트 처리구에서 유의하게 감소하는 결과를 나타냈다. 피트모스와 지올라이트의 높은 CEC의 영향으로 토양 내 CEC가 증가하였고 지올라이트를 처리한 처리구의 CEC가 더 높아 NH4+S 흡착 반응을 통해 NH3 휘산량이 저감된 것으로 판단된다. 피트모스의 경우 CEC 증대뿐만 아니라 토양의 pH를 감소시켜 NH4+S이 NH3로 휘산되는 반응을 억제함으로써 지올라이트보다 NH3 휘산량 저감효과가 더 우수한 것으로 나타났다. 따라서 피트모스 또는 지올라이트를 농경지 밭토양에 시용할 경우 토양으로부터 발생하는 NH3 휘산량을 줄임으로써 주요 미세먼지 원인물질인 NH3의 저감방안으로 활용할 수 있을 것이다. 하지만 장기적으로 보았을 때, 토양의 환경조건이 달라짐에 따라 피트모스나 지올라이트에 흡착된 NH4+S이 다시 NH3로 전환될 수 있을 것으로 판단된다. 따라서 현장조건의 밭토양에 두 제재가 장기적으로 시용되었을 때 NH3의 배출양상에 대한 평가 및 토양의 이화학적 특성, 작물의 안전성 및 생산성에 미치는 영향에 대한 추가적인 연구가 필요할 것으로 판단된다.