Introduction
대두(Glycine max [L.] Merrill)는 비발효(두유, 두부, 두과류)와 발효(된장, 나토, sufu) 제품으로써 콩과식물 섭취를 많이 하는 국가인 아시아 지역에서 폭넓게 소비되고 있다. 대두를 기초로 하는 식품들은 고단백과 고지방일 뿐만 아니라 뛰어난 isoflavones과 같은 phytochemical 성분에 기인한 훌륭한 영양학적 및 기능적 품질의 우수성이 있는 것으로 알려졌다(Kishida et al., 2000). 생대두는 serine protease 억제제 또는 trypsin 억제제의 고농도 함유로 인하여 비반추동물에는 해로운 성분이다(Dunsford et al., 1989; Li et al., 1990). 대두박이란 대두로부터 기름 추출 후 남는 잔여 물질을 말하며, 조단백질 48% 정도 함유한다(Prado et al., 2015). 대두가 식품과 사료용으로 널리 이용되는 이유는 훌륭한 단백질 공급원인데 비해 항영양인자, 즉 phytic acid, 올리고당, 트립신 저해제와 같은 물질이 있어 이러한 물질을 제거하는 필요성이 증가되고 있다(Dunsford et al., 1989; Li et al., 1990). Phytoestrogen은 양이나 소에 불임을 야기하는 문제가 있고(Adams, 1995), lectin은 소장에서 영양소 흡수를 방해하고(Liener, 1994), phytic acid는 인(P) 과 아연(Z)의 흡수를 떨어뜨린다. 이러한 문제점을 해결하기 위해 FSBM (fermented soybean meal)에 관한 연구가 활발히 진행되고 있다. GRAS (generally recognized as safe) 미생물로 대두박을 발효를 시키면 항영양인자 성분들의 분해에 도움을 주기 때문에 이러한 방법이 이용되고 있다(Kishida et al., 2000; Chen et al., 2015). 또한 FSBM은 미생물의 단백분해 효소에 의해 발효되는 동안 대두의 알레르기원의 분해를 포함한 여러가지 이로운 점이 있다고 보고 했다(Hong et al., 2004; Song et al., 2008). FSBM은 항영양인자를 효과적으로 제거하고 영양가를 향상시킨다(Song et al., 2008). FSBM은 반추동물과 비반추동물의 어린 가축과 성축 모두에 기본 사료로 급여 시 유익한 효과가 연구되고 구축되어 왔다(Mathivanan et al., 2006; Yuan et al., 2013). Raffinose, stachyose 및 verbascose는 콩과식물 종자에서 상대적으로 높고 흔하게 발견되는 올리고당이다(Hammer, 1915). α-Galactosidase (EC 3.2.1.22)는 raffinose, stachyose 및 verbascos와 같은 올리고당에 존재하는 α-D-galactosidic linkage를 가수분해하여 비소화성 oligosaccharide의 이용성을 증가시킨다(Fontan et al., 2006). 미생물이 생산하는 α-Galactosidase의 이용성에 관한 연구는 Bifidobacterium adolescentis DSM 20083 (Hong et al., 2004), Aspergillus niger [16], Bacillus coagulas KM-1 (Liyan et al., 2013)이 보고되었다.
Kefir는 약한 신맛과 크림 같은 점조성을 가지는 산성의 유산-알코올 발효유로 Balkans, 동유럽, Caucasus 지역에서 유래되었다(Henry and Saini, 1989; Mathivanan et al., 2006). Kefir grain은 발효유 starter의 한 종류로 황백색으로 끈적끈적한 점착성의 다양한 크기로 유산균(108 CFU·g-1), 효모(106 - 107 CFU·g-1), 초산균(105 CFU·g-1)의 혼합미생물들이 공생으로 자라고 점질성 다당류로 구성되어있다(Hong et al., 2004; Amadou et al., 2011). 최근에 probiotic 미생물과 기능성 유기성분을 가진 건강에 유익한 식품들에 관해 관심이 높은 가운데, 건강증진 미생물인 kefir을 이용한 천연음용제품의 판매가 증가되고 있다(Li et al., 1990). 따라서 본 연구는 kefir의 효모, 유산균, 초산균의 유익균에 의해 발효된 FSBM의 특성을 밝힘으로써 FSBM을 가축에 급여했을 때 얻을 수 있는 간접적인 효과를 제시함에 있다.
Materials and Methods
발효대두박
대두박(Chungmi Bio Co., Ansung, Korera)의 성분은 조단백질 45%, 조지방 1% 이하, 조섬유 6%, 수분 11.5% 이다. Kefir DT (Danisco Deutschiand GmbH, Niebüll, Germany)를 스타터로 제조한 kefir를 starter로 대두박에 접종하고 수분 50%로 조정하여 27℃에서 72시간 발효시켰다. Kefir DT의 균주 조성은 Lactococcus lactis spp., Leuconistoc mesenteroides spp., Lactococcus lactis spp. cremoris, Lactococcus lactis spp. diacetylactis, Streptococcus thermophiles, kefir yeast이다. 즉 대조구(대두박), A: Kefir 60 mL + 대두박 500 g + 물 160 mL, B: Kefir 150 mL + 대두박 500 g + 물 70 mL, C: Kefir 250 mL + 대두박 500 g의 조합으로 발효시켰다.
발효대두박의 이화학적 분석
난소화성분 분석
대두박 발효물의 난소화성 성분인 stachyose 및 raffinose의 분해를 HPLC를 이용하여 분석하였다. 발효대두박 10 g을 100 mL 증류수에 충분히 추출시킨 다음 원심분리기(Mega 17R, Hanil Science Industrial, Daejeon, Korea)를 사용하여 6,000 rpm에서 10 min 동안 원심분리 하였다. 분리된 상등액을 채취하여 0.2 μm membrane filter를 사용하여 여과 후 HPLC system (600E Multisolvent Delivery System, Waters Associates, MA, USA)을 사용하여 당 성분을 분석하였다. 시료는 7725 injector (Rheodyne, USA)를 사용하여 20 μL를 주입하였고, 당은 Refractive Index Detector (2410 RI Detector, Waters Associates., MA, USA)를 사용하였다. Column은 SUPELCOGEL C-610H (38 cm × 7.8 mm, Sigma-Aldrich Co., Missouri, USA)을 사용하였고, column의 온도는 Waters Column Heater Module (serial #F98CHM095M)을 사용하여 40℃를 유지하였다. 이동상은 HPLC용 Water (TEDIA Company Inc., MA, USA)와 0.1% Phosphoric acid를 사용하여 1.0 mL·min-1의 유속으로 40분 동안 분석하였다. 실험에 사용된 표준물질은 Sigma-Aldrich Co. (Darmstadt, Germany)를 사용하였다.
단백질 분석
단백질 분석은 앞서 준비한 시료를 HPLC system (600E Multisolvent Delivery System, Waters Associates, MA, USA)을 사용하여 단백질을 분석하였다. 시료는 7725 injector (Rheodyne, MA, USA)를 사용하여 20 μL를 주입하였고, UV Detector (2487 UV detector, Waters Associate., MA, USA)를 사용하였다. 사용한 column은 Vydac218TPTM C18 (Grace Division Discovery Science, MD, USA)이다.
유기산 분석
유기산 분석은 앞서 준비한 시료를 HPLC Rheodyne 7725 injector (Sigma-Aldrich, Missuori, USA)를 사용하여 20 μL를 주입하였고, Detector는 유기산은 UV Detector (2487 UV detector, Waters Associate, MA, USA)를 사용하였다. Column은 SUPELCOGEL C-610H (38 cm × 7.8 mm, Sigma-Aldrich Co., Missouri, USA)을 사용하였고, column의 온도는 Waters Column Heater Module (serial #F98CHM095M)을 사용하여 40℃를 유지하였다. 이동상은 HPLC용 Water (TEDIA Company Inc., MA, USA)와 0.1% Phosphoric acid를 사용하여 1.0 mL·min-1의 유속으로 40분 동안 분석하였다. 실험에 사용된 표준물질은 Sigma-Aldrich Co. (Darmstadt, Germany)를 사용하였다.
효모수 및 유산균수 측정
72 시간 배양한 발효대두박 추출물을 10진 희석 후 유산균수는 BCP agar (Eiken Chmical Co., Ltd., Tochigi, Japan)에 접종 후 37℃에서, 효모수는 DifcoTM Potato Dextrose Agar (Becton, Dickinson and Company, MD, USA)에 접종 후 27℃에서 48시간 배양 후 colony의 수가 30 - 300개 범위로 나타낸 평판을 선별하여 계수하였다.
발효대두박의 생물활성
항산화 효과
항산화 효과는 2,2′-diphenyl-1-picrylhydrazyl radical (DPPH)방법으로 측정하였다. 즉 에탄올에 녹은 0.2 mM DPPH 용액 0.8 mL를 발효대두박 추출물 0.2 mL에 첨가하여 혼합한 후 어두운 곳에서 25℃로 10분 동안 방치시켰다. 그후 3,000 rpm에 1분 원심 분리하여 상등액을 ELISA reader를 이용하여 490 nm에서 흡광도를 측정하였다.
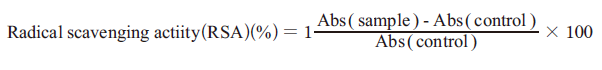 (1)
(1)
항염증 효과
항염증 효과는 mouse 기원인 RAW264.7 macrophage cell line에 발효대두박 추출물을 처리하여 염증성 cytokine의 발현양을 qRT-PCR로 측정하였다. 사용한 primer는 Table 1과 같다. 박테리아 외벽의 구성 성분인 lipopolysaccharide (LPS)로 염증 반응을 유도하여 대표적인 염증성 cytokine인 interleukin (IL)-1β, tumor necrosis factor (TNF)-α, and interleukin (IL)-6의 유전자 발현양을 quantitative real-time PCR (qRT-PCR)로 확인하였다. RAW 264.7 세포에 처리 조건은 6 well plate (SPL, Pocheon, Korea)에 RAW 264.7 세포를 1.5 × 105 cells·well-1로 배양액 2 mL에 분주 후 24 시간 배양 후 세포 생존율 실험 결과를 통해 최적화한 추출물 처리 농도인 1 mg·mL-1 농도로 추출물을 배양 중인 RAW 264.7 세포에 처리하고 24 시간 동안 시료를 처리한 후 LPS (E.coli 0127:B8, Sigma-Aldrich Co., Missouri, USA)를 1 μg·mL-1 농도로 첨가한 뒤 30분 동안 배양하였다. 각 추출물과 LPS를 처리한 RAW 264.7 세포의 RNA를 Cube Tissue RNA Mini Kit (PhileKorea, Daejeon, Korea)를 이용하여 RNA를 추출하였다. Qubit 2.0 Fluorometer (Invitrogen, Florida, USA)를 이용해 RNA를 정량한 뒤 총 RNA 1 μg에 Random Hexamer (100 pmol·μL-1) 1 μL, dNTP mix (10 mM) 1 μL를 넣은 후 DEPC-treated water를 이용해 총 부피를 10 μL로 조정하고 65℃에서 5분간 반응시킨 후, 즉시 얼음에 냉각시킨 다음, M-MLV reverse transcriptase (Promega, WI, USA) 1 μL, 5X M-MLV RT reaction buffer (Promega, WI, USA) 4 μL, RNase inhibitor (Promega, WI, USA) 1 μL, DEPC- treated water 4 μL를 각각 추가적으로 첨가한다. 10분간 실온에 둔 뒤에 1시간 동안 50℃에서 반응시켜 cDNA를 합성한 후 cDNA를 증류수로 1/10로 희석시켜 IL-1β, TNF-α, iNOS, IL-6와 β-actin의 mRNA 발현양을 qRT-PCR을 이용해 비교했다. qRT-PCR은 1/10로 희석시킨 cDNA 5 μL에 nuclease free water 2 μL, 2X Prime Q-mater Mix (GENET BIO, Daejeon, Korea) 10 μL, 10 pmol·μL-1 forward primer와 10 pmol·μL-1 reverse primer를 각각 1.5 μL씩 넣고 AriaMx (Agilent, CA, USA)를 이용하여 95℃에서 5분, 95℃에서 20초, 58℃에서 20초, 72℃에서 20초를 40 cycle 실시하여 수행하였다. Internal standard로 β-actin을 사용하여 IL-1β, TNF-α, IL-6의 mRNA 발현양을 보정한 뒤 LPS를 처리하지 않은 대조구에 대비한 상대적인 mRNA 발현을 확인하였다.
|
Table 1. qRT-PCR primer on inflammatory related cytokine. 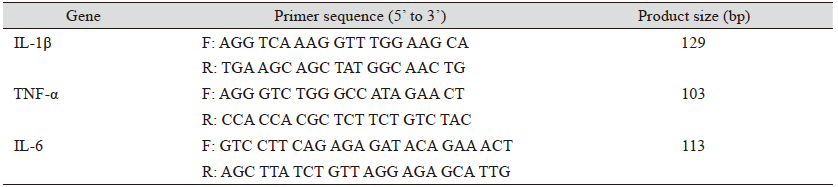
|
|
IL-1β, interleukin-1β; TNF-α, tumor necrosis factor-α; IL-6, interleukin-6. |
통계처리
통계분석은 SAS software (SAS Institute Inc., MA, USA)를 사용하여 평균, 표준편차를 분석하였다.
Results and Discussion
발효대두박의 이화학적 변화
난소화성분 저감
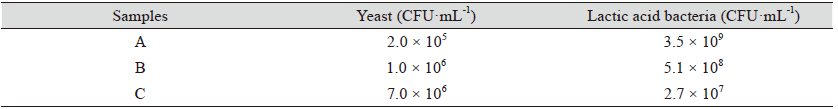
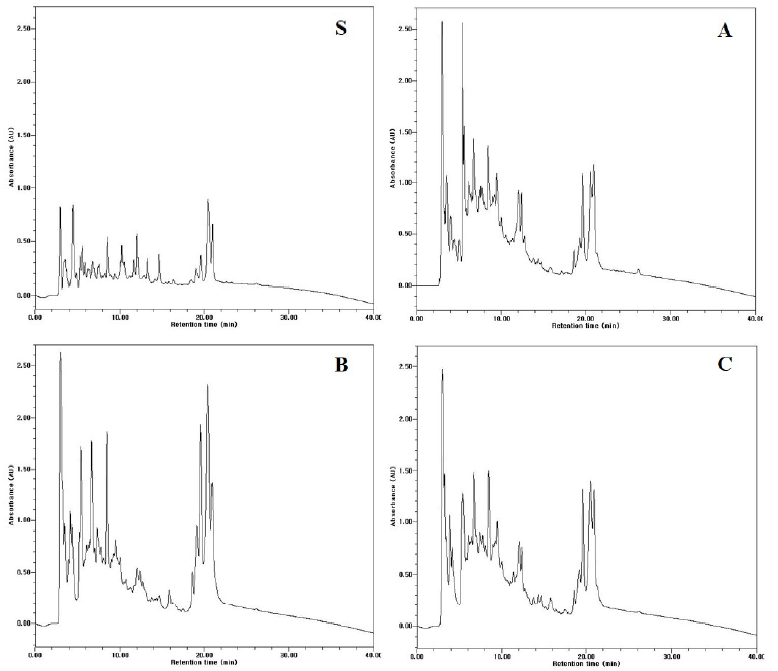
대두박의 난소화성분으로 알려진 Stachyose는 galactose 2분자, glucose 1분자, fructose 1분자로 구성된 4당류이고, raffinose는 galactose 1분자, glucose 1분자, fructose 1분자로 구성된 3당류이다. 대두박에 kefir를 접종하여 72시간 발효시킨 발효대두박을 HPLC로 분석한 결과는 Fig. 1과 같이 발효 조합에 따라 난소화성분인 stachyose와 raffinose의 저감 효과는 차이가 있었다. S: 대조구(대두박), A: Kefir 60 mL + 대두박 500 g + 물 160 mL, B: Kefir 150 mL + 대두박 500 g + 물 70 mL, C: Kefir 250 mL + 대두박 500 g의 조합 처리구 중 S는 대조구로 stachyose가 가장 많이 함유된 것으로 분석되었고, C는 A와 B 처리구에 비해 난소화성 유리당인 stachyose와 raffinose의 가수분해가 현저하게 일어났다. 이는 kefir 접종 양에 따라 효모와 유산균수의 차이에 기인하는 것으로 사료되는데, Table 2의 효모와 총균수를 보면 kefir 접종 양이 증가될수록 효모수는 증가하고 유산균수는 감소하는 경향을 보인다. C 처리구는 효모수는 7.0 × 106 로 가장 높고 유산균수는 2.7 × 107으로 가장 낮았다. 난소화성분을 분해하는 효소인 α-galactosidase는 주로 효모가 생산하고 이를 분해 후 이용하는 당 이용성 특성상 효모수가 가장 높은 C처리구가 난소화성분의 분해가 가장 활발하게 진행된 것으로 사료된다. 이로 인하여 생성된 glucose, galactose, fructose는 유산균과 효모가 발효 과정 중 많은 양을 이용하고 일부는 발효대두박에 남아있는 것으로 확인되었다. 한편 대두박 발효에 이용된 효모와 유산균에 관한 보고는 S. cerevisieae (Hassaan et al., 2015), L. plantarum (Amadou et al., 2010; Zhu et al., 2017)이 있다. 이와 같이 효모와 유산균은 모두 대두박을 발효시키는 starter로 이용되고 있다. 또한 멸치에서 분리한Bacillus coagulans KM-1은 stachyose와 raffinose의 분해능이 뛰어났고(Nam et al., 2014), Bacillus coagulans NRR1207도 대두박의 난소화성 성분인 stachyose와 raffinose를 분해하는데 탁월한 효과가 있었다(Ra et al., 2018).
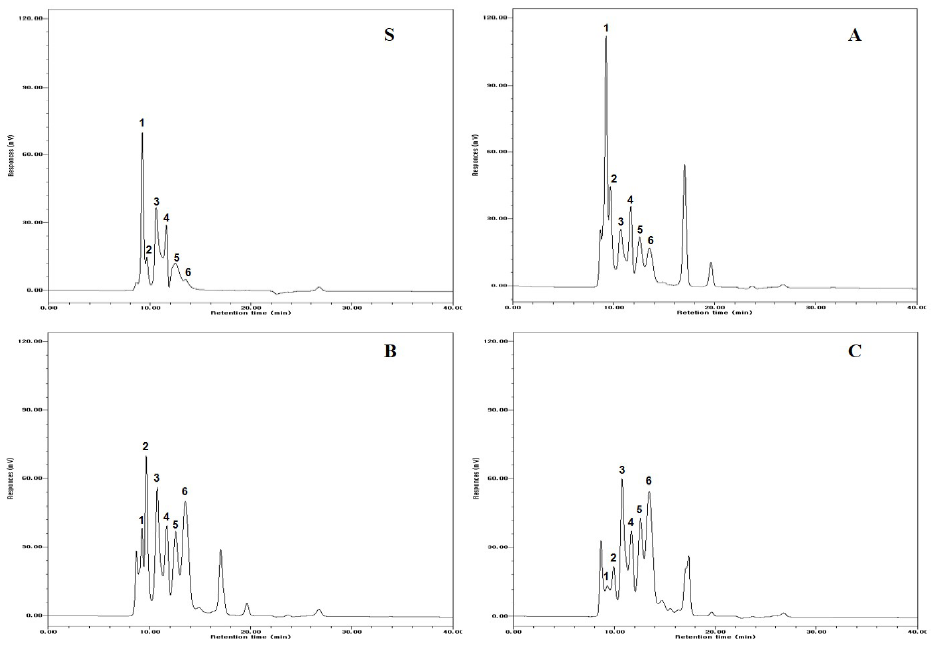
Fig. 1. Kinetic analysis of indigestible components fermented soybean meal by kefir at 37℃ for 72 h. (S) Soybean meal. (A) Kefir 60 mL + soybean meal 500 g + water 160 mL. (B) Kefir 150 mL + soybean meal 500 g + water 70 mL. (C) Kefir 250 mL + soybean meal 500 g. 1, starchyose; 2, raffinose; 3, lactose and sucrose; 4, Glucose; 5, galactose; 6, fructose.
발효대두박의 단백질 분해
발효대두박 추출물의 단백질 분해를 분석한 결과는 Fig. 2에 나타난 바와 같이 처리구에 따른 변화의 차이가 크다. S: 대조구(대두박), A: Kefir 60 mL + 대두박 500 g + 물 160 mL, B: Kefir 150 mL + 대두박 500 g + 물 70 mL, C: Kefir 250 mL + 대두박 500 g의 조합으로 발효시킨 발효대두박 중 C 처리구가 대조구 S에 비해 가장 활발하게 단백질이 가수분해되어 다양한 저분자 펩타이드들이 생성되었음을 알 수 있었다. 대조구인 S는 단백질이 분리된 peak의 분리시간대가 2~22분 사이에 골고루 분포된 것에 비해 A, B, C는 분리시간대가 크게 3개의 그룹으로 peak가 형성됨을 알 수 있다. 즉 2 - 10분, 10 - 18분, 그리고 18 - 22분에 peak가 형성되었고 다양한 저분자 펩타이드가 생성되었다. 이는 kefir의 효모와 유산균이 생산하는 단백질 분해 효소에 의해 대두박 발효과정 중 단백질이 활발하게 가수분해되었고, 이에 따라 저분자 펩타이드가 다양하게 생성됨으로 가축이 섭취했을 때 소화흡수율이 높고 증체에도 큰 영향을 미친다. S. cerevisieae로 발효시킨 대두박은 단백질 함량이 2.62% 증가하였고 phytic acid와 trypsin inhibitor가 감소하였다(Henry and Saini, 1989). 한편 L. plantarum, B. subtils, S. cerevisieae로 발효시킨 대두박을 자돈에 급여했을 때 체중이 증가되었고 사료 섭취는 감소했다(Zhu et al., 2017).
발효대두박의 유기산 생성
발효대두박의 조합에 따른 유기산 생성은 Fig. 3에 나타난 바와 같이 대조구에 비해 A, B, C 모두 유기산 생성이 현저하게 증가되었다. S: 대조구(대두박)에 비해 A: Kefir 60 mL + 대두박 500 g + 물 160 mL, B: Kefir 150 mL + 대두박 500 g + 물 70 mL, C: Kefir 250 mL + 대두박 500 g의 조합으로 처리한 경우 kefir 양을 가장 적게 첨가한 A가 유기산(phytic acid, malic acid, malonic acid, lactic acid, fumaric acid) 생성이 높았다. 특히 B, C에 비해 phytic acid, malic acid, lactic acid의 생산이 현저히 높았다. 이는 Table 2의 처리구에 따른 효모수와 유산균수의 차이에 기인한 것으로 사료된다. 즉 A는 B와 C처리구에 비해 총균수가 3.5 × 109으로 가장 높았고 이는 미생물의 대사산물들중 특정 유기산 생성을 가장 많이 하였다. 이 중 phytic acid는 대두에 0.4 - 6.8% 함유된 성분으로 대두의 부산물인 대두박으로 이행된 것이다. Phytic acid는 미네랄인 Ca2+, Zn2+, Fe+3 등을 chelating하는 기능이 있어 사람과 가축에 미네랄 흡수를 저해하므로 미네랄 결핍을 초래하는 것으로 알려져 있다(Heaney et al., 1991). B와 C의 결과와 같이 효모의 양을 증가시켜 발효시킨 대두박은 phytase에 의해 phytic acid가 분해되어 A 처리구에 비해 현저히 감소되었다. 한편 Rabadi 음식에 함유된 phytic acid의 함량에 관한 연구 결과를 보면 발효 시간을 증가함에 따라 phytic acid는 감소했는데 9시간 발효 후 27 - 30% 정도 감소했다고 보고했다(Dhankher and Chauhan, 1987). Malic acid (능금산)는 발효 과정 중 효모에 의해 생산되고 소비되는 것으로 A에 비해 B와 C 처리구에서 현저하게 감소되었다. 이는 B와 C의 효모수가 증가함에 따라 malic acid의 소비도 증가하기 때문으로 사료된다. 한편 효모인 Saccharomyces cerevisae를 이용하여 포도를 발효하여 wine을 제조할 경우 Saccharomyces cerevisae가 유기산들 중 malic acid를 소비한다고 보고하였다(Serafini et al., 2014). 또한 A에 비해 B와 C는 lactic acid의 양이 감소하였는데 이는 Table 2에 제시된 유산균수의 감소에 기인한 것이다. 발효 과정 중 생산된 유기산들로 인하여 발효대두박에 유해미생물들이 성장하는 것을 억제하므로 발효대두박의 위생 안전에 크게 기여한다고 생각된다.
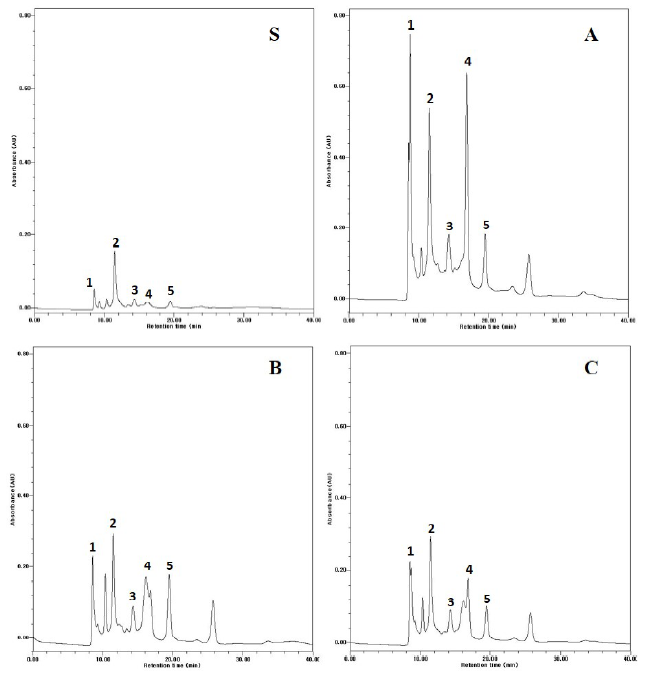
Fig. 3. Kinetic analysis of organic acid of fermented soybean meal by kefir for 72 h. (S) Soybean meal. (A) Kefir 60 mL + soybean meal 500 g + water 160 mL. (B) Kefir 150 mL + soybean meal 500 g + water 70 mL. (C) Kefir 250 mL + soybean meal 500 g. 1, phytic acid; 2, malic acid; 3, malonic acid; 4, lactic acid; 5, fumaric acid.
발효대두박의 효모와 유산균수
발효대두박의 조합에 따른 미생물의 생균수는 Table 2에 나타난 바와 같이 처리구에 따라 차이가 있다. A: Kefir 60 mL + 대두박 500 g + 물 160 mL 처리구는 유산균수 3.5 × 109 CFU·mL-1, 효모 2.0 × 105 CFU·mL-1이었고, B: Kefir 150 mL + 대두박 500 g + 물 70 mL 처리구는 유산균수 5.1 × 108 CFU·mL-1, 효모 1.0 × 106 CFU·mL-1이었고, C: Kefir 250 mL + 대두박 500 g 처리구는 유산균수 2.7 × 107 CFU·mL-1, 효모 7.0 × 106 CFU·mL-1으로 나타났다. 즉 A, B, C 모두에서 유산균수가 효모수에 비해 높게 나타났다. 또한 A, B, C에서 kefir 접종 양이 많을 수록 효모수는 증가하였고 유산균수는 감소하였는데, 이는 72시간 동안 발효하는 과정에서 탄소원의 이용성과 효모와 유산균 상호간에 acetic acid와 lactic acid의 대사물질이 영향을 미친 것으로 사료된다.
발효대두박의 생물활성 기능
항산화 효과
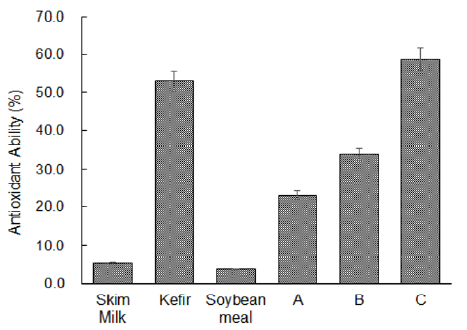
발효대두박의 조합에 따른 항산화 효과는 Fig. 4에 제시한 바와 같다. 대조구인 탈지유, kefir, 대두박, 발효대두박 4종류 중 kefir가 약 52%로 가장 높게 나타났다. S: 대조구(대두박), A: Kefir 60 mL + 대두박 500 g + 물 160 mL, B: Kefir 150 mL + 대두박 500 g + 물 70 mL, C: Kefir 250 mL + 대두박 500 g 조합의 항산화효과는 A가 26%, B는 47%, C는 58%로 C가 가장 높게 나타났는데, 이는 발효대두박의 조합에서 kefir 첨가량이 가장 높은 것에 기인하는 것으로 판단된다. 대두박의 발효 후 생성되는 특정 아미노산인 histidine, serine, valine, lysine이 증가함에 따라 항산화 효과 증가와 관계가 있다(Adams, 1995). 또한 대두박의 발효 후 증가하는 phenolic 성분들의 농도는 항산화와 금속 chelating 효과를 증가시킨다(Moktan et al., 2008).
항염증 작용
항염증 작용은 염증관련 cytokine의 발현을 억제하는 효과로 나타내었다. Fig. 5에 제시한 바와 같이 마우스 대식세포인 RAW264.7을 이용하여 실험을 수행하였다. 발효대두박 추출물의 세포독성 여부는 그래프 A에 제시된 바와 같이 A, B, C 조합 모두에서 세포독성이 없는 것으로 확인되었다. 항염증 효과는 그래프 B에 제시된 바와 같이 항염증 cytokine 발현에 미치는 영향은 S: 대조구(대두박), A: Kefir 60 mL + 대두박 500 g + 물 160 mL, B: Kefir 150 mL + 대두박 500 g + 물 70 mL, C: Kefir 250 mL + 대두박 500 g 조합 모두 positive control에 비해 현저하게 저하되었다. 염증 관련 cytokine인 IL-1β, TNF-α, IL-6의 mRNA 발현 저해 수준은 IL-1β는 약 80% 전후이고, TNF-α는 40% 전후, IL-6는 약 65% 전후로 나타났다. 따라서 kefir와 Bacillus coagulans NRR1207로 발효시킨 대두박은 염증 반응에 관여하는 cytokine의 조절 기능이 있는 것으로 사료된다. 자돈에 발효대두박을 급여 후 혈액의 immoglobulin인 IgG, IgM, IgA의 농도가 높은 수준으로 증가하였다(Zhu et al., 2017).
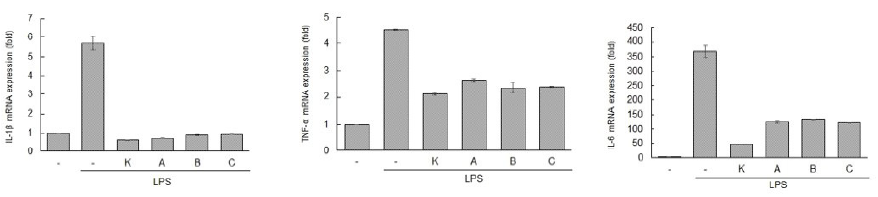
Fig. 5. Inhibition effect of anti-inflammatory cytokine (interleukin [IL]-1β, tumor necrosis factor [TNF]-α, interleukin [IL]-6) of fermented soybean meal by kefir for 72 h. Each bar represents the average ± SD of three independent experiments. Lipopolysaccharide (LPS) (1 μg·mL-1) treatment alone served as a positive control. K, kefir; A, kefir 60 mL + soybean meal 500 g + water 160 mL; B, kefir 150 mL + soybean meal 500 g + water 70 mL; C, kefir 250 mL + soybean meal 500 g.
Conclusion
효모와 유산균은 콩에서 발견되는 4당류인 stachyose, 3당류인 raffinose와 같은 난소화성분인 당류 성분을 가수분해할 수 있다. 본 연구는 효모와 유산균으로 구성되어 있는 kefir를 starter로 사용하여 72시간 동안 발효시킨 대두박의 생화학적 특성을 밝혔다. Kefir 150 mL + 대두박 500 g + 물 70 mL로 발효시킨 처리구에서 난소화성분인 raffinose와 stachyose는 대부분 가수분해되었고 glucose, galactose, fructose를 생성하였다. 대두박의 단백질은 kefir 150 mL + 대두박 500 g + 물 70 mL 발효구에서 대부분 분해되어 다른 처리구에 비해 저분자 peptides를 많이 생성하였다. 발효 대두박의 효모 수는 kefir 250 mL + 대두박 500 g에서 최고 7.0 × 106 CFU·mL-1로 나타났다. 유산균수는 kefir 70 mL + 대두박 500 g 발효구에서 3.5 × 109 CFU·mL-1로 가장 높았다. 항산화 효과는 kefir 250 mL + 대두박 500 g 발효구에서 57 %로 가장 높았다. 염증 관련 cytokine (IL-1β, TNF-α, IL-6)의 발현은 positive control에 비해 모든 발효구에서 유의하게 억제되었다. 이러한 결과는 kefir에 의해 발효된 대두박이 항염증 및 항산화 활성을 나타내기 때문에 사료제조뿐만 아니라 대두박의 난소화 성분을 가수분해하는데 이용될 수 있음을 시사한다.
Authors Information
Seok Han Ra, Chungmi Bio-Company, Chief of Research Institute
Gereltuya Renchinkhand, http://orcid.org/0000-0003-2107-0430
Kwang-Yeon Kim, http://orcid.org/0000-0003-3770-8005
Hyung Churl Bae, http://orcid.org/0000-0003-0781-6611
Myoung Soo Nam, http://orcid.org/0000-0003-0866-1041