Introduction
돼지의 장기를 영장류에게 이식하기 위한 연구가 진행되었으나 유전적인 변형이 일어나지 않은 돼지의 장기를 이식하면 초급성 면역 거부반응이 일어나게 되어 이식된 장기의 괴사를 초래하는 결과를 나타내었다(Lexer et al., 1986). 이를 해결하기 위하여 초급성 면역거부반응의 원인 유전자로 알려진 Galα1-3Galβ1-4GlcNAc (α1,3Gal)을 합성하는 효소인 α1,3-galactosyltransferase (α1,3GalT; GT)가 결여된 돼지(GTKO pig)가 생산되었고(Phelps et al., 2003; Kolber-Simonds et al., 2004), 이 후 추가로 급성, 혈관성 거부반응 등도 억제시킬 수 있는 다양한 인간 유전자가 도입된 형질전환 돼지가 개발되고 있다(Schuurman et al., 2003; Yang and Sykes, 2007; Aigner et al., 2010). 또한, 형질전환 돼지 개발에 필요한 미성숙 난자를 체외에서 성숙시키고 수정란을 발달시키기 위한 체외배양 연구도 진행되고 있다 (Lin et al., 2017). 이전 연구에서 GTKO 돼지(Hwang et al., 2012), GTKO에 사람 보체 조절단백질 membrane cofactor protein (MCP)이 추가된 GTKO/MCP 돼지(Ko et al., 2013), 최근에 MCP 유전자의 단백질 발현 효율을 향상하였고, 동시에 사람 혈액응고 억제 단백질 thrombomodulin (TBM)을 혈관에서 특이적으로 발현하는 GTKO/MCP/TBM 돼지(Lee et al., 2020)를 개발하였다.
돼지에서 인간 면역조절인자 유전자를 발현시키기 위해 주로 cytomegalovirus (CMV) 혹은 cytomegalovirus enhancer/chicken β-actin (CAG)와 같은 바이러스 유래 프로모터 서열이 사용되어 왔다(Phelps et al., 2009; Yeom et al., 2012; Zhang et al., 2012). 그러나 CMV나 CAG와 같은 바이러스 유래의 서열을 가진 프로모터는 프로모터 서열 내에 과도한 메틸레이션 현상이 발생하는 후성유전적변형(epigenetic modification)에 의해 형질전환 돼지가 세대를 거듭할수록 목표유전자의 발현 수준이 감소하는 문제점을 가지고 있고(Hofmann et al., 2006; Kong et al., 2009), 또한 바이러스 서열이 형질전환 돼지에서 높은 수준으로 발견되고 있는 실정이다(Hofmann et al., 2003; Whitelaw et al., 2004). 한편, 인위적으로 과도하게 발현되는 유전자로 인해 형질 전환된 동물의 생리적인 부작용을 초래할 수 있는 위험이 존재하며(Yum et al., 2016), 이에따라 현재의 연구는 intercellular adhesion molecule 2 (ICAM2) 프로모터와 같이 혈관 조직 특이적인 프로모터를 사용하여 형질전환 돼지를 생산하는 추세에 있으나(Nottle et al., 2001; Cowan et al., 2003), 이종장기이식시 발생하는 거부반응을 안정적으로 억제할 수 있는 형질전환 돼지의 생산을 위해서는 강력하고 지속적이면서도 면역 거부반응이 일어나는 특정 시기에 목표 유전자를 발현시킬 수 있는 프로모터가 필요하다.
초급성 면역반응이 억제된 이후에는 혈관성 면역거부반응이 일어나게 되는데 이는 이식받은 동물의 tissue factor (Tf) 단백질이 coagulation factor VII/VIIa와 복합체를 형성함으로서 결과적으로 Factor X를 활성화 시켜 촉발된다고 알려져 있고(Osterud and Rapaport, 1977), TF 단백질은 백혈구, 대식 세포와 같은 다양한 면역 세포와 혈관내피세포에서 염증 자극에 의해 광범위하게 발현이 조절된다(Ahrens et al., 2015). 뿐만 아니라, 염증반응, 종양의 전이 및 배아의 발생단계에서도 중요한 역할을 한다고 보고되고 있다(Mueller et al., 1992; Luther et al., 1996). 실제로, TF 단백질을 제거한 쥐의 경우 배아단계에서 죽는(embryonic lethal) 표현형이 나타난다(Toomey et al., 1996). 특히, 이종 장기를 이식받은 원숭이에서 TF 단백질이 높은 수준으로 발현된다고 보고되었고(Gollackner et al., 2003; Shimizu et al., 2005; Lin et al., 2010), 이전 연구에서 돼지 심장을 이식받은 후 사망한 원숭이에서 이식된 돼지의 심장 조직을 채취한 후 differentially expressed genes (DEGs) 분석을 수행한 결과 발현이 증가하는 유전자 중에 TF도 포함되었다(Park et al., 2021).
따라서, 본 연구에서는 이종이식 돼지 심장 조직에서 실제로 TF 유전자 발현이 증가하는 것을 확인하였다. 이종이식 시에 선택적으로 발현이 증가하는 TF 유전자의 발현 양상에 주목하여 상기 유전자의 프로모터를 제작하였고, 면역 반응이 일어나는 특정 시기에 유전자의 발현을 선택적으로 조절할 수 있는 지를 검증하였다.
Materials and Methods
돼지 혈관 내피 세포(porcine aortic endothelial cell, pAEC)분리 및 배양
pAEC의 분리는 이전의 연구를 참고하였다(No et al., 2018). 서술하면, GTKO 돼지의 대동맥을 채취하여 절개하여 내벽을 0.2% (v/v) 콜라겐분해효소 타입 1(Sigma-Aldrich, Missouri, USA)이 첨가된 12 well 플레이트에 부착시켜 37℃에서 3시간 동안 배양하였다. 이 후, 분리되어 나온 세포를 회수하여 0.1% 젤라틴이 코팅된 플레이트로 옮기고 혈관내피세포 전용 배지인 endothelial basal medium-2 (EBM-2)에 endothelial growth medium-2 (EGM-2; Lonza, Koln, Germany)를 첨가하여 37℃ 인큐베이터에서 배양하여 분석에 사용하였다.
혈청 처리
국립축산과학원이 보유하고 있는 GTKO 돼지에서 5 mL의 채혈을 한 후 혈청을 분리하기 위해 BD Vacutainer® SST™II Advance (Becton Dickinson Company, New Jersey, USA) 튜브에 담아 30분간 4℃ 냉장고에 보관하였다. 4℃로 설정된 원심분리기에서 2,000 rpm에서 30분간 원심분리하여 맑은 상층액을 채취하여 15% 농도로 배지에 직접 첨가하여 사용하였다. 사람 혈청(Pooled human complement serum)은 Innovate research (Ontario, Canada)에서 구입하여 사용하였다.
TF 프로모터 합성 및 발현 벡터 제작
TF 프로모터의 활용 가능성을 평가하기 위해 3종류의 프로모터를 합성하였다 (Thermo Fisher Scientific, 미국). 돼지 TF 유전자의 혈청 반응 부위를 포함시켜 엑손 1의 일부 서열을 연결시킨 787 bp의 프로모터, 혈청 반응 부위 앞쪽에 459 bp의 염기서열이 추가된 1,246 bp의 프로모터, 그리고 사람 TF 유래의 508 bp 길이의 프로모터를 각각 합성하였다. 각각의 프로모터 5’의 가장 앞쪽에는 사람 AP-1 전사인자 결합부위를 추가하였다. 또한 발현 벡터를 제작하기 위해 5’말단에는 Kpn I 제한효소 인식 서열을 추가하였고, 3’말단에는 Xho I 제한 효소 인식 서열을 합성한 각각의 프로모터 서열에 추가하였다. 제작한 3종의 프로모터를 Kpn I 및 Xho I 제한 효소로 자른 후, pGL4-basic luciferase 벡터(Promega, WA, USA)에 도입하였고 각각 porcine TF (pTF) 350, pTF809 및 human TF (hTF) 380으로 명명하였다.
발현 벡터 도입
발현 벡터는 Nucleofector (Lonza, Koln, Germany) 장치에 내장되어 있는 S-005 프로그램을 이용하여 1 × 106 Cells/cuvette 농도의 세포에 AmaxaTM Basic Nucleofector™ Kits for Mammalian Endothelial Cells (Lonza, Koln, Germany)를 이용하여 유전자를 도입하였다.
Luciferase assay
pGL4 luciferase reporter 벡터에 도입한 3종의 프로모터 및 대조군으로서 CAG 프로모터의 활성을 측정하기 위해, Dual luciferase® reporter assay system (Promega, WA, USA)을 사용하여 제조사에서 설명한 방법으로 수행하였다. Firefly 및 Renilla의 활성은 Centro LB 960 Luminometer (Berthold, Bad Wildbad, Germany) 장치를 이용하여 측정하였다.
RNA 추출 및 cDNA 합성
실시간 PCR을 수행하기 위해, 동결한 조직을 Trizol 용액(Thermo Fisher Scientific, MA, USA)이 첨가된 튜브에서 homogenizer를 사용하여 분쇄한 후, 제조사가 제공한 방법을 이용하여 total RNA를 추출하였다. 발현 벡터가 도입된 세포의 경우 cell scraper 혹은 trypsin을 사용하여 세포를 회수한 후 RNeasy mini kit (Qiagen, Hilden, Germany)로 회사에서 제공하는 방법에 따라 total RNA를 추출하였다. 조직과 세포에서 추출한 total RNA 중 200 ng의 total RNA를 주형으로 하여 Superscript IV First-Strand Synthesis System for RT-PCR (Invitrogen, CA, USA) 키트를 사용하여 합성하였다.
유전자 발현 분석
합성된 cDNA를 2X Power SYBR green PCR master mix (Thermo Fisher Scientific, MA, USA)를 이용하여 돼지 Tf, elongation factor 1a (Ef1a), Icam2, Tbm, Mcp, interleukin 6 (Il-6) 및 glyceraldehyde 3-phosphate dehydrogenase (Gapdh) 유전자의 Forward 그리고 Reverse 프라이머를 10 pM로 첨가한 후, StepOnePlus real-time PCR system 장치 (Applied Biosystems, CA, USA)를 이용하여 95℃에서 15초간의 DNA denaturation 과 60℃에서 1분간의 annealing 및 extension 과정을 1 반복으로 지정하여 40회 반복하였다. 이후 얻어진 유전자 별 Ct값을 이용하여 delta-delta Ct방법으로 발현 정도를 분석하였다. 분석한 각 유전자의 프라이머 염기서열은 Table 1에 정리하였다.
통계처리
통계 분석은 IBM SPSS 21 (IBM, New York, USA)프로그램을 이용하여 분석하였다. 돼지 심장 조직에서의 유전자 발현 분석은 T-test를 이용하였으며, 세포의 유전자 발현 분석은 일원 분산 분석(one-way ANOVA)방법을 이용하여 비교하였다. 사후 검정은 Turkey 방법을 이용하여 분석하였고, p값이 0.05 미만일 때 유의적인 차이가 있다고 판단하였다.
Results and Discussion
돼지 Tissue factor 유전자 발현 특성
GTKO 돼지의 심장을 이식받아 거부반응으로 9일 후 사망한 원숭이에서 이식한 돼지의 심장을 채취하여 DEGs를 분석한 유전자 목록(Park et al., 2021) 중에서 발현이 증가한 목록에 포함된 Tf 유전자와 목록에서 제외된 Ef1a, Mcp, Tbm, Icam2 유전자의 발현을 분석하였다. 그 결과, DEGs 결과와 동일하게 Tf 유전자는 발현이 유의적으로 증가한 반면 그 외 유전자의 발현 수준에는 변화가 없었다(Fig. 1). 이러한 결과는 현재까지 보고된 바 있는 이종이식 연구의 결과와 유사하며(Bennet et al., 2000; Moberg et al., 2002; Ji et al., 2011), Tf 유전자는 이종이식에 의한 거부반응에 특이적으로 반응하여 발현이 조절되는 유전자라는 사실을 확인할 수 있었다. 초급성 면역반응 이후의 혈관성 거부반응은 이식한 돼지 장기의 혈관내피세포와 혈액 내에 존재하는 다양한 면역세포의 상호작용에 의해 유발된다. 체외 환경에서 거부반응을 재현하기 위해 GTKO 돼지의 혈관내피세포(pAEC)를 분리한 후 배양하였다. 배양액에 돼지와 사람의 혈청을 5%에서 25%까지 첨가한 후 5시간 동안 배양한 pAEC에서 RNA를 추출한 후 Fig. 1의 Tf, Ef1a, Mcp, Tbm 유전자와 잘 알려진 염증반응 관련 유전자 Il-6의 발현 수준을 분석하였다. Tf 유전자는 5%의 사람 혈청 첨가만으로도 발현이 유의적으로 증가하였고, 15% 농도에서 가장 높은 수준으로 발현하였다. 이에 반해 Ef1a, Mcp, Tbm 유전자의 발현 변화는 관찰되지 않았다. Il-6 유전자는 25%의 고농도 사람 혈청 처리에 의해 발현이 증가하였다(Fig. 2A). 15%의 사람 혈청을 1시간에서 7시간 첨가한 환경에서 pAEC를 배양한 결과 1시간부터 Tf 유전자의 발현이 유의적으로 증가하였고, Ef1a, Mcp, Tbm, Il-6 유전자의 유의적인 발현 변화는 확인되지 않았다(Fig. 2B).
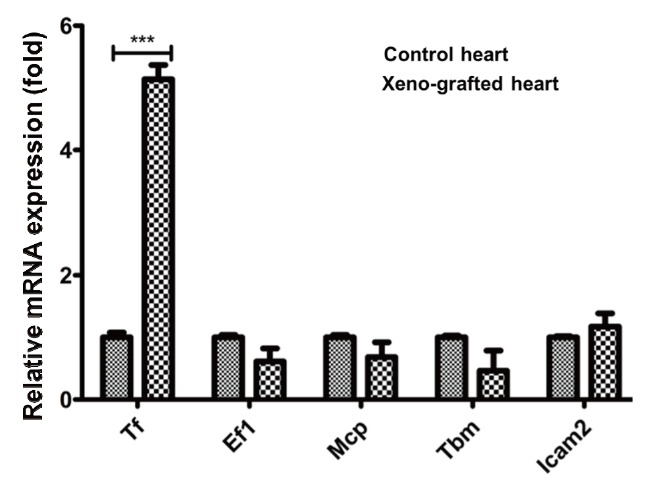
Fig. 1.Upregulation of porcine tissue factor gene in rejected pig heart (Xeno-grafted heart) after xenotransplantation into monkey compare with non-transplanted pig heart (control heart). Tf, tissue factor; Ef1, elongation factor 1α; Mcp, membrane cofactor protein; Tbm, thrombomodulin; Icam2, intercellular adhesion molecule 2. *** means p < 0.01.
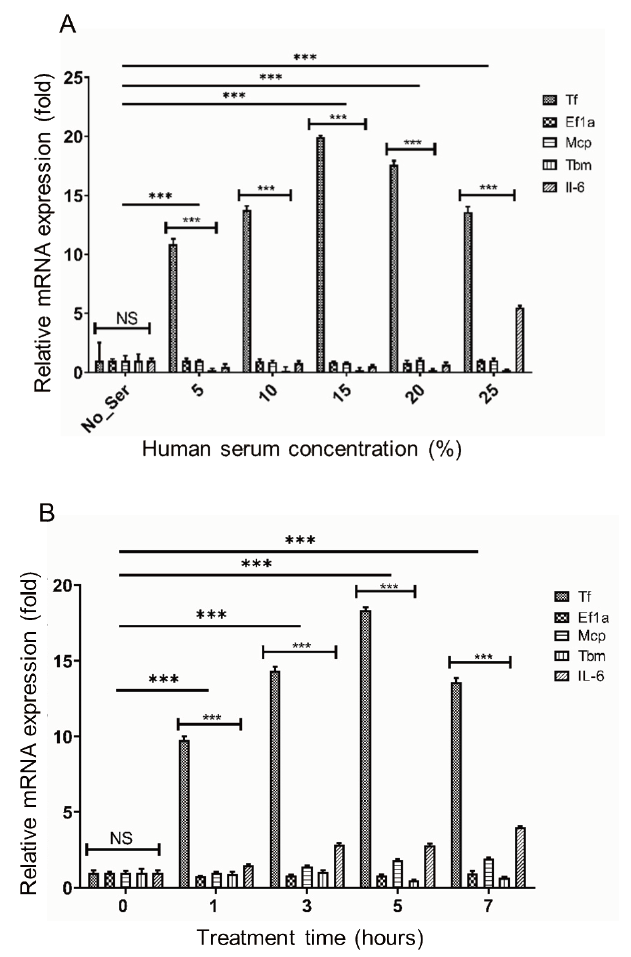
Fig. 2.Upregulation of porcine tissue factor gene in response to human serum in porcine aortic endothelial cell (pAEC). (A) pAEC was cultured in medium supplemented with 0, 5, 10, 15, 20, and 25% of human serum for 4 hours. (B) pAEC was cultured for 0, 1, 3, 5, and 7 hours in medium supplemented with 15%. pAEC, porcine aortic endothelial cells; Tf, tissue factor; Ef1, elongation factor 1α; Mcp, membrane cofactor protein; Tbm, thrombomodulin; Icam2, intercellular adhesion molecule 2; IL-6, interleukin 6. NS and *** mean not significant and p < 0.01, respectively.
거부반응 억제 유전자가 도입된 돼지에서 분리하고 배양한 혈관내피세포는 도입유전자의 기능 분석 연구를 위한 재료로 활용되고 있다(Nomura et al., 2019; Ramackers et al., 2020). 이전의 연구에서 GTKO/MCP 돼지에서 분리하고 배양한 혈관내피세포에 영장류 혈청을 처리하면 세포의 생존에 독성으로 작용한다고 보고한 바 있다(Lee et al., 2020). 이러한 결과들을 바탕으로 본 연구에서 구축한 체외 실험 방법은 적어도 부분적으로 체내의 이종이식에 의한 거부반응을 재현할 수 있다는 것을 보여준다. 이종이식 후 사망한 원숭이에 이식된 돼지 심장의 DEGs 결과와 Fig. 2의 Tf 유전자의 발현 변화 양상이 동일하고, 염증반응 마커인 Il-6 유전자 발현 양상과 비교했을 때, Tf 유전자는 거부반응이 발생하면 염증반응 인자보다 빠르게 반응하여 발현이 증가하며, 혈청에 존재하는 인자가 Tf 유전자의 발현 조절에 기여한다고 판단된다.
돼지 Tf 프로모터 및 리포터 벡터 제작
체내에서 이종이식 거부반응 발생으로 발현이 증가하고 사람 혈청에 반응하여 발현이 증가하는 돼지 Tf 유전자의 특성을 고려하면, Tf 유전자의 프로모터를 활용하면 이종에 의한(xenogeneic) 스트레스 환경에서 특이적으로 목표 유전자의 발현을 조절할 수 있을 것으로 예측되었다. 이를 확인하기 위하여 Moll et al. (1995)의 보고를 참고로 인간 및 설치류와 가장 유사한 부분에 해당하는 돼지 Tf 프로모터 염기서열 410 bp와 사람 Tf 유전자 발현에 중요한 인자로 작용한다고 알려진 AP-1 결합 부위를 포함하는 1,246 bp의 염기서열을 합성하였다(Fig. 3A). 또한. 1,246 bp의 돼지 프로모터 중에서 5’쪽의 459 bp의 염기서열을 제외시킨 787 bp의 돼지 TF 프로모터와 사람 TF 프로모터 533 bp를 합성하였다. 합성된 프로모터를 pGL3 luciferase reporter 벡터에 도입하였고, 각각 pTF1246, pTF787 및 hTF535으로 명명하였다(Fig. 3B).
돼지 Tf 프로모터의 사람 혈청에 반응한 특이적 발현 조절
Fig. 3B에서 보여준 pTF1246, pTF787 및 hTF535 luciferase 리포터 벡터와 대조군으로서 CAG 프로모터에 연결한 리포터 벡터를 nucleofection 방법을 이용하여 pAEC에 도입하였다. 유전자 도입 효율은 이전의 연구에서 보고하였다(No et al., 2018). CAG 프로모터는 CMV 인헨서와 치킨 베타액틴 프로모터 및 토끼 베타 글로불린 인트론으로 구성되어 있으며, 전 조직에서 외부 자극 유무에 관계없이 강력하게 목표 유전자를 발현시키기 위한 형질전환 동물 생산에 널리 활용되고 있다(Miyazaki et al., 1989; Niwa et al., 1991; Alexopoulou et al., 2008). 또한 CAG 프로모터는 이종이식 연구에 활용하기 위하여 면역조절 인자를 과발현하는 형질전환 돼지 생산에도 활용되고 있다(Aigner et al., 2010). 리포터 벡터를 도입한 후 48시간에 일반적인 배양 환경에서 luciferase의 발현 양상을 비교한 결과, CAG 프로모터 대비 0.1배의 낮은 수준으로 발현을 나타내었다(Fig. 4A). 반면에 배양액에 사람의 혈청을 각각 15% 첨가하여 배양한 환경에서는 luciferase의 발현 수준이 pTF1246, pTF787 및 hTF535 프로모터에 의해 돼지 혈청에 비해 유의적으로 증가하였다(Fig. 4B). CAG 프로모터는 혈청 첨가에 의한 발현 변화를 보이지 않았다. 한편, hTF535 프로모터의 경우도 사람 혈청에 반응하여 luciferase의 발현 수준이 크게 증가하였으나, 돼지 유래 pTF1246 및 pTF787 프로모터보다 낮았는데 이는 이종 혈청에 반응하여 돼지 세포에서 생성된 여러 인자에 의한 2차적인 요인이 작용한 것으로 추측된다.
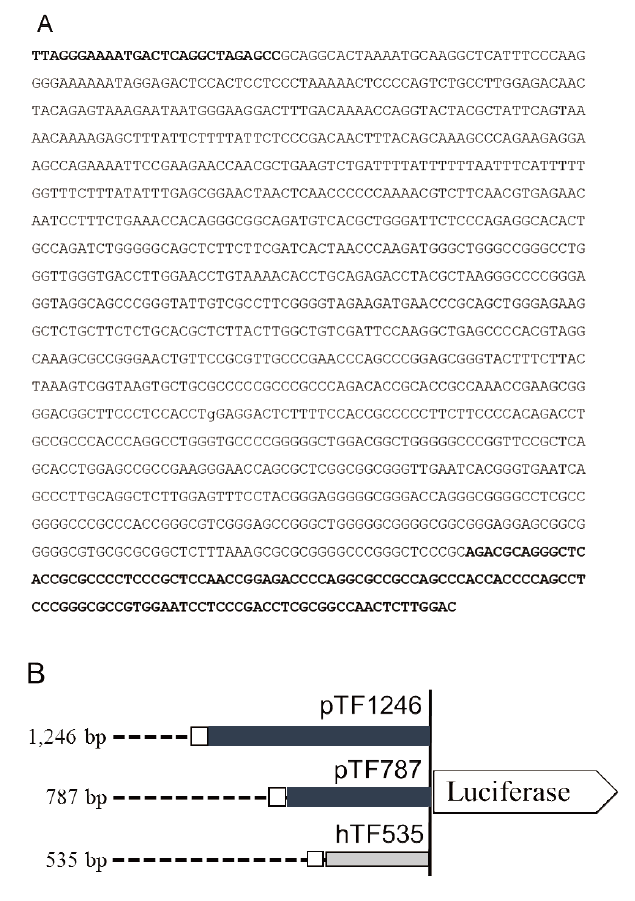
Fig. 3.Promoter sequences of porcine Tf gene and structure of luciferase reporter vector. (A) Nucleotide sequences of 1,246 bp containing putative promoter region of porcine Tf gene. AP-1 biding sites are presented as bold letters at 5’ end. Bold letters at 3’ end indicate untranslated region of exon 1 of porcine Tf gene. (B) Schematic diagram of luciferase reporter vectors used in this study. Numbers on the left indicate the approximate length of the respective promoters. Open box indicates AP-1 biding sites. Tf, tissue factor; AP-1, activator protein 1; pTF, porcine Tf; hTF, human TF.
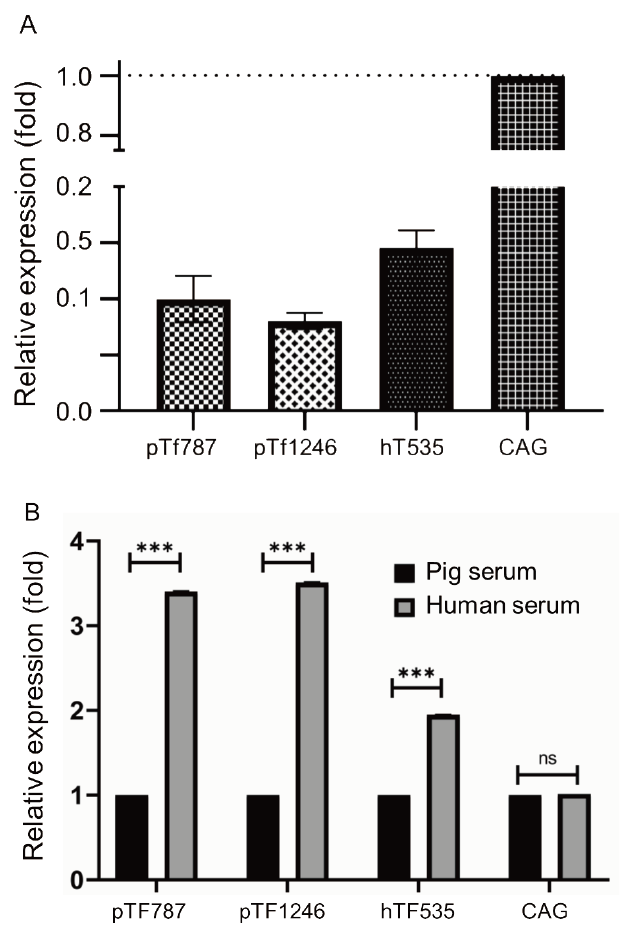
Fig. 4.Relative activity of various promoters for regulation of luciferase expression in porcine aortic endothelial cell (pAEC). (A) Comparative activities of porcine and human tissue factor promoters with that of the cytomegalovirus enhancer/chicken β-actin (CAG) promoter in regulating luciferase expression in transfected pAEC. (B) Luciferase activity in transfected PAEC incubated in culture medium supplemented with pig and primate serum. ns and *** means ‘not significant’ and ‘p < 0.01’, respectively.
돼지의 장기나 조직을 이종 이식에 활용하기 위해서는 거부반응이라는 큰 장벽이 존재하는 데, 이를 해결하기 가장 적합한 방법은 유전자 조절을 통해 인간화 돼지를 개발하는 것이다(Meier et al., 2018). 그런데, 목표 유전자의 일부는 높은 생리 활성으로 인해 형질전환 돼지에 생리적인 손상을 초래하므로 특이 약물을 통하여 발현을 조절할 수 있는 유도 프로모터가 필요하다(Kallunki et al., 2019). 최근에, Fischer et al. (2020)은 사람 human C-C motif chemokine ligand 2 및 TNF alpha-induced protein 3, 그리고 돼지 A20 프로모터는 돼지 발달을 손상시키는 LEA29Y 유전자의 발현을 염증성 인자에 반응하여 발현을 증가시킨다고 보고하였다. 비록 본 연구에서 사람 혈청 성분 중에서 pTF1246 및 pTF787 프로모터의 활성을 증가시키는 인자를 규명하지는 못 하였지만, 이종이식 거부반응의 주요 원인의 하나인 영장류의 혈청에 반응하여 발현을 증가시키는 기능이 있는 pTF1246 및 pTF787 프로모터는 이종이식 거부반응 억제에 효과적으로 작용하지만 생리적인 활성이 높아 생산하기 어려운 형질전환 돼지 개발에 유용하게 사용할 수 있을 것이라고 판단된다.
Conclusion
이종 장기 이식에 있어서 가장 중요한 문제로 작용하는 것이 면역 거부반응으로 인한 이식 장기의 괴사이다. 이를 극복하기 위해서는 면역 거부반응을 안정적으로 억제시킬 수 있는 새로운 후보물질을 개발하는 것과 아울러 거부반응이 일어나는 특정 시기에 목표유전자를 발현시킬 수 있는 프로모터의 개발이 이루어져야 할 것이다. 본 연구에서는 이종 이식 후 및 이종 혈청에 반응하여 돼지의 심장과 돼지의 혈관내피세포에서 발현되는 Tf의 발현 양상에 주목하였다. 이를 바탕으로 돼지 Tf 프로모터를 합성하여, 일반적인 생체 상황에서는 발현이 정상적으로 유지되는 반면, 이종의 혈청에 반응하여 목표 유전자를 과 발현시키는 결과를 얻었다. 따라서, 본 연구에서 구축한 돼지 Tf 프로모터를 이용하여, 형질전환 돼지의 항상성을 유지시키는 한편, 이종 이식 후 거부반응이 나타나는 특정시기에 목표 유전자를 과 발현시켜 효과적으로 면역 거부반응을 억제시킬 수 있을 것으로 기대한다.
Authors Information
Jin Gu No, https://orcid.org/0000-0002-7851-7662
Haesun Lee, https://orcid.org/0000-0002-7136-9468
Na Hyun Lee, https://orcid.org/0000-0001-9673-9819
Wu-Sheng Sun, https://orcid.org/0000-0001-6979-082X
In-Sul Hwang, https://orcid.org/0000-0003-2949-3075
Minguk Lee, https://orcid.org/000-0001-8237-6447
Keon Bong Oh, https://orcid.org/0000-0002-0651-0306





