Introduction
세계 3대 곡물 중에 하나인 쌀은 세계적으로 보면 인도에서 BC7000 - 5000년대, 중국에서 BC5000년경부터 벼를 재배했다고 알려졌고, 한국은 쌀이 보급되기 전에 잡곡(조, 수수, 보리, 밀 등)을 주식으로 했으나, 7세기 이후 통일신라시대부터 벼 생산량이 많아지면서 우리 식생활에 커다란 부분을 차지하게 되었고, 곡물의 대표가 되었다(RDA, 2015). 이러한 쌀이 현대에서도 우리의 주식이자 곡물의 대표로서 꾸준히 소비되고 있다(Lee et al., 2018). 시장 개방등과 같은 외부적인 환경과 더불어 소비자들이 고품질 쌀에 대한 관심이 증가함에 따라 고품질 밥쌀용 벼 육종에 관한 연구가 이루어지고 있으며 생산된 쌀 품종의 우수성을 알리고 고품질의 쌀을 이용한 상품화 등을 통해 차별화 및 경쟁력확보의 필요성이 요구되고 있다(Woo et al., 2018). 농촌진흥청은 우리 쌀의 소비 확대와 경쟁력을 높이기 위해 2003년부터 자체 지속적으로 품종을 개발하고 있으며(RDA, 2020), 이와 함께 개발된 품종들은 지속적으로 대학, 출연연구소 등이 참여하는 국가식품분석시스템을 구축하여 식품영양성분분석 데이터를 생산하고 식품 성분 표를 발간하고 있다(Park et al., 2018a). 국내 생산되는 현미와 백미의 아미노산 등 영양성분 조성에 대해 미비하게 연구되어진 바가 있고, 농촌진흥청은 285개 밥쌀용 품종 가운데 2003년 이후에 삼광, 운광, 고품, 호품, 칠보, 하이 아미, 진수미, 영호 진미, 미품, 수광, 대보, 현품, 해품, 해담, 청품, 진광, 예찬, 해들 18개 품종을 최고품질 벼로 보급하였고 향후 지속적으로 신품종을 개발하고 있다.
본 연구는 쌀의 영양학적 데이터베이스 구축을 위한 기초자료를 제공 및 신품종 개발에 기초자료를 제공하고자 현재까지 국내에 육성된 멥쌀(백미, 현미) 총 13종 곡류를 이용하여 조 단백질, 아미노산 17종 영양성분 분석하여 비교 검토하였다.
Materials and Methods
재료 및 시약
시료는 농촌진흥청 국립농업과학원 생산 수확된 13종(삼광[Samkwang], 새일[Sail], 신동진[Shindongjin], 오대[Odae], 도담[Dodam], 운광[Ungwang], 해들[Haedeul], 해품[Haepum], 남찬[Namchan], 알찬[Alcha], 영호진[Younghojin], 친들[Chindeul], 한아름 4호[Hanareum No. 4]) 품종 별 백미와 현미를 사용하였다. 시료는 세척 후 분쇄 중 영양소 손실을 최소화하기 위하여 액체 질소에 담아 급속 냉동한 후 분쇄기로 분쇄하여 -70℃ 급속 냉동기에 보관하여 사용하였다. 아미노산 분석에 사용된 표준품들은 Sigma-Aldrich Co. (St. Louis, MO, USA), 유도체 시약(AccQ-Tag reagent)은 Waters Co. (Milford MA, USA), 기기분석에 사용된 용매 아세토나이트릴(acetonitrile), 메탄올(methanol), 물(water)은 Honeywell Burdick & Jackson (Muskegon, MI, USA)을 구입하여 사용하였다. 조 단백질 분석 사용된 황산(sulfur acid), 붕산(boric acid), 수산화나트륨(sodium hydroxide)은 특급시약(Samchun Co., Pyeongtaek, Korea)을 분해 촉진제는 Foss Co. (Hilleroed MA, UK) 시약을 구입하여 사용하였다. 아미노산과 단백질 분석법에 대한 정확성을 검증하기 위해 인증표준물질(certified reference materials, CRM)은 1849a (infant/adults nutritional formular)을 사용하였고 실험실내 정도 관리 물질(in house sample)은 국내 시판되고 있는 영아용 분유(Infant formula, Pasteur, Seoul, Korea)을 사용하였다.
분석법 검증
아미노산 분석방법을 검증을 위해 직선성, 검출한계(limit of detection, LOD) 및 정량한계(limit of quantitation, LOQ)을 검토하였다.
LOD는 시료에 포함되는 분석대상물의 검출이 가능한 최소량 또는 최저 농도, LOQ는 검체 중에 포함되어 있는 분석대상물의 정량이 가능한 최소량 또는 최저 농도로 LOD와 LOQ는 보통 signal-to-noise ratio에 의해 결정되며(LOD는 S/N이 3 : 1로, LOQ는 10 : 1), 표준편차와 검량선의 기울기에 근거하여 산출하였다. 검출한계 계산식은 LOD = 3.3 × σ/S로 σ는 반응의 표준편차를 의미하고, S는 검량선의 기울기를 의미하며 정량한계는 LOQ = 10 × σ/S의 계산식으로 산출하였다(Seol et al., 2017). 직선성 확인을 위해 아미노산 분석 17종 표준용액을 3.125, 6.25, 12.5, 25, 50 μM·L-1 희석하여 분석하였다. 정밀성과 정확성은 분석 정확도를 검증하기 위해 미국 국립표준기술연구소(National Institute of Standard and Technology, NIST)에서 제공하는 표준인증물질(CRM1849a)를 9번 이상 반복하여 분석하고, NIST에서 참값(reference value)과 본 실험의 측정값(analysis value) 차를 결과 값의 분산정도(목표표준편차; target standard deviation)로 나눈 값으로 Z값(Z-score)을 산출하였으며 각 분석항목별 Z값에 따라 |Z| ≤ 2 만족할 경우 양호 |Z| < 2는 미흡으로 관리하였다(Kim et al., 2019). 그리고 NIST에서 참값과 본 실험의 측정값(analysis value) 비교한 후 상대표준편차(coefficient of variation)와 회수율 (%)로 나타내었다.
분석 품질 관리
AOAC가이드라인(AOAC, 2002)에 따라 분석품질을 확인하기 위해 실험실내 정도 관리 물질로 품질관리 도표(QC chart)를 작성하여 관리하였다. 최소 10회 이상 반복 분석하여 상대표준편차가 10%이내에 들어가는 분석 값을 기준으로 관리상한선(upper control line, UCL), 관리하한선(lower control line, LCL)을 설정하였고, 조치상한선(upper action line, UAL)과 조치하한선(lower action line, LAL)을 설정하여 관리하였다. UCL과 LCL은 분석 값의 평균값에 2배의 편차를 더한 값이며, UAL과 LAL은 분석 값의 평균값에 3배의 편차 값을 더한 값을 이용하였으며, 범위에 벗어나면 재분석을 하여 진행하였다(Jung et al., 2009).
조 단백질 분석
조 단백질 분석은 AOAC 방법(AOAC, 2005)에 의하여 정량 하였다. 조 단백질은 Micro-Kjeldahl 질소 정량 법으로 자동단백질 분석기(Vapodest 50S, Gerhardt, Fussen, Germany)로 측정하였다. 시료 1 - 2 g을 킬달 분해플라스크에 넣고 분해촉매제 3.5 g와 95% 황산 15 mL로 분해하고 32% 수산화나트륨과 3% 붕산으로 중화하여 수증기로 증류 후 0.1 N 염산으로 적정하여 얻어진 질소량으로 질소계수(5.93)를 곱하여 조 단백질 함량(g·100 g-1)을 계산하였다.
아미노산 분석
아미노산 분석은 AOAC법(AOAC, 2005)과 식품영양성분데이터 베이스구축사업 매뉴얼(KFDA, 2019)에 따라 분석하였다. 균질화된 시료 약 1 - 2 g을 취하여 6 N 염산을 10 mL을 가하여 질소 충진 후 110℃ 드라이오븐(Gbiotech Co., Suwon, Korea)에 20 - 24 hr 가수분해하였다. 증류수로 50 mL 정용 플라스크에 정용 후 0.2 μm membrane filter로 여과하여 AccQ-Tag 방법으로 유도체화 시킨 다음 아미노산을 HPLC (Waters Co., MA, USA)로 분석하였다. 이때 column은 Nova-Pak C18 (3.9 × 150 mm, Waters Co., MA, USA), injection volume은 10 μL, flow rate는 1 mL·min-1이고, 검출기는 fluorescence 검출기로(Ex. 250 nm, Em. 395nm Waters Co., USA), 이동상은 60% acetonitrile과 AccQ-Tag eluent buffer을 이용하여 gradient법으로 분석하였다. 아미노산 표준물질 17종을 표준품을 6.25, 12.5, 25, 50, 125 및 250 μM·L-1의 농도로 희석하여 검량선을 작성하여 계산하였다.
통계분석
각 시료 영양성분 실험은 3반복 실험을 진행하였고, 본 시험에서 얻어진 실험 결과는 평균(mean)과 표준편차(SD)로 제시하였고, 시료간의 차이 유무를 분산 분석을 시행한 후 사후 검증은 Tukey’s multiple range test (p > 0.05)를 실시 하였다.
Results and Discussion
분석방법 검증
조단백질, 아미노산의 유용성 검증은 AOAC 분석법(AOAC, 2002) 검증 가이드라인에 따라 정확성 정밀성 LOD, LOQ, 및 직선성의 지표를 분석하였다. 분석법 검증을 위해 직선성(linearity), LOD, LOQ을 Table 1에 나타내었다. 아미노산 분석의 재현성과 정확도를 높이기 위해 최적의 실험환경이 수반되어야 한다고 알려져 있어(Seol et al., 2017; Duan et al. 2019) 최적의 조건에서 실험을 실시하였고, 표준용액 농도는 0.3125 - 100 μM·L-1 농도범위에서 10번 분석하여 평균값을 결과를 도출하였다. 검증 결과 상관계수(γ2)는 17종 아미노산에서 0.9918 - 0.9999 사이의 직선성을 나타내었고, 대상 분석시료 검출 및 정량 가능 최저 농도를 확인하기 위하여 LOD 범위는 0.01 - 0.07 mg·mL-1 LOQ는 0.03 - 0.21 mg·mL-1 나타났는데(Table 1), Shim 등(2013)의 연구에서도 LOD는 0.007 - 0.059 mg·mL-1, LOQ는 0.023 - 0.198 mg·mL-1으로 본 연구와 비슷한 결과를 보이는 것을 확인할 수 있었다. 정확도와 정밀도를 확인하기 위하여 CRM1849a 이용하여 9번 이상 반복하여 측정하여 CV (%)은 0.23 - 2.38% 산출되었고, Z-score값도 (-1.54) - (-0.08)로 나타나 시료에 대한 정밀도 및 정확성의 기준을 만족하는 것으로 나타났다(Table 2).
Table 1. Standard calibration curve of amino acid.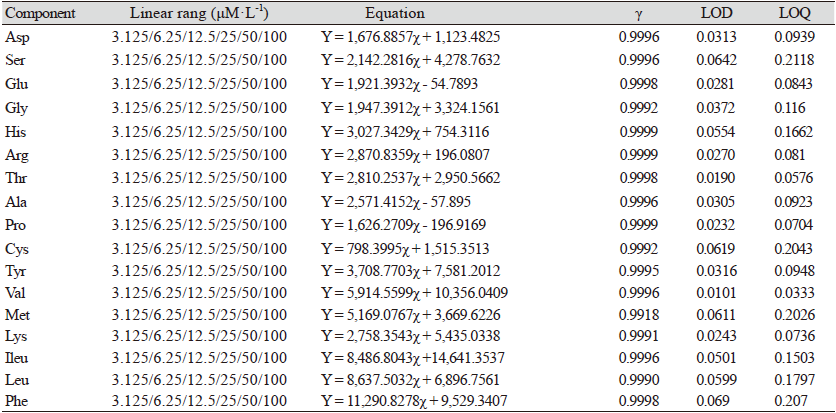
|
|
γ, correlation coefficient; LOD, limit of detection (mg·100 g-1); LOQ, limit of quantification (mg·100 g-1). |
Table 2. Recovery and coefficient of variation of crude protein and 17 kinds amino acid content for
certificated reference material (CRM) 1849a.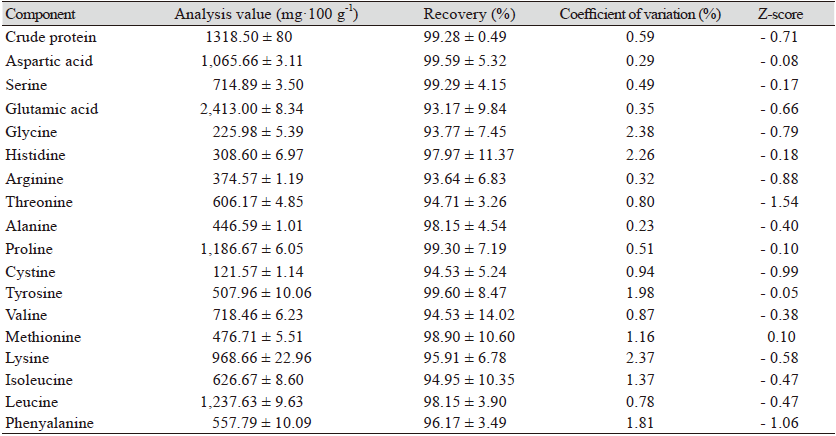
|
분석품질관리
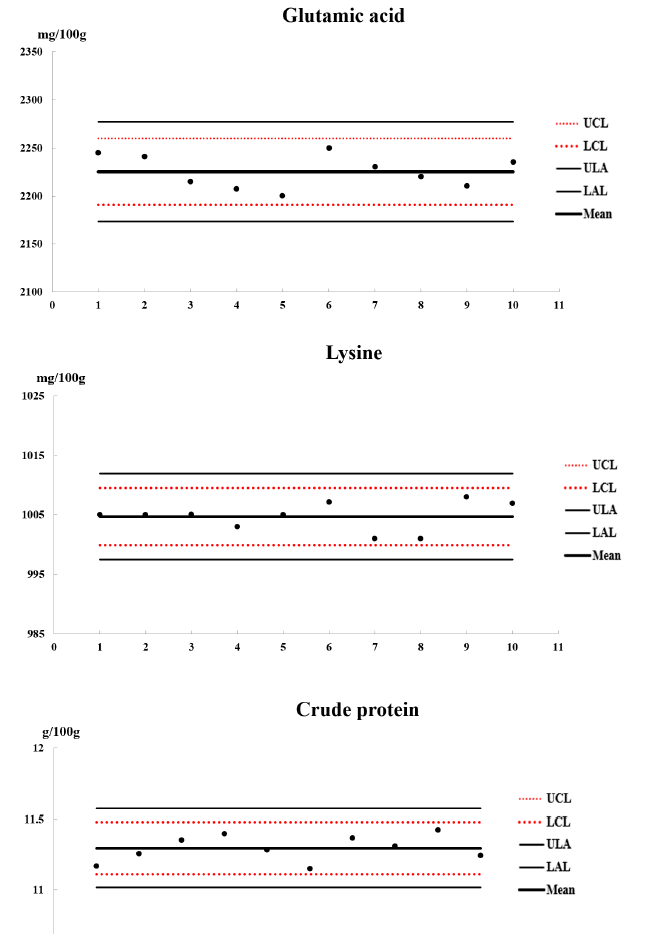
시료 분석을 진행 시 분석조건이나 환경에 따라 분석결과에 영향을 미칠 수 있으므로 국가영양성분분석 데이터 구축과 같은 지속적으로 분석 시에는 분석품질을 평가하고 관리하는 것이 생산되는 분석데이터의 신뢰도 확보에 중요한 부분이다(Jeong et al., 2020). 농진청에서 발간하는 국가식품성분 표와 같이 데이터 생산 및 업데이트가 지속적으로 이루어지고 있는데 이런 경우 정확성과 재현성 있는 분석데이터의 생산을 위해 분석품질관리의 수행은 필수 요소라고 하겠다(Lee et al., 2016). 단백질과 아미노산 성분의 내부 분석품질관리는 분석 품질관리도표(quality control chart)를 통해 매회 분석 값에 제시하여 분석방법이 제대로 수행 되었는지를 알 수 있고, 실험 과정에서 발생하는 환경적인 문제, 분석기기 오차, 실험자 오차 등에 대한 검증절차로 이용되고 있다(Park et al., 2018b) 본 시험에서 분석된 영양성분은 동일하게 품질관리를 시행하였고 대표적인 영양소(crude protein, Lys, Glu)의 QC차트만 제시하였다(Fig. 1).
시험분석 기간 동안 분석품질관리 시료를 시료와 함께 동일한 분석법으로 분석한 것이다. 곡류시료분석과 함께 품질관리시료를 분석한 분석 값을 QC-차트로 검토한 결과 조 단백질, 17종 아미노산 모두 관리범위 안에 포함되는 것을 알 수 있었다. 본 연구에 분석된 13종 곡류(백미, 현미)의 조 단백질과 아미노산 분석은 QC-차트의 관리 수준에 적합한 경우에 얻어진 결과이다. 이는 본 연구의 신뢰성을 나타내는 것으로 판단할 수 있다.
조 단백질 성분
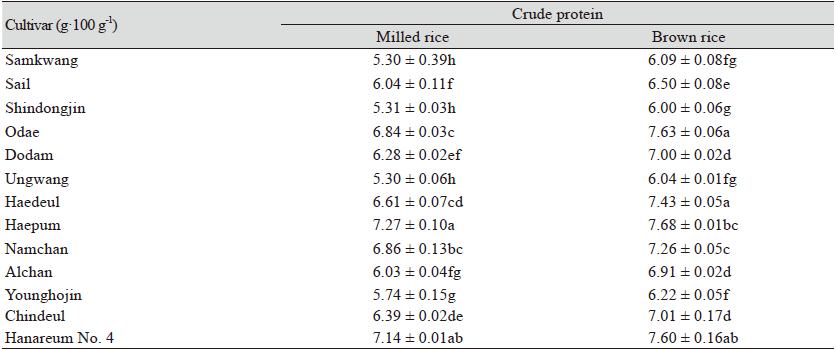
13종 멥쌀 품종 별 현미와 백미의 조 단백질 분석한 결과는 Table 3과 같다. 단백질 함량을 품종 별로 비교해 보았을 때, 멥쌀 백미의 경우 해품 7.27%, 한아름4 7.14%, 오대 6.84%순으로 높게 나타났고 운광 5.29% 가장 낮은 단백질 함량을 나타냈다. 멥쌀 현미는 해품 7.68%, 오대 7.63%, 한아름4 7.60%, 순으로 높게 나타났고, 신동진 6.00% 가장 낮은 단백질 함량을 나타났다. 같은 시료라도 품종 별 재배시기별 재배지역별 재배방법 토양 등 재배환경에 따라 영향을 받는 것(Seol et al., 2017; Jung et al., 2018)이라 알려져 있는데, 본 연구의 함량 차이도 이러한 영향으로 보여진다. 13종 멥쌀 품종 별 현미와 백미 모두 해품 품종이 가장 높은 조 단백질 함량을 나타났으며, 동일 품종 별 백미와 현미의 단백질 함량 비교 시 13종 모든 품종이 현미가 단백질 함량이 높게 나타났다(Table 3). 식미는 단백질 함량에 반비례 관계가 성립한다는 연구결과가 있으며, 백미가 도정 시 제거되는 미강이나 배아에 더 많은 단백질이 존재한다는 것을 의미한다(Kim et al., 2003).
아미노산 성분
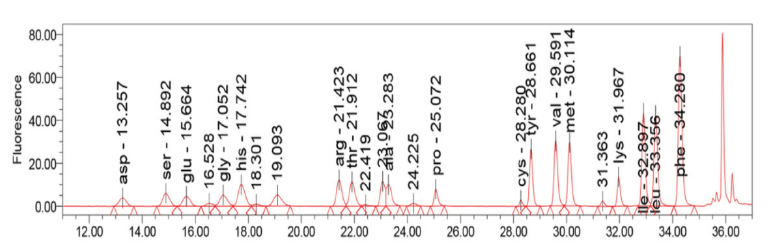
Fig. 2는 삼광 백미 17종 아미노산 분석 HPLC 크로마토그램 결과이며, Table 4은 품종 별 현미, 백미 아미노산 함량(%)을 분석한 결과이다. 아미노산은 필수 아미노산과 비 필수 아미노산을 나누어지는데, 필수 아미노산 9종(valine [Val], methionine [Met], lysine [Lys], isoleucine [Ile], leucine [Leu], phenylalanine [Phe], histidine [His], threonine [Thr], arginine [Arg])과 비 필수 아미노산 8종(aspartic acid [Asp], serine [Ser], glutamic acid [Glu], glycine [Gly], alanine [Ala], proline [Pro], tyrosine [Tyr], cystein [Cys])을 분석하였다. 아미노산 함량은 백미, 현미 모두 해품(백미 5.76%, 현미 6.49%) > 해들(백미 5.71%, 현미 6.30 %) > 오대(백미5.63%, 현미 6.29%) 품종 순으로 높게 나타났고, 필수 아미노산의 경우 해품(백미 2.34%, 현미 2.57 %) > 해들(백미 2.31%, 현미 2.48%) > 오대(백미 2.20 %, 현미 2.56%), 비 필수 아미노산은 백미는 도담(3.55%) > 오대(3.43%)> 해품(3.42%), 현미는 해품(3.92%)> 해들(3.82%)> 오대(3.73%) 순으로 높게 나타났다(Table 5). 필수 아미노산은 인체를 구성할 때 합성되지 않아 반드시 식이로 섭취해야만 하는 아미노산이다. 백미의 필수 아미노산 조성은 2.34 - 1.35%, 현미는 2.57 - 1.59% 정도 들어있었다. 필수 아미노산 중 가장 많이 함유된 아미노산은 arginine으로 백미는 0.470 - 0.248%, 현미는 0.552 - 0.275%으로 분석되었다. Arginine은 성장 호르몬(hGH) 분비를 촉진으로 근육량 증가 및 노화방지에 도움을 주며 수술 후 회복증진에 많은 도움을 주는 세포 면역 반응을 활성화시키고 외상환자 상처 회복을 증진시키는 역할을 한다(Roberts and Frankel, 1950). 품종 별로 백미에서 해품 종이 높은 아미노산 함량을 나타냈는데, 총 아미노산 5.76%, 필수 아미노산 2.34%, 비 필수 아미노산 3.42%였고, 현미도 해품 종으로 총 아미노산 6.49%, 필수 아미노산 2.57%, 비 필수 아미노산 3.92%으로 전체 아미노산 함량에 대한 필수 아미노산 함량 비율이 백미는 해품 품종(40.60%)에서 현미는 도담 품종(43.64%)에서 높은 함량을 나타냈으며, FAO (1970)에서 제시한 32.30%보다는 모든 쌀 품종에서 높은 것으로 분석되었다(Fig. 3). 그리고 비 필수 아미노산이 가장 많이 함유된 아미노산은 glutamic acid, aspartic acid 순으로 높게 나타났는데, 백미는 1.26 - 0.68, 0.72 - 0.36% 현미는 1.29 - 0.83, 0.68 - 0.48% 정도 분석되었다(Choe, 2002). Aspartic acid는 혈관을 확장시키고 glutamic acid은 뇌에 있어 신경전달 물질인 GABA의 생성을 촉진시키는 것으로 알려져 있다(Roberts et al., 1950).
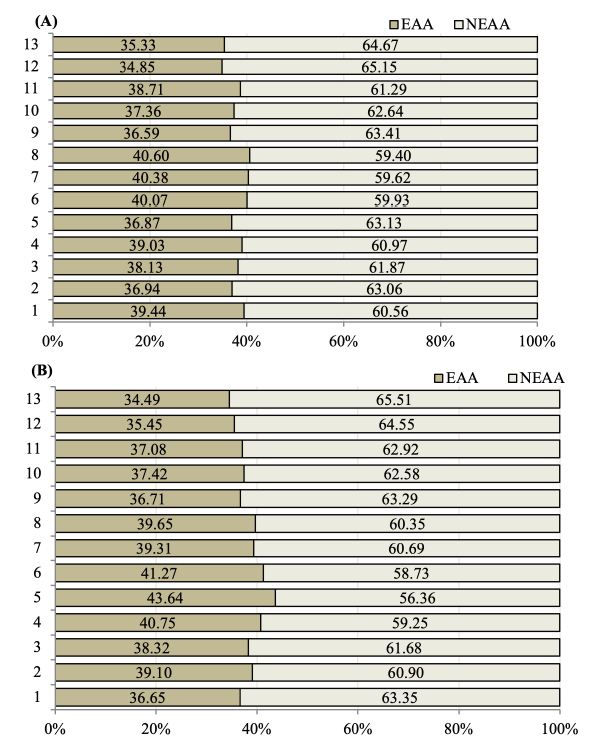
Fig. 3. Essential amino acids (EAA) and non-essential amino acids (NEAA) in non-glutinous milled rice (A) and brown rice (B) from 13 cultivars in Korea. 1, Samkwang; 2, Sail; 3, Shindongjin; 4, Odae; 5, Dodam; 6, Ungwang; 7, Haedeul; 8, Haepum; 9, Namchan; 10, Alchan; 11, oYunghojin; 12, Chindeul; 13, Hanareum No. 4.
Conclusion
본 연구는 국내 재배한 13품종 백미, 현미 중의 아미노산과 조단백질 함량을 분석하여 기초 데이터를 마련하고 실험법 결과의 신뢰도를 확보하고자 하였다. 조단백질 함량은 13종 멥쌀 품종 별 현미와 백미 모두 해품 품종(백미 7.27% 현미 7.68%)이 가장 높은 조단백질 함량을 나타났으며, 동일 품종별 백미와 현미의 단백질 함량 비교 시 13종 모든 품종이 현미가 단백질 함량이 높게 나타났다. 총 아미노산 함량은 백미, 현미 해품 > 해들 > 오대 품종 순으로 높게 나타났고, 필수 아미노산의 경우 해품 > 해들 > 오대, 비 필수 아미노산은 백미는 해들 >오대 > 도담, 현미는 해들 > 해품 > 오대 순으로 높게 나타났다. 전체 아미노산 함량에 대한 필수 아미노산 함량 비율이 백미는 해품 품종(40.60%)에서 현미는 도담 품종(43.64%)에서 높은 함량을 나타났다. 분석방법 검증에서 선 형식의 상관관계(γ2)는 아미노산 17종 모두 0.9918 - 0.9999의 높은 유의 수준을 보였으며 정량한계와 검출한계 범위는 각각 0.0101 - 0.642, 0.0333 - 0.2118 mg·mL-1로 나타났다. 농촌진흥청은 우리 쌀의 소비 확대와 경쟁력을 높이기 위해 2003년부터 자체 지속적으로 품종을 개발하고 있으며, 이와 함께 개발된 품종들은 지속적으로 대학, 정부 출연연구소 등이 참여하는 국가식품분석시스템을 구축하여 식품영양성분분석 데이터를 생산하고 식품 성분 표를 발간하고 있다. 현재 국내 육성되는 곡류는 해마다 신품종 개발이 지속적으로 이루어지고 있다. 따라서 국내에서 육성된 쌀 품종에 대한 지속적인 영양성분 연구는 신품종 육성 및 부가가치향상을 위한 기초데이터로 활용, 국가 식품표의 영양성분 구축데이터 및 이를 활용한 농산물의 기능성 소재로 기초데이터나 이를 활용한 가공식품이나 기능성 소재로 응용 할 수 있는 기본 자료로 이용될 수 있을 것으로 판단된다.
Authors Information
So-Jung Kim, https://orcid.org/0000-0001-9759-2636
Min Joo Kim, https://orcid.org/0000-0003-2942-5208
Su Hyeon Lee, https://orcid.org/0000-0001-9832-8204
Youngmin Choi, https://orcid.org/0000-0002-8633-4671
Jeehye Sung, https://orcid.org/0000-0002-7998-3016
Dongwon Seo, https://orcid.org/0000-0002-7994-6944