Introduction
최근 과학기술의 발달로 기대수명이 증가하여 전세계적으로 노인인구가 증가하고 있고, 이에 따라 노인성 질환에 대한 연구도 활발히 이루어지고 있다. 치매는 대표적인 노인성 뇌 질환으로, 치매의 유형 중 가장 대표적인 것은 알츠하이머 치매(Alzheimer’s disease)다. 전체 치매 환자 중 알츠하이머 치매 환자가 약 60 - 80%를 차지하며, 그 외에 혈관성 치매, 루이소체 치매 등이 있다(Kalaria, 2018). 알츠하이머 치매는 기억력 및 사고능력의 저하와 더불어 성격변화 및 사회성 결여 등의 다양한 임상적 변화를 동반한다. 특히 기억력 손상은 알츠하이머 치매의 대표적인 증상으로, 신경전달물질인 아세틸콜린(acetylcholine)을 생성하는 신경세포의 손상과 아세틸콜린을 분해하는 아세틸콜린에스터라제(acetylcholinesterase, AChE) 활성이 증가되면서 점차 악화된다. 기억장애가 심해지면 단기기억 뿐만 아니라 기억력 전체가 심각하게 손상되어 일상생활을 영위하는데 있어 큰 어려움을 가지게 된다(Kasa et al., 2000; Kim et al., 2000). 알츠하이머 치매는 아밀로이드 베타(Aβ)의 축적으로 인한 노인반 형성, 타우(tau) 단백질의 과인산화로 인한 신경섬유 얽힘, AChE의 활성화로 인한 신경전달물질 결핍, 그리고 산화적 스트레스 등에 의해 발생하는 것으로 알려져 있다(Benzi and Moretti, 1998). 특히 산화적 스트레스는 과음, 흡연, 운동부족 등 생활습관 또는 과도한 스트레스에 의해 발생하여 산화적 손상으로부터 취약한 뇌 조직에서 신경세포 및 신경교세포의 사멸을 유도한다. 이들 세포가 사멸함에 따라 뇌조직이 위축되어 점진적으로 기억력을 잃어간다(Fleury et al., 2002). 특히 신경교세포는 전체 뇌 세포의 5 - 10%를 차지하며, 뇌 손상이 발생할 때 활성화되어 손상된 신경세포나 이물질을 제거한다. 또한, 신경교세포에서 산화적 스트레스의 축적은 세포사로 인한 세포독성을 유발하게 된다(De Bernardo et al., 2004; Qian et al., 2005). 따라서 산화적 스트레스로 인한 신경교세포의 손상은 알츠하이머 치매와 같은 신경퇴행성질환의 발생과 밀접한 관련이 있다.
엉겅퀴는 국화과에 속하는 여러해살이 식물로, 예로부터 봄에 채취한 엉겅퀴 어린 잎과 줄기를 식용으로 이용해왔다. 엉겅퀴의 뿌리는 한방에서 ‘대계근’이라 하여 약용으로 활용해왔으며, 토혈, 혈뇨, 간염 등의 치료에 사용하였다(Ishida et al., 1987; Jang et al., 2012). 서양에서는 간 손상에 대한 엉겅퀴의 보호효과가 알려져 있어 기능성식품 소재로 활용되고 있다(Kim et al., 2017). 국내에서 주로 재배되는 엉겅퀴는 Cirsium japonicum var. maackii (CJM)종으로, cirsimarin, cirsimaritin, hispidulin, apigenin 등의 활성물질이 함유되어 있다(Rodriguez et al., 2017). CJM은 HepG2 세포에서 tert-butyl hydroperoxide에 의한 간독성을 감소시켜 간세포를 보호하였으며, Hif-2α로 유도된 골관절염 모델에서 연골 손상을 감소시켰다(Jung et al., 2017; Cho et al., 2019). 선행 연구로써 Aβ에 대한 CJM의 신경세포 보호 효과를 확인하였으나(Kim et al., 2020c), H2O2에 대한 CJM 추출물 및 분획물별 신경교세포 보호 효과에 대한 연구는 부족한 상황이다. 또한, 기억력 손상 동물모델에서 CJM의 산화적 스트레스 개선 효과에 대한 연구는 전무한 실정이다. 따라서 본 연구에서는 신경교세포 및 기억력 손상 동물모델에서 산화적 스트레스에 대한 CJM의 보호 효과를 확인하고자 한다. 먼저, C6 신경교세포에 H2O2를 처리하여 산화적 스트레스를 유도한 후 추출물 및 분획물 5종을 처리하여 산화적 스트레스 개선 효과를 평가하고, 이를 바탕으로 CJM 활성분획을 선정하여 기억력 손상 동물모델로 널리 활용되는 스코폴라민(scopolamine) 투여 마우스에서 항산화 효과를 확인하고자 한다.
Materials and Methods
엉겅퀴 추출물 및 분획물 제조
실험에 사용한 CJM은 임실생약(Imsil, Korea)에서 제공받아 사용하였다. CJM는 봄 지상부를 세척 및 건조한 후 환류냉각장치를 이용하여 ethanol (EtOH)로 추출하였다. 그 결과 CJM 총 5.71 kg로부터 EtOH 추출물 667.2 g을 얻었다(수율 11.68%). EtOH 추출물로 유기용매를 이용하여 분획물을 제조하였고, n-hexane 분획물 213.6 g (수율 3.74%), CHCl3 분획물 39.0 g (수율 0.68%), ethyl acetate (EtOAc) 분획물 67.6 g (수율 1.18%), n-butanol 분획물 47.0 g (수율 0.82%)의 4가지 분획물을 얻어 실험재료로 사용하였다.
실험재료 및 시약
세포 배양을 위한 Dulbecco’s modified eagle medium (DMEM), fetal bovine serum (FBS), 100 units·mL-1 penicillin-streptomycin, trypsin-EDTA는 Welgene (Gyeongsan, Korea)에서 구입하였다. 산화적 스트레스를 유발하기 위한 H2O2는 Junsei Chemical Co. (Tokyo, Japan)사의 제품을 구매하여 사용하였다. 세포생존율 측정을 위한 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)는 Bio Basic (Toronto, Canada), dimethylsulfoxide (DMSO)는 Bio Pure (Ontario, Canada)에서 구매하였다. Reactive oxygen species (ROS) 측정을 위한 2′,7′-dichlorofluorescein diacetate (DCFH-DA)와 nitric oxide (NO) 측정을 위한 griess reagent는 Sigma (St. Louis, USA), NaNO2는 Junsei Chemical Co. (Tokyo, Japan)제품을 구매하여 사용하였다. 실험동물의 기억력 감퇴를 유도하기 위한 스코폴라민은 Sigma (St. Louis, USA), NaCl은 LPS solution (Daejeon, Korea)에서 구입하였다. 조직 내 thiobarbituric acid reactive substances (TBARS) 측정을 위한 thiobarbituric acid (TBA)는 Acros Organics (New Jersey, USA), trichloroacetic acid (TCA)와 malondialdehyde (MDA)는 Sigma (Saint Louis, USA), n-butanol은 Duksan (Ansan, Korea), pyridine은 Wako Pure Chemical (Osaka, Japan)에서 제조한 제품을 사용하였다. Western blotting을 위한 radioimmunoprecipitation assay (RIPA) buffer는 Elpis Biotech. (Daejeon, Korea), polyvinylidenefluoride (PVDF) membrane은 Millipore Co. (Billerica, USA), skim milk는 Sigma (Saint Louis, USA), enhanced chemoluminescence (ECL)은 Bio-Rad Lab. (Hercules, USA)사 제품을 구입하여 사용하였다.
세포배양
C6 신경교세포는 한국세포주은행(Korea Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였다. 세포는 37℃, 5% CO2 인큐베이터에서 배양하였고, 세포배양을 위해 100 units·mL-1의 penicillin-streptomycin과 10% FBS가 함유된 DMEM을 배지로 사용하였다. 배양된 세포는 세포분화가 최대에 도달하였을 때 phosphate buffered saline으로 세척한 후 0.02% EDTA가 함유된 0.05% trypsin 용액으로 부착된 세포를 떼어냈다. 원심분리를 통해 세포를 집적시킨 뒤 세포가 골고루 분산되도록 잘 혼합하여 계대배양하였다.
Cell viability 측정
세포가 confluence 상태가 되었을 때 96 well plate에 5 × 104 cells·mL-1로 seeding하여 37℃에서 24시간 동안 배양하였다. 세포가 잘 부착되면 CJM 추출물 및 분획물을 10 μg·mL-1로 희석하여 각 well에 처리하였다. 4시간 후 300 μM H2O2를 처리하여 산화적 스트레스를 유발하였고, 24시간 뒤 5 mg·mL-1 MTT 용액을 각 well에 주입하여 4시간 동안 재배양하였다. MTT 용액에 의해 생성된 formazan 결정은 빛을 차단한 상태에서 30분 간 DMSO에 녹인 뒤 540 nm에서 흡광도를 측정하였다(Mosmann, 1983).
세포 ROS 소거능 측정
세포가 confluence 상태가 되었을 때 96 well black plate에 5 × 104 cells·mL-1로 seeding하여 37℃에서 24시간 동안 배양하였다. 세포가 잘 부착되면 CJM 추출물 및 분획물을 10 μg·mL-1로 희석하여 각 well에 처리하였다. 4시간 후 300 μM H2O2를 처리하여 산화적 스트레스를 유발하였고, 24시간 후 80 μM의 DCFH-DA 용액을 각 well에 주입하여 37℃에서 30분 동안 재배양하여 형광도(excitation-480 nm, emission-535 nm)를 측정하였다(Cathcart et al., 1983).
세포 NO 소거능 측정
세포가 confluence상태가 되었을 때 96 well plate에 5 × 104 cells·mL-1로 seeding하여 37℃에서 24시간 동안 배양하였다. 세포가 잘 부착되면 CJM 추출물 및 분획물을 10 μg·mL-1로 희석하여 각 well에 처리하였다. 4시간 후 300 μM H2O2를 처리하여 산화적 스트레스를 유발하였고, 24시간 후 각 well로부터 상등액을 취하여 griess 용액과 1 : 1 비율로 혼합하였다. 혼합액은 15분간 반응시킨 뒤 540 nm에서 흡광도를 측정하였다(Dirsch et al., 1998).
실험동물
실험동물은 5주령의 수컷 ICR 마우스를 오리엔트바이오(Seongnam, Korea)에서 공급받아 사용하였다. 실험동물의 사육실은 온도 20 ± 2℃, 습도 50 ± 10%, 12시간 간격으로 light-dark cycle을 유지하였고, 물과 식이는 자유롭게 공급하였다. 1주일의 적응기간을 가진 뒤, 군 당 평균체중이 동일하도록 하여 정상군(normal), 스코폴라민 투여군(control), 스코폴라민 투여 및 50 mg·kg-1·day-1 CJM EtOAc fraction 섭취군(EACJM50), 스코폴라민 투여 및 100 mg·kg-1·day-1 CJM EtOAc fraction 섭취군(EACJM100)으로 나누었다. EACJM은 정수에 녹여 14일간 매일 1회 경구투여 하였으며, 시료를 섭취하지 않은 normal 및 control군은 시료 대신 정수를 경구투여 하였다. 실험종료 8일 전부터 행동실험을 실시하였으며, 행동실험을 시작하기 30분 전 기억력 손상을 유도하기 위해 스코폴라민을 투여하였다. 스코폴라민은 1.5 mg·kg-1·day-1 농도로 매일 1회 복강투여 하였고, 기억력 손상을 유도하지 않은 normal군은 스코폴라민 대신 생리식염수(0.9% NaCl)를 복강투여 하였다. 행동실험이 종료된 후 실험동물은 졸레틸-럼푼(3 : 2, v·v-1) 혼합액으로 마취한 뒤 심장으로부터 혈액을 채취하고 생리식염수로 관류시켜 장기 내 혈액을 제거하였다. 이후 실험에 사용할 조직을 적출한 뒤 무게를 측정하고 보관용기에 담아 밀봉하여 -80℃ deep freezer에 냉동보관하며 실험에 사용하였다. 본 실험은 부산대학교 동물실험윤리위원회의 승인을 받아 수행되었다(승인번호: PNU-2021-0079).
뇌 조직 ROS 측정
실험동물로부터 적출한 뇌 조직은 0.9% NaCl을 이용하여 균질화한 후 4℃에서 3,000 rpm으로 15분간 원심분리를 2회 반복하여 조직 상층액을 분리하였다. 뇌 조직 상층액을 phosphate-buffered saline과 혼합한 뒤 12.5 mM DCFH-DA를 첨가하여 실온에서 10분간 반응시킨 후 반응액의 형광도(excitation-480 nm, emission-535 nm)를 측정하여 ROS 생성량을 확인하였다(Muhammad et al., 2019).
뇌 조직 TBARS 측정
뇌 조직 상층액에 46 mM TBA와 920 mM TCA 혼합액을 첨가한 후 100℃에서 20분간 반응시켰다. 이후 n-butanol과 pyridine 혼합액을 첨가한 후 4℃에서 3,000 rpm으로 20분간 원심분리 하였고, 상층액의 흡광도를 540 nm에서 측정하였다. 표준곡선으로는 MDA를 사용하였으며, 농도별 MDA를 제조한 후 흡광도를 측정하여 지질과산화 정도를 산출하였다(Ohkawa et al., 1979).
뇌 조직 NO 측정
뇌 조직 상층액을 증류수와 혼합한 뒤 griess 용액을 첨가하여 실온에서 30분간 반응시켰으며, 반응액의 흡광도를 540 nm에서 측정하였다. 표준곡선으로는 NaNO2를 사용하였으며, 농도별 NaNO2를 제조한 후 흡광도를 측정하여 NO 생성 정도를 산출하였다(Tsikas, 2007).
Western blotting
실험동물로부터 적출한 뇌 조직은 RIPA buffer와 protease inhibitor cocktail을 혼합하여 만든 lysis buffer를 이용하여 균질화한 후 4℃에서 12,000 rpm으로 30분간 원심분리 하여 단백질을 분리하였다. 동량의 단백질을 10% sodium dodecyl sulfate polyacrylamide gel로 전기영동하여 분리하고, PVDF membrane에 단백질을 transfer하였다. 5% Skim milk에 PVDF membrane을 1시간 반응시켜 비특이적 결합을 blocking한 후 1차 항체를 희석하여 overnight 반응시켰다. 실험에 사용한 1차 항체는 β-actin (1 : 1000, Cell Signaling Tech., MA, USA), superoxide dismutase (SOD, 1 : 500, Abcam Inc., MA, USA), glutathione peroxidase (GSH-px, 1 : 500, Abcam Inc.)이다. 이후 적절한 2차 항체(1 : 1000, Cell Signaling Tech.)를 1시간 동안 반응시킨 후 ECL 용액을 이용하여 단백질 발현을 확인하였다.
통계분석
실험 결과는 Statistical Package for the Social Sciences (SPSS) 26 software (Chicago, IL, USA) 프로그램을 이용하여 분석하였다. 각 실험값은 평균 ± 표준편차로 표시하였다. 통계적 분석은 one-way analysis of variance (ANOVA)를 시행하였으며, Duncan’s multiple test를 이용하여 p < 0.05 미만일 경우 통계적으로 유의한 것으로 판정하였다. 각 군내 짝지어진 두 지표의 비교는 Student’s t-test를 이용하였으며, p < 0.05 미만일 경우 통계적으로 유의한 것으로 판정하였다.
Results and Discussions
인구 고령화로 인해 알츠하이머 치매에 대한 관심이 증가하면서 알츠하이머 치매의 치료 약제에 대한 연구도 활발히 수행되고 있다. 현재 임상에서는 알츠하이머 치매 치료를 위해 아세틸콜린에스터라제 억제제(acetylcholinesterase inhibitor)로써 donepezil, galantamine, rivastigmine 등이 주로 처방되고 있다(Polinsky, 1998). 그러나 이들 약물은 단지 병의 진행을 지연시키기만 할 뿐 근본적인 알츠하이머 치매 치료제는 아니며, 사용 시 오심, 구토, 식욕부진, 어지럼증, 수면장애 등의 부작용이 빈번히 나타난다. 특히 노인환자의 비중이 매우 높은 알츠하이머 치매의 경우 이러한 부작용은 더욱 심각한 문제를 초래할 수 있으므로 부작용이 적은 천연물 유래 치료제의 개발이 시급한 상황이다(Dawson and Iversen, 1993). 따라서 본 연구에서는 국내에 자생하는 천연소재인 CJM의 산화적 스트레스 개선 효과를 확인하여 CJM이 알츠하이머 치매의 예방 및 치료물질로 활용될 수 있을지 그 가능성을 평가하고자 한다.
H2O2 처리 C6 신경교세포에서 세포생존율에 대한 CJM의 효과
뇌는 신경세포와 신경교세포로 이루어져 있으며, 그 중 신경교세포는 전체 뇌세포의 약 90%를 차지한다. 신경교세포는 단순히 신경계의 구조를 지지하는 기능을 한다고 여겨져 왔으나, 최근의 연구를 통해 신경세포에 영양을 공급하고 신경세포가 정상적인 기능을 유지할 수 있도록 도울 뿐만 아니라 퇴행성 뇌 질환의 발병에도 중요한 역할을 한다는 사실이 밝혀지고 있다(Block and Hong, 2005). 알츠하이머 치매 환자의 뇌에는 Aβ가 축적되며 이로 인해 산화적 스트레스가 발생하고 시냅스와 신경세포가 손상되는데, 이 때 신경교세포가 식세포 작용을 통해 Aβ를 제거하여 신경세포의 손상 및 상실을 억제한다(Chung et al., 2015). 한편, 신경교세포가 과도하게 활성화되어 염증반응이 일어나면 신경세포의 사멸을 촉진함으로써 오히려 알츠하이머 치매를 악화시킬 수도 있다(Hashioka et al., 2021). 따라서 본 연구에서는 신경교세포 손상에 대하여 CJM의 보호 효과를 확인함으로써 알츠하이머 치매 예방 및 치료적 가능성을 확인하였다. C6 glial 세포는 신경교세포 보호 효과를 확인하기 위해 널리 사용되며, 특히 다수의 논문에서 C6 glial 세포에 H2O2를 처리하여 시료의 항산화 효과를 확인하였다(Jiang et al., 2020; Kim et al., 2020a). 이를 바탕으로 본 연구에서도 C6 glial 세포와 H2O2를 이용해 CJM의 항산화 활성을 살펴보았다.
MTT는 살아있는 세포 내에 산화환원효소 작용에 의해 환원되어 보라색의 formazan을 형성하는데, 이를 용해하여 발색정도를 측정함으로써 세포생존율을 측정하는 데 널리 사용되고 있다(Mosmann, 1983). 이에 따라 MTT assay를 수행하여 세포생존율을 확인한 결과(Table 1), H2O2를 처리한 control군의 세포생존율은 78.5%로, 아무것도 처리하지 않은 normal군의 세포생존율인 100%에 비하여 유의적으로 세포생존율이 감소되어 신경교세포 손상이 일어났음을 확인하였다. 반면, CJM 분획물을 처리한 군에서는 control군과 비교했을 때 세포생존율이 유의적으로 증가하여 CJM 분획물의 신경교세포 보호 효과를 확인할 수 있었다. 특히 EtOAc 분획물은 세포생존율을 86.45%까지 상승시키는 효과를 나타내어 가장 우수한 세포 보호 효과를 나타냈다.
H2O2 처리 C6 신경교세포에서 ROS 생성에 대한 CJM의 효과
DCFH-DA는 세포 내에서 탈아세틸화 되면서 DCF-H로 전환되고, DCF-H는 ROS와 반응하여 형광을 나타내는 DCF로 전환되므로 형광도를 측정함으로써 세포 내 ROS 생성량을 확인할 수 있다(Cathcart et al., 1983). 따라서 DCFH-DA assay를 실시한 결과(Fig. 1), 신경교세포에 H2O2를 처리한 control군에서 ROS를 측정했을 때, 아무것도 처리하지 않은 normal군의 100%에 비해 118.67%까지 상승하였다. 한편, CJM 추출물 및 분획물 처리군에서는 ROS 생성량이 control군보다 유의적으로 저하됨을 확인하였다. 즉, H2O2에 의해 산화적 스트레스가 발생하였으나 CJM 추출물 및 분획물을 처리함으로써 산화적 스트레스가 감소한 것으로 사료된다. CJM 추출물 및 분획물 중에서도 EtOAc 분획물은 ROS 생성량을 control군 118.67% 대비 101.82%까지 감소시켰다.
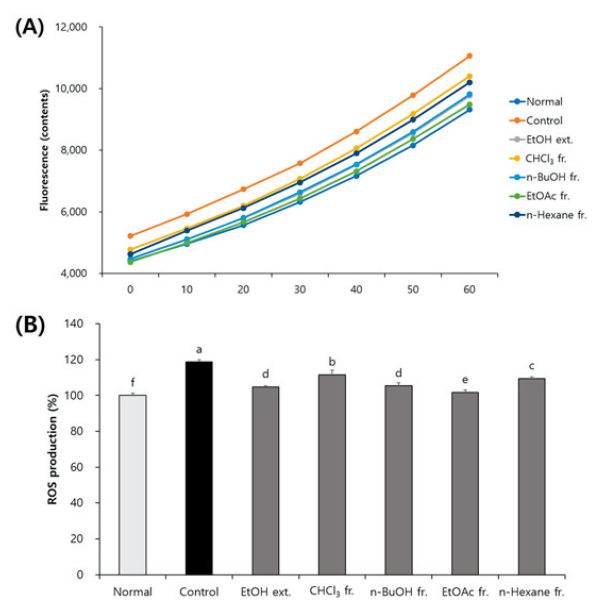
Fig. 1. Effect of Cirsium japonicum var. maackii on reactive oxygen species (ROS) production in H2O2-treated C6 glial cells. Extract (ext.) and fractions (fr.) were treated with 10 μg·mL-1. Time course of change in intensity of ROS fluorescence during 1 h (A) and production of ROS at 1 h (B). Values are means ± SD. a - f: Means with the different letters are significantly different (p <0.05) by Duncan’s multiple range test.
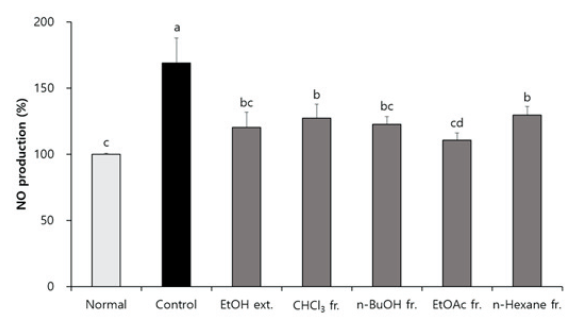
H2O2 처리 C6 신경교세포에서 NO 생성에 대한 CJM의 효과
알츠하이머 치매 환자의 뇌에서 신경교세포는 면역반응을 일으켜 신경염증을 유도하며, 그 과정에서 NO를 포함한 다양한 염증매개물질의 분비를 촉진하여 신경독성을 유발한다(Galea et al., 1996; Penke et al., 2017). CJM 추출물 및 분획물이 신경교세포의 NO 생성량에 영향을 미치는지 확인하기 위하여 NO assay를 수행하였다(Fig. 2). 신경교세포에 H2O2를 처리한 경우 NO 생성량이 168.90%만큼 증가하여 아무것도 처리하지 않은 normal군의 100%에 비해 염증매개물질의 분비가 촉진됨을 확인하였다. 반면, CJM 추출물 및 분획물 처리군에서는 control군에 비해 NO 생성량이 유의적으로 감소하여 CJM이 신경염증을 감소시키는 것으로 생각된다. 특히 EtOAc 분획물 처리군에서는 110.75%로 NO 생성량이 크게 감소하여 신경염증을 효과적으로 억제할 것으로 기대된다.
CJM 추출물 및 분획물의 활성을 비교한 이전 연구에 따르면 EtOAc 분획물이 다른 추출 및 분획물에 비해 aldose 환원효소를 효과적으로 억제하고, 산화적 스트레스를 유발하는 ROS (DPPH, ·OH 및 O2- 라디칼) 소거능도 우수한 것으로 나타났다(Lee et al., 2017; 2018). 뿐만 아니라 Aβ를 처리한 C6 신경교세포에서 CJM 추출 및 분획물 중 EtOAc 분획물이 세포 보호 활성이 가장 우수하였다(Kim et al., 2020c). 이들 연구와 마찬가지로 본 연구에서도 EtOAc 분획물이 H2O2로 유도된 ROS와 NO의 과생성을 감소시켜 C6 신경교세포를 가장 효과적으로 보호하는 것으로 확인되었다. 따라서 CJM EtOAc (EACJM)분획물을 활성 획분으로 선정하여 동물실험을 진행하였다.
스코폴라민 투여 마우스에서 뇌 내 산화적 손상에 대한 EACJM의 효과
스코폴라민은 뇌에서 콜린성 기능장애 뿐만 아니라 산화적 스트레스를 유발함으로써 기억력 손상을 유도한다(Konar et al., 2019). 이에 착안하여 스코폴라민을 투여하는 기억력 감퇴 동물모델이 제작되었으며, 시료의 항치매 효과를 탐색하기 위해 널리 사용되고 있다(Karthivashan et al., 2018; Kim et al., 2020b). 본 연구에서도 CJM의 항산화로 유도한 기억력 개선 효과를 확인하기 위해 스코폴라민 투여 마우스 모델을 사용하였다.
스코폴라민은 산화적 스트레스에 취약한 뇌 조직에서 MDA와 같은 지질과산화물을 생성시키는데, 지질과산화물은 신경독성을 갖는 것으로 알려져 있다(Sohn et al., 2021). 본 연구에서는 스코폴라민에 의해 발생하는 뇌 내 산화적 손상에 대하여 EACJM이 보호 효과를 나타내는지 알아보기 위해 뇌 조직에서 ROS와 지질과산화물 수준을 측정하였다(Fig. 3). 스코폴라민을 투여한 control군의 뇌 조직에서 ROS는 normal군의 100%에 비해 171.56%까지 상승하였고, 지질과산화물은 normal군 80.71 nmol·L-1에 비해 139.01 nmol·L-1까지 증가하였다. 반면, EACJM50 및 100군에서는 ROS와 지질과산화물 모두 감소하였는데, 특히 지질과산화물은 각각 81.51 nmol·L-1 및 81.52 nmol·L-1로 normal군과 비슷한 수준까지 감소시키는 것으로 나타났다. 이전 연구에서도 CJM은 ROS 생성을 효과적으로 억제한 것으로 보고되었는데, SH-SY5Y 신경세포와 PC12 신경세포, 그리고 C6 신경교세포에서 산화적 손상 유발물질인 H2O2에 의한 ROS 생성을 감소시켰다(Jang and Kim, 2016; Lee et al., 2018; Kim et al., 2021). 따라서 EACJM은 스코폴라민으로 유도된 뇌 내 산화적 손상에 대하여 보호 효과를 나타내는 것으로 사료된다.
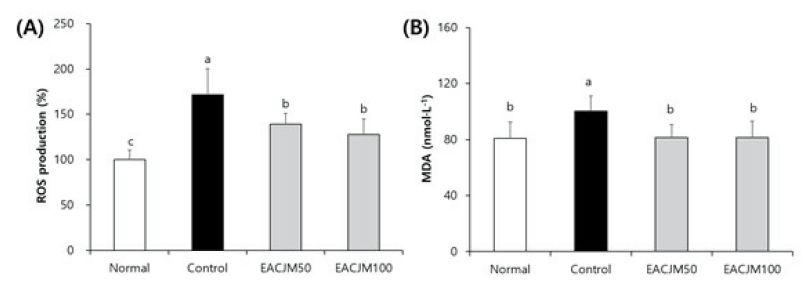
Fig. 3. Effects of ethyl acetate fraction from Cirsium japonicumvar. maackii (EACJM) on reactive oxygen species (ROS) production (A) and thiobarbituric acid reactive substances (B) in brain from scopolamineinjected mice (n = 6). Values are means ± SD. MDA, malondialdehyde; Normal, 0.9% NaCl + water; Control, scopolamine + water; EACJM50, scopolamine + EACJM (50 mg·kg-1·day-1); EACJM100, scopolamine + EACJM (100 mg·kg-1·day-1). a - c: Means with the different letters are significantly different (p < 0.05) by Duncan’s multiple range test.
스코폴라민 투여 마우스에서 뇌 내 염증에 대한 EACJM의 효과
아세틸콜린은 신경전달물질로써 기억 메커니즘에 관여할 뿐만 아니라 염증성 사이토카인의 방출을 억제하여 염증반응으로부터 뇌를 보호한다. 그러나 스코폴라민을 투여하면 아세틸콜린의 활성이 감소하여 대뇌피질 부위의 염증성 사이토카인의 발현이 증가하며, 이는 신경염증의 발생으로 이어질 수 있다(Heneka et al., 2010; Jung et al., 2011). 스코폴라민을 투여함으로써 유발된 뇌 내 신경염증에 대한 EACJM의 효과를 확인하기 위해 뇌 조직에서 NO 농도를 측정하였다(Fig. 4). 스코폴라민을 투여한 control군의 뇌 조직에서 NO 농도가 53.38 μmol·L-1로 normal군의 38.44 μmol·L-1과 비교하여 약 1.4배 증가함을 확인하였다. 그러나 EACJM50군은 42.37 μmol·L-1, EACJM100군은 43.34 μmol·L-1로 나타나 EACJM 투여군에서는 control군에 비해 NO 농도가 유의적으로 감소한 것을 알 수 있었다. 이전 연구에 따르면 EACJM은 신경세포에서 산화적 손상으로 유발된 NO 생성을 감소시켰다(Kim et al., 2021). 또한 CJM은 lipopolysaccharide를 처리하여 염증반응을 유도한 RAW264.7 대식세포에서 NO 생성을 감소시켜 염증을 억제하였으며, 이는 CJM 활성물질인 cirsimaritin이 염증성 사이토카인인 tumor necrosis factor-α, interleukin-6, 및 inducible nitric oxide synthase의 활성을 저해했기 때문이라고 보고되었다(Shin et al., 2017). 이들 결과를 바탕으로 EACJM은 스코폴라민에 의해 발생한 뇌 내 염증반응으로부터 신경세포 및 뇌 조직을 보호하는 것으로 나타났다.
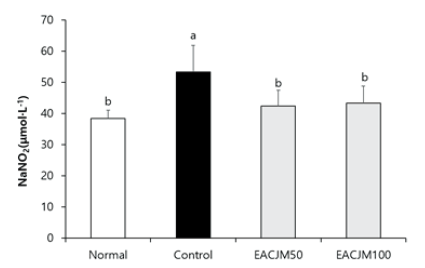
Fig. 4. Effects of ethyl acetate fraction from Cirsium japonicum var. maackii (EACJM) on nitric oxide (NO) production in brain from scopolamine-injected mice (n = 6). Values are means ± SD. Normal, 0.9% NaCl+ water; Control, scopolamine + water; EACJM50, scopolamine + EACJM (50 mg·kg-1·day-1); EACJM100, scopolamine + EACJM (100 mg·kg-1·day-1). a - b: Means with the different letters are significantly different (p < 0.05) by Duncan’s multiple range test.
스코폴라민 투여 마우스에서 뇌 내 항산화 관련 단백질 발현에 대한 EACJM의 효과
뇌는 다른 조직에 비해 산소 소모량과 불포화지방산 함량이 높아 산화적 스트레스에 취약하지만, 항산화 방어체계를 통해 산화적 손상을 감소시킨다. 항산화 방어체계와 관련된 주요한 효소로는 SOD와 GSH-px가 있는데, SOD는 미토콘드리아의 전자전달계에서 생성된 O2-를 H2O2로 환원시키며, GSH-px가 H2O2를 무독성의 H2O로 전환하여 ROS로부터 뇌를 보호한다(Matés and Sánchez-Jiménez, 1999). 본 연구에서도 뇌 조직에서 EACJM이 항산화 효소 활성에 영향을 미치는지 알아보기 위해 관련된 단백질 발현을 측정하였다(Fig. 5). 스코폴라민을 투여한 control군에서 SOD와 GSH-px의 단백질 발현은 normal군에 비해 유의적으로 감소하였다. 그러나 EACJM 투여군에서는 control군에 비해 SOD와 GSH-px 단백질 발현이 크게 증가하였다. 이전 연구에 따르면 EACJM은 항산화 단백질인 heme oxygenase, thioredoxin reductase 1, 및 NAD(P)H quinone oxidoreductase 1의 활성을 증가시킬 뿐만 아니라 in vitro에서 O2-을 비롯한 자유라디칼(free radical)을 효과적으로 감소시켰다(Lee et al., 2018; Kim et al., 2021). 이들 결과를 바탕으로 EACJM은 스코폴라민으로 인해 저하된 항산화 방어체계를 활성화함으로써 뇌 내 ROS를 소거하여 지질과산화물 생성을 억제하고 신경세포를 보호하는 것으로 사료된다.
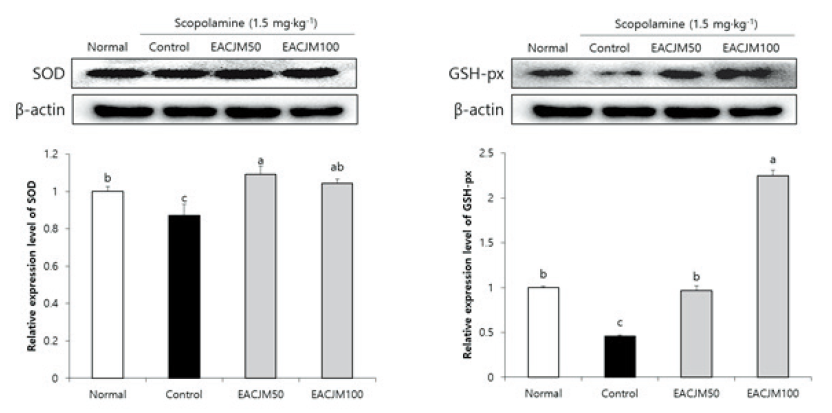
Fig. 5. Effects of ethyl acetate fraction from Cirsium japonicum var. maackii (EACJM) on antioxidative system-related protein expressions in brain from scopolamine-injected mice (n = 6). Values are means ± SD. SOD, superoxide dismutase; GSH-px, glutathione peroxidase. Normal, 0.9% NaCl + water; Control, scopolamine + water; EACJM50, scopolamine + EACJM (50 mg·kg-1·day-1); EACJM100, scopolamine + EACJM (100 mg·kg-1·day-1). a - c: Means with the different letters are significantly different (p < 0.05) by Duncan’s multiple range test.
이전 연구에 따르면 EACJM에는 cirsimarin, cirsimaritin, hispidulin 등의 활성물질이 함유되어 있으며, 이들은 다양한 생리활성을 가지는 것으로 알려져 있다(Lee et al., 2017). 특히 hispidulin은 flavonoids 화합물로, 여러 연구에서 우수한 항산화 효과를 나타냈다. 예를 들어 Kut 등(2022)에 따르면, hispidulin은 적혈구막에서 지질과산화를 막는 항산화제로 작용하여 적혈구를 보호하였다. 또한 뇌 허혈 동물모델에서 hispidulin이 Nrf2 항산화 경로를 유도함으로써 신경보호 효과를 나타내는 것으로 보고되었다(An et al., 2018). 따라서 세포 및 동물에서 나타난 EACJM의 항산화 효과는 hispidulin을 포함한 다양한 활성물질에 의한 것으로 사료된다.
본 연구를 통해 CJM의 신경교세포 보호 효과 및 기억력 개선 효과를 평가하였다. CJM 추출물 및 분획물은 산화적 스트레스에 대하여 신경교세포의 세포생존율을 증가시켰으며, H2O2에 의해 발생한 ROS와 NO 생성량을 감소시켰다. 그 중에서도 EtOAc 분획물은 신경교세포 효과에 있어 가장 강한 활성을 나타내어 EtOAc 분획물을 이용하여 동물실험을 진행하였다. EACJM은 뇌 조직에서 스코폴라민에 의해 생성된 ROS를 억제하여 지질과산화물과 NO 수준을 감소시켰는데, 이러한 효과는 항산화 효소인 SOD와 GSH-px의 단백질 발현의 증가로부터 비롯된 것으로 사료된다. 이러한 결과를 바탕으로 CJM은 항산화 효과를 통하여 알츠하이머 치매의 예방 및 치료용 천연소재로서 이용될 수 있을 것으로 사료된다.
Authors Information
Min Jeong Kim, http://orcid.org/0000-0001-7276-0672
Byeong Wook Noh, Pusan National University, Master student
Qi Qi Pang, Pusan National University, Ph.D. student
Sanghyun Lee, http://orcid.org/0000-0002-0395-207X
Ji-Hyun Kim, Pusan National University, Postdoctoral researcher
Eun Ju Cho, http://orcid.org/0000-0003-4282-3219