Introduction
세포사멸(apoptosis)은 손상되거나 기능이 필요가 없어진 세포와 조직을 제거하는 수단으로 크게 외재적(extrinsic)과 내재적(intrinsic) 사멸로 구분된다(Tait and Green, 2010). 세포 내 reactive oxygen species (ROS)의 증가는 내재적 세포사멸과 관련이 있다고 알려져 있다(Simon et al., 2000). 세포 내 ROS는 DNA 손상과 지질과산화 및 단백질과 반응하여 노화나 신경계질환 및 각종 질환의 주원인으로써, ROS의 항상성을 유지하는 것이 세포의 성장과 생존에 매우 중요하다(Simon et al., 2000; Ozben, 2007). 내재적 세포사멸은 세포 내 ROS 증감에 따라 anti-apoptosis 단백질인 Bcl-xL와 Bax 단백질이 미토콘드리아 막에서 발현에 의해 cytochrome c을 방출한다(Li et al., 1997; Srinivasula et al., 2001). 반면, 외재적 세포사멸은 casepase단백질들을 잘라냄으로써 세포의 역할을 하지 못하게 하여 세포사멸에 이르게 한다(Boatright and Salvesen, 2003).
신경세포는 신호전달을 위한 구조 특성상 지방성분이 많아 산화적 스트레스에 매우 취약한 것으로 알려져 있으며, ROS의 과잉 생성은 뇌신경세포의 기능장애 및 세포사멸을 유발한다(Lee et al., 2018; Nam et al., 2019). 과도한 산화적 스트레스로 인해 퇴행성 뇌신경질환이 유발되고 이로 인해 인지능력과 기억력장애가 발생되는 것으로 알려져 있다(Heo et al., 2004; Bidchol et al., 2011). 또한, 신경세포인 PC12 세포는 Bcl-2 계열 단백질과는 독립적으로 caspase에 의해서도 세포 사멸이 조절 될 수 있다고 알려져 있기 때문에 PC12 세포는 신경 세포사멸 기전을 연구하는데 매우 유용한 모델이다(Boatright and Salvesen, 2003).
큰금계국(Coreopsis lanceolate, CL)은 여러해살이 국화과(Compositae) 식물로 아메리카 대륙이나 동아시아에 많이 분포 되어 있으며, 우리나라에서도 5 - 7월에 노란 꽃을 피우며 주변에서 흔히 관찰할 수 있으며 세포 손상에 대한 방어, 항염증과 항균효과를 나타내는 phenylpropanoids와 flavonoids성분이 함유되어 있다(Reichling and Thron, 1989). Flavonoid는 항산화 효과, 항암억제효과 및 혈당강하 등의 기능성이 보고되어 있다. 특히, 큰금계국에는 quercetin, luteolin, butin, apigenin 등의 flavonoids 성분이 있다고 알려져 있다(Zhang et al., 2006; Kim et al., 2019). 최근 큰금계국의 생리활성 연구가 진행되고 있으나 산화 스트레스 유도 손상에 대한 신경 세포사멸에 대한 연구는 아직 미흡한 실정이다.
따라서, 본 연구에서는 큰금계국의 꽃을 제외한 지상부 추출물이 ROS가 유발된 신경세포의 세포사멸억제 기전연구를 하였다. 이를 통한 큰금계국의 신경세포 손상 보호 효과를 통한 기능성소재 개발 가능성을 제시하였다.
Materials and Methods
추출물 제조
실험에 사용된 큰금계국(CL) 시료는 2018년 충북 음성군에서 채취한 것으로 지상부(잎과 줄기, Coreopsis lanceolate aerial part [CLA])를 동결 건조하여 분말화 하였다. 건조된 100 g CLA을 70% 에탄올로 실온에서 24시간 동안 추출하였다(시료·용매 비율, 1 : 10). 여과 후, 추출물을 vacuum evaporator (Ratavapor R-121, Buchi, Flawil, Switzerland)로 감압농축하고 동결 건조시킨 후 -80℃에 저장하여 실험에 사용하였다.
총 페놀과 플라보노이드 함량 측정
총 페놀 함량은 Folin-Dennis법에 의해 측정하였다(Folin and Denis, 1912). 각 추출물(3 mg·mL-1) 500 μL 추출물 (100 μg·mL-1)을 2 N Folin-Ciocalteu 시약 50 μL와 3 분간 혼합하였고, 20% sodium carbonate anhydrous 용액 100 μL를 넣고 1시간 동안 상온에서 반응시켰다. 흡광도는 multi-plate reader (Biotek, Vermont, USA)를 사용하여 725 nm에서 측정하였으며 기준물질로는 gallic acid (Sigma-Aldrich, St. Louis, MO, USA)을 사용하였고, gallic acid로 작성한 표준 곡선으로부터 함량을 구하였다.
플라보노이드 함량은 각 추출물 (100 μg·mL-1) 150 μL에 10% aluminum chloride과 1 M potassium acetate를 각각 10 μL씩 넣은 후 증류수 280 μL와 혼합하였다. 혼합물은 실온에서 30분 동안 유지시킨 후 multi-plate reader를 사용하여 415 nm에서 흡광도를 측정 하였다(Pourmorad et al., 2006). 기준물질로는 (+)-catechin (Sigma-Aldrich, St. Louis, MO, USA)을 사용하였고, 기준물질로 작성한 표준 곡선으로 함량을 구하였다.
ABTS+ [2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)+]라디칼 소거 측정
ABTS+ 소거능 측정하기 위하여 ABTS tablet (Sigma-Aldrich, St. Louis, MO, USA)을 7 mM 농도로 H2O에 용해시킨 후 2.45 mM potassium peroxodisulfate (Sigma-Aldrich, St. Louis, MO, USA) 와 1 : 1 비율로 혼합시켜 12에서 16시간 상온에 둔 후 사용하였다. 시료 20 μL와 ABTS 용액 180 μL를 섞어 실온으로 암실에서 30분간 배양했다. 흡광도는 734 nm에서 multi-plate reader를 사용하여 측정하였다(Ilavenil et al., 2014). 대조군으로는 에탄올만을 첨가하였으며, ascorbic acid (Sigma-Aldrich, St. Louis, MO, USA)를 양성대조군으로 사용하였다. ABTS+ 라디칼 소거활성은 다음과 같이 계산한 후(% inhibition = [Acomtrol - Asample]/Acontrol), 라디칼을 50% 저해하는 농도 값인 IC50값을 사용하여 나타내었다.
DPPH (2,2-diphenyl-1-picrylhydrazyl) 라디칼 소거능 측정
DPPH free radical 소거능 측정하기 위해 DPPH를 0.2 mM로 에탄올에 용해시켜 DPPH 용액을 제조하였다. 시료 50 μL와 0.2 mM DPPH 용액 200 μL를 섞어 암실에서 30분간 유지시킨 후 517 nm에서 multi-plate reader를 사용하여 측정 하였다(Ko et al., 2012). 대조군으로는 에탄올만을 첨가하였으며, ascorbic acid를 양성대조군으로 사용하였다. DPPH 라디칼 소거능의 비율은 다음과 같이 계산한 후(% inhibition = [Acomtrol - Asample]/Acontrol), 라디칼을 50% 저해하는 농도 값인 IC50값을 사용하여 나타내었다.
HPLC (high-performance liquid chromatography)에 의한 페놀 성분 분석
페놀 성분 분석을 위해 추출물에서 phenol-rich fraction을 얻어 사용하였다(Kim et al., 2018). 활성시료와 동일한 CLA 추출물(5 g)을 물에 용해시키고 ethyl acetate·ethyl ether (1 : 1 = v·v-1)로 분획하여 phenol-rich fraction을 얻었다. 각 분획을 감압 하에 농축시킨 후 메탄올에 각각 10 mg·mL-1이 되도록 용해시키고 0.45 μm poly-vinylidine difluoride (PVDF) membrane (Pall Co., NY, USA)으로 여과하여 준비하였다. 페놀 성분은 Aglient 1200 series HPLC (Aglient Technology, Santa Clara, CA, USA)으로 분석하였으며, C18 컬럼 (synergy fusionRP column, 250 × 4.6 mm, 4 μm; Phenomenex, Torrance, CA, USA)을 사용하여 35℃에서 분석되었다. 분석 조건은 Kim 등(2018)의 방법을 사용하였으며 이동상은 용매 A (0.5% acetic acid in water) 및 용매 B (0.5% acetic acid in acetonitrile), 검출 파장은 280 nm, 유속은 1.0 mL·min-1, 주입량은 10 μL로 하였다. 표준물질로는 gallic acid, homogentisic acid, chlorogenic acid, (+) - catechin hydrate, caffeic acid, p-coumaric acid, ferulic acid, naringin, quercetin hydrate, cinnamic acid (Sigma-Aldrich, St. Louis, MO, USA)가 사용되었으며 모든 표준물질은 메탄올에 용해시킨 후 0.45 μm PVDF membrane로 여과하여 사용하였다.
세포주 배양
본 연구에 사용한 신경 세포(pheochromocytoma 12, PC12)는 ATCC (Manassas, VA, USA)에서 구입하였다. 세포는 10% Fetal Bovine Serum (FBS; Gibco, Grand Island, NY, USA)과 1% penicillin과 streptomycin이 포함된 Dulbecco’s-modified Eagle’s medium (DMEM; Gibco, Grand Island, NY, USA) 배지로 2일마다 교체하였으며 배양기(MCO-2OAIC, Sanyo, Japan)에서 37℃, 5% CO2로 유지하였다.
세포 생존율 측정
PC12 세포에서 세포생존율의 측정을 위하여 MTS [3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium], inner salt; Promega, Madison, WI]를 사용하였다. 96 well plate에 1.0 × 105 cells·mL-1의 농도로 세포를 분주하여 배양한 후, CLA 추출물을 농도별(0, 50, 100, 200 μg·mL-1)로 24시간 동안 처리하였다. 그 후, H2O2 (50 μM)로 20분 동안 처리하고 MTS를 처리한 후 2시간 이내에 multi-plate reader를 사용하여 490 nm에서 흡광도를 측정하였다.
세포 내 ROS 생성량 측정
세포 내 ROS수치는 DCF-DA를 이용하여 측정하였다. PC12 세포를 96 well plate에 1.0 × 105 cells·mL-1를 분주한 후 24시간 동안 세포를 안정화시켰다. CLA 추출물을 농도별(50, 100, 200 μg·mL-1)로 전처리하고 24시간 배양 후 50 μM H2O2로 20분간 처리하였다. 20 μM의 DCF-DA (Sigma-Aldrich, St. Louis, MO, USA)로 30분간 염색하고 PBS로 3회 세척한 후 형광을 측정하였다. 형광은 multi-plate reader를 이용하여 485 nm에서의 excitation filter 및 535 nm에서의 emission filter에서 측정하였다.
단백질 발현 분석
PC12 세포는 CLA 추출물을 농도별(50, 100, 200 μg·mL-1)로 24시간 동안 전처리 후, 50 μM H2O2로 20분 동안 처리하고 회수하여 사용하였다. 세포는 radioimmunoprecipitation assay (RIPA) buffer (Cell signaling, Danvers, MA, USA)로 용해한 후 얼음에서 30분간 반응시켰다. 세포 용해액을 4℃, 13,000 rpm에서 30분간 원심 분리한 후 상층액을 Bradford 시약(Biorad, Hercules, CA, USA)으로 단백질을 정량 하였다. 단백질을 12% sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)에서 전기영동 하여 분리하였으며 단백질은 PVDF membrane (Merck Millipore, Burlington MA, USA)으로 옮겨 30분간 blocking (5% Bovine serum albumin in TBS-T)하였다. 1차 항체(Bax, Bcl-2, cytochtome c, caspase 3, caspase 9 및 β-actin; Abcam, Cambridge, UK)를 1 : 1,000으로 희석하여 4℃에서 24시간 반응시켰다. 반응시킨 PVDF membrane을 TBS-T로 3번 세척하고 2차 항체(mouse anti-rabbit IgG-HRP; Santacruz, Dallas, TX, USA)를 1 : 2,000으로 희석하여 실온에서 1시간 반응시킨 뒤 TBS-T로 10분 간격으로 3번 세척하였다. 단백질 발현은 enhanced chemiluminescence (ECL) western blotting detection kit (Biorad, Hercules, CA, USA)로 반응시켜 Davinch-K chemilumination (DAVINCH, Seoul, Korea)로 확인하였다.
통계 처리
모든 실험은 3회 반복 실시하였으며, 평균(mean) ± 표준편차(standard deviation, SD)로 표기하였다. One-way analysis of variance (ANOVA)를 실시하였고, Tukey’s Multiple Comparison test (Prism 5.02 GraphPad Software, San Diego, CA, USA)로 사후검증을 실시하였다.
Results and Discussion
CLA의 항산화 성분 및 항산화 활성
식물에는 플라보노이드를 포함한 다양한 페놀계 화합물들이 존재하고 색과 맛에 영향 줄 뿐만 아니라 항산화, 항암 등의 여러 가지 생리활성을 가지고 있는 것으로 알려져 있다(Ho, 1992; Ebrahimzadeh et al., 2008). 따라서, CLA의 총 페놀과 총 플라보노이드 함량을 측정한 결과 22.3 mg·g-1 및 16.2 mg·g-1로 측정되었다(Table 1).
항산화 활성을 평가하는 방법은 다양하게 알려져 있지만 그 중에서도 DPPH radical 소거활성과 ABTS+ radical 소거 활성은 짧은 시간 내에 간단하게 항산화 활성을 측정하기 위한 방법으로 널리 사용되고 있다(Park, 2014). CLA의 항산화 활성을 알아보기 위해 DPPH와 ABTS+ radical 소거 활성을 측정한 결과, IC50 값이 127.4 μg·mL-1 및 31.6 μg·mL-1로 확인되었다(Table 1). 항산화 활성 평가를 위한 양성 대조군으로 사용한 AA는 매우 강한 항산화 특성을 가지고 있다고 잘 알려져 있다(Meister, 1992). ABTS+ 소거능에서 CLA의 IC50 값은 31.6 ± 0.3 μg·mL-1로 AA의 IC50 값은 34.1 ± 0.3 μg·mL-1로 항산화활성이 높은 것으로 나타났다. 이 결과는 CLA가 강력한 황산화제 이용이 가능한 것으로 볼 수 있다.
CLA의 HPLC를 이용한 페놀 성분 분석
식물의 페놀성분은 생태학적 및 생리학적 환경에 의한 반응으로 합성된다(Chung et al., 2003). 페놀성분은 방향족 고리에 한 개 이상의 hydroxyl 작용기를 가지고 있는 화합물을 말한다(Balasundram et al., 2006). 또한, CLA와 같은 Coreopsis 속에서는 플라보노이드, 페닐프로파노이드 등의 페놀계 성분이 존재한다고 알려져 있다(Reichling et al., 1994). CLA에 존재하는 페놀성분의 정성 및 정량 분석을 위해 HPLC로 분석한 결과, (+)-catechin hydrate의 함량이 5.0 ± 0.0 mg·g-1으로 가장 높았고 ferulic acid (1.6 ± 0.0 mg·g-1), chlorogenic acid (1.5 ± 0.0 mg·g-1), caffeic acid (1.2 ± 0.0 mg·g-1), naringin (0.9 ± 0.0 mg·g-1) 및 p-coumaric acid (0.5 ± 0.0 mg·g-1) 순으로 검출되었다(Fig. 1; Table 2). 가장 많이 함유되어 있는 (+)-catechin은 신경보호, 항비만 등 다양한 효과가 있다고 보고되어져 있을 뿐만 아니라 항산화 활성이 뛰어나다고 알려져 있다(Rice-Evans and Miller, 1996; Mandel and Youdim, 2004; Rains et al., 2011). 따라서, CLA의 높은 항산화 활성은 검출된 페놀성분들에 의해 나타난 것으로 보인다.
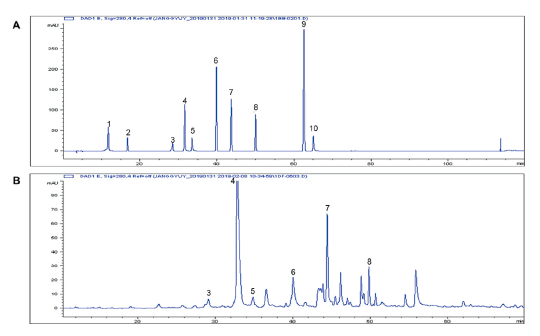
Fig. 1. The chromatographys of phenolics (100 μg·mL-1; A) and CLA (10 mg·mL-1; B) using by highperformance liquid chromatography (HPLC). Peak identification: 1, gallic acid; 2, homogentisic acid; 3, chlorogenic acid; 4, (+) -catechin hydrate; 5, caffeic acid; 6, p- coumaric acid; 7, ferulic acid; 8, naringin; 9, quercetin hydrate; 10, cinnamic acid. CLA, aerial parts of Coreopsis lanceolate.
Table 2. Phenolics contents of CLA analyzed by high-performance liquid chromatography (HPLC) (n = 3).
|
|
CLA, aerial parts of Coreopsis lanceolate ; N.D., not detected. All values are means ± SD. |
H2O2로 유도된 PC12 세포에서 CLA의 세포 내 ROS 감소
일중항 산소(1O2), 과산화물 라디칼(O-2) 및 하이드록실 라디칼(HO·)을 뜻하는 ROS는 세포에 산화스트레스를 유발하여 DNA와 단백질을 파괴함으로써 세포사멸을 초래한다고 알려져 있다(Simon et al., 2000). PC12세포에 H2O2로 산화스트레스를 유도시켜 CLA를 처리했을 때 세포 내 ROS 수치에 미치는 영향을 확인하였다. H2O2만 처리한 세포가 처리하지 않은 세포에 비해 ROS가 유의적으로 약 155% 증가하였으나, CLA 추출물을 처리한 세포 내 ROS는 약 53%에서 106%까지 감소하는 것을 확인하였다(Fig. 2). 또한, CLA는 200 µg·mL-1의 농도에서도 독성이 없는 것을 확인하였다(Fig. 3) 페놀성분과 같은 항산화 활성을 가지고 있는 성분은 ROS를 직접적으로 제거하여 산화 스트레스를 줄이고 세포를 보호하는 효과가 있다고 알려져 있다(Masella et al., 2005). 따라서, CLA의 페놀성분으로 인한 항산화 효과가 세포 내 ROS가 감소에도 영향이 있는 것으로 보인다.
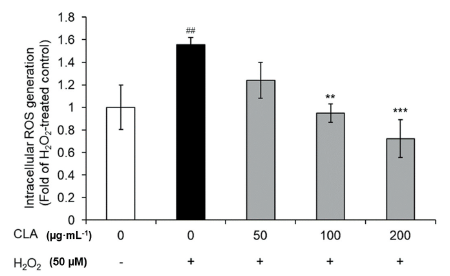
Fig. 2. Protect effect of intracellular reactive oxygen species (ROS) generation of CLA on H2O2-induced PC12cells. The data indicated that CLA against oxidative stress induced PC12 cells in a dose-dependent manner. All values are means ± SD, n = 3. ##p < 0.01 comparing H2O2non-treated control and H2O2 treated control column; **p < 0.01 and ***p < 0.001, comparing H2O2 treated control and each column. CLA, aerial parts of Coreopsis lanceolate.

Fig. 3. Cell viability of CLA extracts (50, 100, 200 μg·mL-1) on H2O2-induced PC12cells by MTS assay. All values are means ± SD (n = 3). Values with different superscript letters indicate a statistically significant difference determined by Duncan’s test (p <0.05). CLA, aerial parts of Coreopsis lanceolate; MTS, [3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium].
H2O2로 유도된 PC12 세포에서 CLA의 세포 사멸 보호
H2O2에 의해 사멸이 유발된 PC12 세포에서 CLA가 미치는 영향을 확인하기 위해 내인성(pro-apoptotic) 및 외인성(pre-apoptotic) 경로의 단백질 발현을 확인하였다(Fig. 4). CLA (200 μg·mL-1)에서 pro-apoptotic Bax의 발현이 감소한 반면 anti-apoptotic Bcl-2 유전자의 발현은 상대적으로 증가하였음을 알 수 있었다. CLA는 내인성 경로로 세포사멸을 일으키는 단백질인 Bax/Bcl-2의 발현을 억제하여 cytochrome c의 발현을 농도 의존적으로 억제하였다. Bcl-2는 Bad 단백질과 이량체를 이루고 있는데, Bad 단백질이 Bax로 대체되어 Bax와 Bcl-2의 이량체가 증가하게 되면 세포가 사멸된다(Yang et al., 1995). CLA추출물은 PC12 세포에서 Bax와 Bcl-2는 발현의 차이로 세포 사멸을 조절하였다. 또한, 외인성 경로로 세포사멸을 일으키는 단백질인 caspase-3 및 caspase-9도 CLA에 의해 농도 의존적으로 활성이 감소하였다. 따라서, CLA는 H2O2를 처리한 신경세포에서 세포 사멸을 일으키는 단백질인 Bax/Bcl-2, cytochrome c 및 caspase 단백질 발현 또한 억제함으로써 신경세포를 산화스트레스로부터 보호하는 것으로 보인다.
Conclusion
본 연구에서 CLA 추출물은 H2O2로 유도된 PC12 세포에서 ROS의 활성을 농도 의존적으로 저해하였으며 Bax과 Bcl-2 발현의 조절을 통해 cytochrome c를 억제하였다. 또한, 세포사멸의 최종 단계에서 중요한 역할을 하는 caspase 단백질의 발현을 억제하는 것을 확인하였다. 결과적으로, CLA 추출물이 항산화 방어 체계를 조절을 통하여 세포 사멸을 저해하여 산화스트레스로부터 신경세포를 보호하였다. 이는 CLA가 알츠하이머나 파킨슨 같은 신경변성질환 관련 예방 소재로서 가능성이 있음을 제시할 수 있다.
Authors Information
Kyung Hye Seo, National Institute of Horticultural & Herbal Science, Researcher
Hyung Don Kim, National Institute of Horticultural & Herbal Science, Researcher
Jeong-Yong Park, National Institute of Horticultural & Herbal Science, Master
Dong Hwi Kim, National Institute of Horticultural & Herbal Science, Header
Seung-Eun Lee, National Institute of Horticultural & Herbal Science, Researcher
Gwi Young Jang, National Institute of Horticultural & Herbal Science, Researcher
Yun-Jeong Ji, National Institute of Horticultural & Herbal Science, Doctor of Philosophy
Ji Yeon Lee, National Institute of Horticultural & Herbal Science, Doctor of Philosophy





