Introduction
식물성스테롤(phytosterols)은 콜레스테롤과 유사한 구조인 네 개의 고리를 가진 steroid 핵으로 구성되어 있다(Fernandes and Cabral, 2007). 또한, 5, 6번 탄소에 이중결합을 가지고 있으며 3번 탄소에 hydroxy group (-OH)를 갖고 있는 triterpene의 기본구조를 이루고 있다(Fernandes and Cabral, 2007). 콜레스테롤은 8개의 탄소로 이루어진 side chain을 가지고 있으며, 식물성스테롤은 대체로 9-10개의 탄소로 이루어진 side chain구조를 나타낸다.
식물성스테롤은 콜레스테롤과 유사한 화학구조를 가지고 있지만 영양학적인 면에서는 다른 성질을 나타낸다. 식물성스테롤은 대표적으로 β-sitosterol, campesterol, stigmasterol이 주를 이루며 나머지는 소량의 isomer (sitostanol, campestanol 등)들로 구성되어있다. 가장 대표적인 식물성스테롤은 β-sitosterol로서 식물성스테롤류 중에서 약 65%로 높은 비율을 차지하고 있다(Patel and Thompson, 2006). 식품에서 유리형(free sterol)과 에스테르형(steryl ester)으로 주로 존재하고 있는 식물성스테롤은 대체로 자연식품에는 1%내외로 함유하고 있으며 식물성스테롤을 강화한 가공식품에는 최대 8%까지 함유하고 있다(Laakso, 2005). 사람 몸의 콜레스테롤은 인체 내에서 합성되거나 육류 등의 동물성 식품을 섭취함으로써 함유하게 된다. 콜레스테롤의 과잉 섭취는 심혈관질환의 발병률을 높이는 반면에 식물성스테롤은 소장에서 흡수되는 콜레스테롤의 함량을 줄여주는 역할을 하게 되어 건강기능식품 품목으로 지정되어 있다(Richard and Ostlund, 2007; MFDA, 2015a).
식물성스테롤은 지용성 물질로 주로 채소류, 종자 및 식물유 등의 식물성식품에 존재한다. 중국에서 소비되고 있는 식품 중 식물성스테롤의 함량은 채소류(pea, cauliflower, broccoli 등)에서 1.1-53.7 mg/100 g (0.011-0.537%), 과일류(orange, tangerine, mange 등)에는 1.6-32.6 mg/100 g (0.016-0.326%) 범위이다(Han et al., 2008). 종자 및 두류(아마씨유, 참깨, 메조, 강낭콩, 렌틸, 완두콩)의 식물성스테롤의 함량은 57.8-242.4 mg/100 g (0.578-2.424%)으로 채소류나 과일에 비하여 매우 높은 함량을 보이고 있다(Ryan et al., 2007). 식물유에는 99.12-207.17 mg/100 g (0.991-2.072%)의 식물성스테롤을 함유하고 있다고 보고하였다(Lagarda et al., 2006). 따라서 종자 혹은 식물유들이 식물성스테롤의 주된 공급원이 되기 때문에 이들 함량연구들이 주로 이루어지고 있다.
식물성스테롤은 혈중 LDL-콜레스테롤 수치를 낮춤으로서 심혈관질환에 중요한 생리활성을 나타내는 물질로 알려져 있다(Richard and Ostlund, 2007). 식물성스테롤을 섭취할 때는 단일물질(sitostanol 등)로 섭취하는 것보다 유화제와 함께 food formulation으로 섭취했을 때 콜레스테롤 흡수를 37%까지 감소할 수 있다고 하였으며, sitostanol/lecithin 복합체로 섭취할 때는 혈중 LDL-콜레스테롤 수치를 14.3% 감소시킬 수 있다고 하였다(Richard and Ostlund, 2007). The United States National Cholesterol Education program은 하루에 2 g 정도의 식물성 스테롤을 food formulation으로 섭취했을 때 LDL-콜레스테롤 수치를 효과적으로 감소시킬 수 있음을 제시하였다(Richard and Ostlund, 2007).
식품에서 식물성스테롤의 함량은 gas chromatography (GC) 혹은 high performance liquid chromatography (HPLC) 분석을 통하여 이루어지고 있다(Lagarda et al., 2006; Warner and Mounts, 1990; Slavin and Yu, 2012). 이중에서 가장 보편적으로 이용하는 분석법은 flame ionization detector (FID)를 이용한 GC이다. 식품에 존재하는 식물성스테롤은 지용성 성분으로서 1% 미만함유하고 있는 미량성분이기 때문에 추출물을 그대로 기기분석을 수행할 경우 정밀한 정량한계 및 높은 분리도(resolution)를 얻기 어렵다(Shin et al., 2013). 따라서 식품을 직접 검화(direct saponification)하여 지용성 성분들 중 가장 많은 부분을 차지하는 유지(triacylglycerol)들을 제거하고 미량성분들인 식물성스테롤과 같은 비검화물들을 용매추출하여 적절한 농도로 제조한 후 바로 기기분석하거나 유도체화하여 GC분석함으로써 스테롤류를 정량하고 있다(Shin et al., 2013; MFDA, 2015b; Clement et al., 2010). 검화를 하게 되면 식품 중 함유되어 있는 에스테르형을 유리형 식물성스테롤로 전환하여 총 함량을 구할 수 있게 된다(Volin, 2001).
식물성스테롤은 대체로 유지 혹은 종자들에서 비교적 높은 함량이 검출되고 있고, 이에 대한 연구 또한 많이 이루어지고 있다(Maguirea et al., 2004; Vlahakis and Hazebroek, 2000). 반면에 채소류에 함유된 식물성스테롤 함량 연구는 미진한 실정이다. 따라서 본 연구에서는 채소류 9종(파프리카 3종, 콜라비, 죽순, 방울토마토, 백다다기오이, 영양부추, 옥수수)에 함유되어 있는 식물성스테롤 함량을 조사하고 이들을 조리(원재료, 삶기, 굽기, 볶기, 튀기기, 찌기, 로스팅, microwave)하였을 때 각 식물성스테롤의 함량변화를 조사하였다.
Materials and Methods
실험재료
조리법(원재료, 삶기, 굽기, 볶기, 튀기기, 찌기, 로스팅, microwave)에 따른 식물성스테롤의 함량변화를 조사하기 위하여 9종의 채소류를 선정하였다. 스테롤 표준품 5α-cholestane (internal standard, assay ≥97%, C8003)는 Sigma-Aldrich (St. Louis, MO, USA)에서, β-sitosterol, campesterol, stigmasterol의 혼합물은 Fluka/Aldrich (Buchs, Switzland)에서 구입하였다. 식물성스테롤 유도체화에 필요한 시약인 dimethyl formamide는 Tokyo Chemical Industry Co., Ltd. (Tokyo, Japan)에서 구입하였으며, hexamethyldisilane (52617, Fluka)와 chlorotrimethylsilane (92360, Fluka)는 GC분석용을 구입하여 사용하였다. 이외에 기기분석에 사용된 유기용매는 특급시약(high purity grade)이었다.
시료 전처리
조리법에 따른 9 종류의 채소류에 함유된 식물성스테롤 함량을 조사하였다. 채소류로서 잎채소(콜라비), 줄기채소(죽순), 과채소(방울토마토)류와 보편적으로 소비되고 있는 다음의 9종을 선정하였다. 파프리카(red, yellow, orange) 3종, 콜라비(Kohlrabi), 죽순(Bamboo shoot), 방울토마토(Cherry tomato), 백다다기오이(Cucumber), 영양부추(Chinese chive), 옥수수(Corn)를 구입하여 7가지 조리한 후 식물성스테롤의 함량(생물 중, edible fresh weight)을 분석하였다. 시료의 조리는 국제한식조리학교(Jeonju, Korea)에서 수행하였으며 방법은 다음과 같았다.
삶기(boiling): 원재료 상태에서 전기레인지(㈜대륭)로 끓는 증류수 3 L에서 1.5-4분 동안 시료에 맞춰 삶은 후 물기를 체에서 2분 동안 방치하여 제거하였다.
굽기(grilling): 원재료 상태에서 팬에 기름을 두르지 않고 전기레인지(㈜대륭)로 열을 가해서 건조된 팬에 구워서 1.5-9분 조리하였다. 시료에서 기름이 용출되면 체에 2분 동안 방치하여 기름을 제거하였다.
볶기(stir-frying): 원재료 상태에서 팬에 15 mL의 기름을 두르고 전기레인지(㈜대륭)로 열을 가하여 연도가 높아질 때까지 볶아서 1-5분 조리하였다. 시료에서 기름이 용출되면 체에 2분 동안 방치하여 기름을 제거하였다.
튀기기(deep-frying): 원재료 상태에서 델키 업소용 전기튀김기(DK-201)을 이용하여 170℃로 예열 후 170℃에서 1-2분 동안 조리 후, 시료의 기름은 체에 2분 동안 방치하였다. 다음 키친타올 3겹으로 3회 문질러 기름기를 제거하였다.
찌기(steaming): 찜기에 일정량(3 L)의 증류수를 넣고 전기레인지(㈜대륭)로 끓여 김이 나면 시료를 넣어 온도를 나춰서 1분 동안 찐 후 뒤집어서 1분 동안 다시 조리하였다.
Roasting: Fujimak 컨벡션 오븐을 이용하여 160℃에서 예열한 후 시료를 담아서 5-6분 동안 조리후 뒤섞어 준 후, 다시 5-6분 동안 조리하였다.
전자레인지(Microwave): 접시에 평평하게 시료를 깔아서 microwave (삼성 RW-C23RWS, 전자레인지)를 5-8분동안 가동한 후 뒤섞어 주었다. 다음 다시 3-5분 동안 조리하였다.
이들 조리한 시료들은 각각 균질기(Robot Coupe R301 Ultra, Robot Coupe, London, UK)로 균질화 한 후 분석 전까지 -20℃의 냉동고에서 보관하였다가 분석에 사용하였다.
시료의 검화(saponification) 및 용매추출
각 균질화 된 시료에서 식물성스테롤의 함량 분석을 위하여 알칼리 검화를 수행한 후 용매 추출하였다(Shin et al., 2013, MFDA, 2015b). 지용성성분의 검화법은 전의 보고한 내용과 동일하였다(Shin et al., 2013). 100 mL 용량의 추출관에 균질화된 시료 5 g과 항산화제인 6% pyrogallol ethanol 용액 10 mL을 첨가한 후 1분동안 vortex mixer로 균질화한 후 충분히 추출되도록 10분 동안 sonication을 하였다. 추출관에 60% KOH용액 8 mL을 첨가하여 질소 충진한 후 shaking water bath (BS-21, Lab companion, Ramsey, Minnesota, USA)에서 75℃, 100 rpm으로 1시간동한 검화하였다. 다음 찬물에서 냉각한 추출관에 2% NaCl 용액 20 mL와 추출용매인 n-hexane와 ethyl acetate의 혼합액(85:15, v/v, 0.01% BHT) 15 mL을 첨가하여 1분동안 vortex mixer로 혼합하였다. 방치 후 얻어진 상등액을 분리하여 무수황산나트륨으로 잔여의 수분을 제거한 후 50 mL의 정용병에 정용하였다. 추출과정은 총 세 번 반복하여 식물성스테롤 성분을 추출하였다. 정용한 추출액에서 12.5 mL을 25 mL의 vial에 취하여 질소로 용매를 완전히 제거한 후 acetone 3 mL을 첨가하여 진탕 후 다시 질소로 용매를 완전히 제거함으로써 잔존할 수 있는 수분을 완전히 제거하였다. 완전히 건조된 시험관에 dimethyl formamide 3 mL을 첨가하여 vortex mixer로 충분히 혼합하였다. 이를 식물성스테롤 분석하는데 필요한 유도체화 반응을 위한 시험용액으로 사용하였다.
유도체화 반응(trimethylsilylation)
검화반응으로 준비된 시험용액 1 mL을 수분이 완전히 제거된 시험관에 취하여 hexamethyldisilane 0.2 mL과 chlorotrimethylsilane 0.1 mL을 첨가한 후 마개를 닫고 강렬하게 30초간 vortex mixer로 혼합하였다(MFDA, 2015b). 다음 상온에서 15분 동안 방치하여 반응한 후 시험관에 내부표준물질(internal standard, IS)인 5α-choestane 용액(0.1 mg/mL in heptane) 1 mL과 반응 종료를 위한 증류수 10 mL을 넣은 후 마개를 닫고 30초 동안 강렬하게 vortex mixer로 혼합하였다. 유도체화 반응을 위한 모든 과정은 후드에서 수행하였다. 층분리를 위하여 원심분리(HA-1000-3, Hanil Science Industrial Co., Ltd., Korea)를 3000 rpm에서 2분 동안 수행하였다. 상등액(haptane 층)을 취하여 무수황산나트륨을 통과하여 탈수한 여액(heptane 층)을 GC vial에 옮겨 GC분석하였다.
Phytosterol 함량 분석 및 정량
식물성스테롤 함량을 정량하기 위한 GC분석조건은 다음과 같았다(MFDA, 2015b). GC (YL6100, Younglin, Anyang, Korea)는 HP ultra-2 컬럼(Agilent J&W Scientific, Folsom, CA, USA, crosslinked 5% PH ME siloxane, 25 m × 0.2 mm × 0.33 ㎛)과 FID (Younglin 6100, Anyang, Korea)가 장착되어 있었다. 이송기체는 질소 이었으며, 주입구와 검출기의 온도는 각각 280℃와 300℃로 설정하였다. 식물성스테롤 분리를 위한 오븐의 온도는 초기 260℃에서 2분 동안 유지하다가 285℃까지 10℃/min으로 승온하였다. 다음 285℃에서 10분 동안 유지하여 총 분석시간은 30분이었다. 식물성스테롤 정량을 위한 유도체화 시료 주입량은 2 ㎕로 하였다.
각각의 식물성스테롤은 내부표준물질을 이용하여 β-sitosterol의 response factor (RF)로 정량하였다.
Response factor = [AP/AIS]/[CP/CIS]
이때 AP는 phytosterol peak의 area이며, AIS는 5α-cholestane peak의 area, CP는 phytosterol의 농도(amount 혹은 concentration), CIS는 5α-cholestane의 농도(amount 혹은 concentration)이다(Phillips et al., 1999). 조리 후 식품에 존재하는 식물성스테롤 함량의 변화율은 다음과 같다.
Total phytosterol content variation (%)
= (the content of phytosterol after cooking –the content of phytosterol before cooking)/(the content of phytosterol before cooking) × 100
각 β-sitosterol과 campesterol, stigmasterol의 동정은 5α-cholestane (internal standard, IS)의 retention time (RT)에 대한 각 식물성스테롤의 retention time의 relative retention time(RRT)을 구하여 비교함으로써 이루어졌다.
Relative retention time (RRT) = RT of each phytosterol / RT of 5α-cholestane (IS)
각 식물성스테롤 함량은 mg/kg으로 나타내었다. 분석의 quality control (QC) 시료로서 시중에서 판매되는 조제분유를 구입하여 이를 매회 분석함으로써 분석품질을 점검하였다.
Results and Discussion
조제분유의 식물성스테롤 동정 및 분석
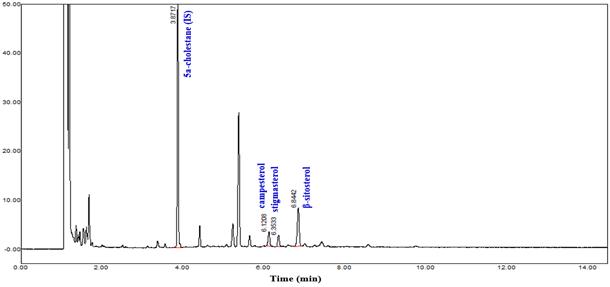
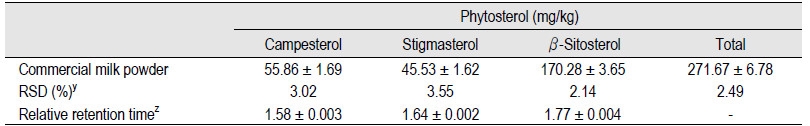
조제분유에는 우유에서 유래되는 콜레스테롤뿐만 아니라 식물성유지에서 유래되는 식물성스테롤 또한 존재하고 있다(Claumarchirant et al., 2015; Maduko and Park, 2007). 따라서 시중에서 균일하게 제조된 조제분유의 식물성스테롤 함량을 측정함으로서 분석품질을 확인하였다. 조제분유를 분석한 결과, 식물성스테롤류의 함량과 각 스테롤류의 relative retention time을 구하여 Table 1에 나타내었다. QC로 사용한 조제분유에는 식물성스테롤 중에서 β-sitosterol이 170.28 mg/kg으로 가장 높았고, campesterol과 stigmasterol이 각각 55.86 mg/kg과 45.53 mg/kg으로 함유되어 총 식물성스테롤 함량은 271.67 mg/kg 이었다. Maduko와 Park (2007)의 연구에 의하면, 식물유와 혼합하여 조제한 drink milk blend의 총 식물성스테롤 함량(β-sitosterol, campesterol, stigmasterol)은 72-135 mg/kg으로 존재한다고 하였다. 특히 bovine infant formula의 경우, 260 mg/kg으로 존재한다고 보고하였다. 이는 이번 결과와 유사하였다. 조제분유에서 식물성스테롤의 함량은 분유 제조 시 함유되는 식물유의 함량에 따라 다르게 검출될 수 있다. Fig. 1에서는 조제분유의 크로마토그램을 나타내었다. 본 GC 분석조건에서 β-sitosterol와 campesterol, stigmasterol의 RT는 각각 6.84분, 6.12분, 6.35분로 각각의 IS 대비 평균 RRT는 1.77, 1.58, 1.64 이었다(Table 1).
조리법에 따른 파프리카류에 함유된 식물성스테롤 함량변화
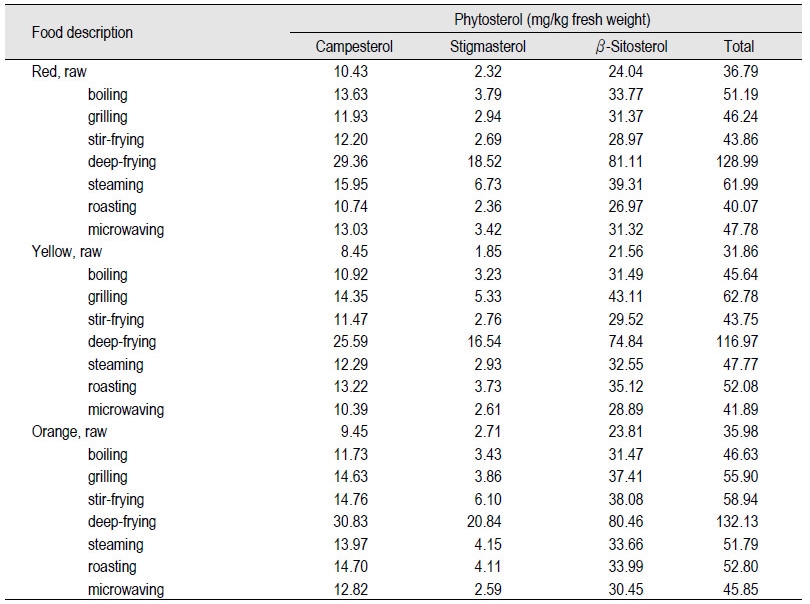
파프리카는 가지과(Solanaceae)이며 고추속(Capsicum), 고추종(Annuum)에 속하는 식물로서 매운맛이 없고 단고추로 알려져 있다(Jeong et al., 2006). Table 2에서는 파프리카(red, yellow, orange) 3종의 원재료에서의 식물성스테롤 함량과 조리(삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지)에 따른 식물성스테롤 함량변화를 비교하였다. 3종의 파프리카(red, yellow, orange) 원재료에는 총 식물성스테롤 함량이 31.86-36.79 mg/kg fw함유하고 있었다. 그 중에서도 β-sitosterol 함량(21.56-24.04 mg/kg fw)이 가장 높았으며, campesterol, stigmasterol 순으로 검출되었다. 조리 후 파프리카에서 검출된 식물성스테롤은 점차로 증가하였다. 특히 식용유지로 튀긴 시료들에서 116.97-132.13 mg/kg fw으로 가장 높은 함량이 검출되었다. 특히 튀긴 주황파프리카에서 가장 높았으며 식물성스테롤을 분석한 크로마토그램을 Fig. 2에 나타내었다. 크로마토그램에서 보는 바와 같이 검출된 주된 식물성스테롤은 β-sitosterol와 campesterol, stigmasterol이었으며 β-sitosterol 함량(2,132.13 mg/kg fw)이 가장 높았다. 이는 높은 식물성스테롤을 함유하고 있는 식용유지를 이용하여 조리하였기 때문인 것으로 사료된다. 혈중 콜레스테롤 함량을 낮추기 위해서는 식물스테롤 1.5-3.0 g을 매일 섭취해야 한다고 보고되고 있는데, 이는 210 mg/100g에 해당되는 수치이다(Jong et al., 2004).
Fig. 3에서는 파프리카(red, yellow, orange) 3종에서 원재료의 식물성스테롤 함량에 대한 조리(삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지)후 식물성스테롤 함량변화를 나타내었다. 튀기기 조리한 파프리카(red, yellow, orange)의 총 식물성스테롤 함량은 원재료 대비 250.6-267.3% 내외의 증가율을 나타내며 가장 높았다. 이는 원재료 대비 대략 2.5-2.7배 증가한 수치이며, 튀길 때 이용한 식용유지에서 기인한 것으로 사료된다. 이외에 조리법에서는 총 식물성 스테롤이 원재료 대비 8.9-97.1%의 증가율을 보이며, 조리 후 전반적으로 식물성스테롤 함량이 증가하는 경향을 나타내었다.
조리법에 따른 콜라비, 죽순, 방울토마토에 함유된 식물성스테롤 함량변화
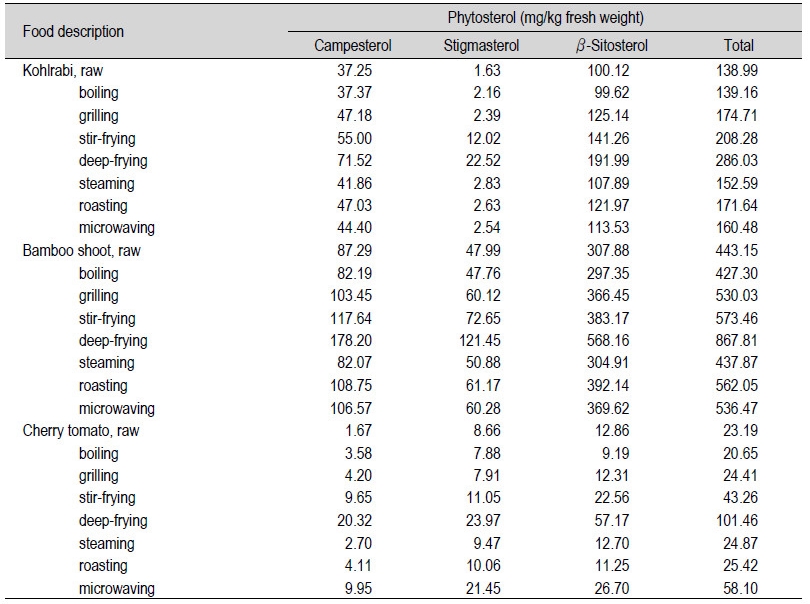
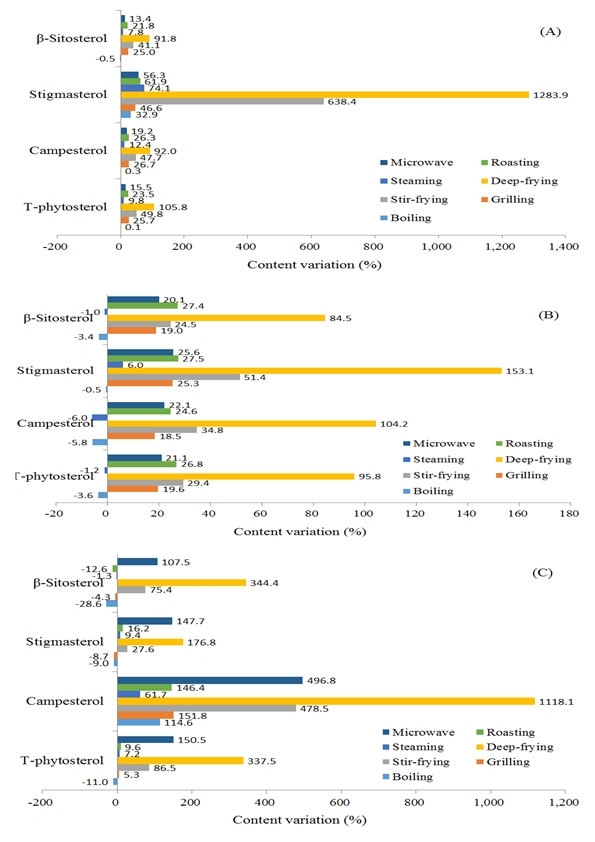
콜라비(Kohlrabi)는 배추과(Brassica oleracea L. gongulodes group)에 속하는 작물로 주로 샐러드용으로 이용되고 있다(Park et al., 2014). 벼과의 대나무족(bambuseae)에 속하는 식물인 죽순(Bamboo shoot, Phyllostachys spp.)은 대나무의 어린싹으로 식품에 다양하게 이용되고 있다(Jang et al., 2013). Table 3에서는 콜라비와 죽순, 방울토마토(Cherry tomato)의 원재료에서 식물성스테롤 함량과 조리(삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지)에 따른 식물성스테롤 함량을 나타내었고, Fig. 4에서는 시료들의 원재료 대비 식물성스테롤의 함량변화율을 나타내었다. 잎채소(leafy vegetable)인 콜라비 원재료에는 β-sitosterol 100.12와 campesterol 37.25, stigmasterol 1.63 mg/kg fw으로 총 식물성스테롤의 함량이 138.99 mg/kg fw (0.014%) 이었다. 조리 후 총 식물성스테롤 함량은 각각 삶기 139.16 mg/kg fw, 굽기 174.71 mg/kg fw, 볶기 208.28 mg/kg fw, 튀기기 286.03 mg/kg fw, 찌기 152.59 mg/kg fw, roasting 171.64 mg/kg fw, 전자레인지 160.48 mg/kg fw으로 검출되며 점차로 증가하는 경향을 보였다. 삶기와 찌기, 전자레인지로 조리된 콜라비의 총 식물성스테롤의 함량변화율은 원재료 대비 각각 0.1%와 9.8%, 15.5%로 낮은 폭으로 증가하였으며, 기름으로 조리한 볶기와 튀기기에서는 원재료 대비 49.9%와 105.8%로 큰 폭으로 증가하였다(Fig. 4). 굽기와 roasting한 콜라비의 총 식물성스테롤의 함량변화율은 원재료 대비 각각 25.7%와 23.5%로 증가하였다.
|
Table 3. Phytosterol contents of kohlrabi, bamboo shoot, and cherry tomato treated by different cooking methods.
|
|
줄기채소(stem vegetable)인 죽순 원재료에는 총 식물성스테롤의 함량이 443.15 mg/kg fw (β-sitosterol 307.88, campesterol 87.29, stigmasterol 47.99 mg/kg fw)으로 함유하여 즉 0.04%를 나타내며 채소류 중에서는 비교적 높은 수치를 보였다(Table 3). Lu 등(2009)에 의하면 죽순에서 식물성스테롤의 함량은 건물 중 0.1-0.3% 함유하고 있다고 보고되고 있다. 특히 겉껍질을 포함하고 있을 때 그 함량이 높다고 하였다. 본 연구에서 총 식물성스테롤 함량은 죽순을 각각 조리하였을 때 삶기 427.30 mg/kg fw, 굽기 174.71 mg/kg fw, 볶기 208.28 mg/kg fw, 튀기기 286.03 mg/kg fw, 찌기 152.59 mg/kg fw, roasting 171.64 mg/kg fw, 전자레인지 160.48 mg/kg fw으로 검출되며 점차로 증가하는 경향을 보였다. 삶기와 찌기한 죽순의 총 식물성스테롤 함량은 원재료 대비 감소하는 경향을 나타내었으며, 튀긴 죽순의 총 식물성스테롤 함량은 원재료 대비 95.83%의 큰 폭으로 증가하였다. 굽기와 볶기, roasting, 전자레인지로 처리한 죽순의 총 식물성스테롤 함량은 원재료 대비 19.6%-29.4%로 증가하였다(Fig. 4).
|
|
|
Fig. 4. Content variation of phytosterols in vegetables treated by different cooking methods. Kohlrabi (A), bamboo shoot (B), and cherry tomato (C). |
과채소(fruit vegetable)인 방울토마토 원재료에는 β-sitosterol 12.86 mg/kg fw과 campesterol 1.67 mg/kg fw, stigmasterol 8.66 mg/kg fw으로 총 식물성스테롤의 함량이 23.19 mg/kg fw (0.002%)으로 비교적 낮은 수치를 나타내었다(Table 3). Piironen 등(2003)에 의하면 토마토(Lycopersicon esculentum Miller)에 총 식물성 스테롤 함량은 생물 중 74 mg/kg이었으며, 건물 중 1167 mg/kg으로 함유하고 있다고 하였다. 조리 후 방울토마토의 총 식물성스테롤 함량은 각각 삶기 20.65 mg/kg fw, 굽기 24.41 mg/kg fw, 볶기 43.26 mg/kg fw, 튀기기 101.46 mg/kg fw, 찌기 24.87 mg/kg fw, roasting 25.42 mg/kg fw, 전자레인지 58.10 mg/kg fw으로 검출되며 삶기를 제외한 조리법에서 점차로 증가하는 경향을 보였다. 굽기와 찌기, roasting한 방울토마토의 총 식물성스테롤 변화율은 원재료 대비 5.3%-9.6%로 증가하였으며, 볶기와 튀기기, 전자레인지 처리한 시료의 경우 원재료 대비 각각 86.5%와 337.5%, 150.5%의 변화율을 타내었다(Fig. 4). 방울토마토의 경우, 콜라비나 죽순과는 다르게 전자레인지로 조리하였을 때 비교적 높은 총 식물성스테롤을 나타내었다.
조리법에 따른 백다다기오이, 영양부추, 옥수수에 함유된 식물성스테롤 함량변화
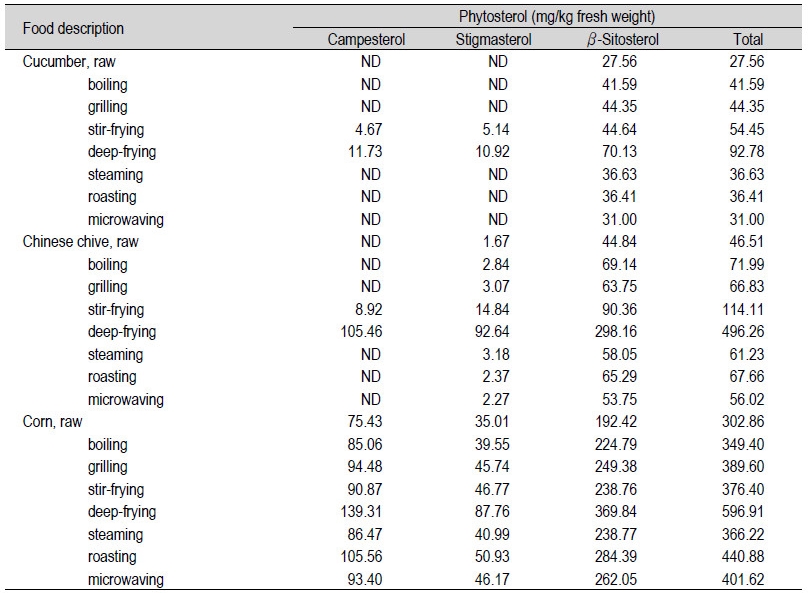
백다다기오이와 영양부추, 옥수수의 원재료에 함유된 식물성스테롤의 함량 및 조리 후(삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지) 식물성스테롤 함량을 Table 4에 나타내었다. Fig. 5에서는 백다다기오이와 영양부추, 옥수수의 원재료 대비 조리 후 식물성스테롤에 대한 함량 변화율을 나타내었다. 백다다기오이 원재료에는 식물성스테롤류 중에서 β-sitosterol (27.56 mg/kg fw, 0.003%)로 아주 적은 양을 함유하고 있었다(Table 4). 조리 후 β-sitosterol 함량은 각각 삶기 41.59 mg/kg fw, 굽기 44.35 mg/kg fw, 볶기 44.64 mg/kg fw, 튀기기 70.13 mg/kg fw, 찌기 36.63 mg/kg fw, roasting 36.41 mg/kg fw, 전자레인지 31.00 mg/kg fw으로 검출되며 소폭 증가하였다. 굽기와 튀기기의 경우, 소량의 campesterol과 stigmasterol이 검출되었는데 이는 조리에 사용한 식용유지로부터 유래된 것으로 사료된다. 삶기와 굽기, 볶기, 찌기, roasting된 백다다기오이의 총 식물성스테롤 함량은 원재료 대비 32.1%-97.5%의 비율로 증가하였다(Fig. 5). 튀기기의 경우, 원재료 대비 236.6% 큰 폭으로 증가하였으며 전자레인지 처리한 시료의 경우 원재료 대비 12.5% 소폭 증가하였다.
영양부추 원재료에는 β-sitosterol 44.84 mg/kg fw과 stigmasterol 1.67 mg/kg fw으로 총 식물성스테롤의 함량이 46.51 mg/kg fw (0.005%) 이었다(Table 4). 조리 후 총 식물성스테롤 함량은 각각 삶기 71.99 mg/kg fw, 굽기 66.83 mg/kg fw, 볶기 114.11 mg/kg fw, 튀기기 496.26 mg/kg fw, 찌기 61.23 mg/kg fw, roasting 67.66 mg/kg fw, 전자레인지 56.02 mg/kg fw으로 검출되었다. Piironen 등(2003)에 의하면 부추(Leek, Allium porrum L)에 총 식물성 스테롤 함량은 생물 중 194 mg/kg이었으며, 스테롤 중에서 가장 높은 함량은 β-sitosterol (166 mg/kg)으로 보고하였다. 또한, 건물 중 총 식물성 스테롤은 865 mg/kg으로 함유하고 있다고 하였다(Piironen et al., 2003). 삶기와 굽기, 찌기, 로스팅, microwave한 영양부추의 총 식물성스테롤 함량은 원재료 대비 20.4%-54.8%의 비율로 증가하였다(Fig. 5). 기름으로 조리한 볶기와 튀기기에서는 원재료 대비 각각 145.3%와 967.0%로 큰 폭으로 증가하였다.
옥수수는 원재료에는 총 식물성스테롤 함량이 302.86 mg/kg fw (β-sitosterol 192.42, campesterol 75.43, stigmasterol 35.01 mg/kg fw)으로 0.03%를 나타내며 식물체 중에서는 비교적 높은 식물성스테롤을 함유하고 있었다(Table 4). Piironen 등(2003)에 의하면 옥수수(sweet corn, frozen)의 총 식물성스테롤 함량은 생물 중 285 mg/kg, 건물 중 1,033 mg/kg으로 보고하였다. 생물 중 검출된 주된 식물성스테롤은 β-sitosterol 152 mg/kg으로 보고하였다(Piironen et al., 2003). 생물 중 검출된 함량은 이번 결과와 유사한 수치이었다. 튀기기를 제외한 조리 후 총 식물성스테롤 함량은 원재료 대비 15.4%-45.6%의 증가율을 나타내었으며, 튀기기 조리 후 97.1%의 증가율을 보였다(Fig. 5).
본 연구에서 분석된 조리법에 따른 9종 채소류 내 식물성스테롤 함량 변화에서는 대체로 조리(삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지)한 채소류의 경우, 식물성스테롤 함량이 증가하는 경향을 나타내었으며, 그 증가 폭은 식물체내 스테롤류의 함량 및 채소류의 특성에 기인하는 것으로 사료되었다. 따라서 본 연구에서 분석된 채소류 9종의 식물성스테롤을 분석한 결과, 조리된 채소류에서 더 높은 식물성스테롤 함량을 나타내었다. 채소류의 조리법에 따른 식물성스테롤 함량 변화는 다양한 조리법 연구에 응용될 수 있을 것으로 사료된다.
Conclusion
본 연구에서는 채소류 9종(파프리카 3종, 콜라비, 죽순, 방울토마토, 백다다기오이, 영양부추, 옥수수)에 함유되어 있는 식물성스테롤 함량을 조사하였다. 또한, 이들을 조리(원재료, 삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지)하였을 때 각 식물성스테롤의 함량변화를 살펴보았다. 연구결과 식물성스테롤은 파프리카, 백다다기오이, 영양부추, 방울토마토에서 생물 중 0.002%-0.005% 함유하고 있었으며, 옥수수에는 0.03%, 콜라비와 죽순에는 0.01%-0.04% 함유하고 있었다. 이들 시료를 조리(삶기, 굽기, 볶기, 튀기기, 찌기, roasting, 전자레인지)할 경우, 식물성스테롤 함량이 대체로 증가하는 경향을 보였다. 그 증가폭(혹은 감소폭)은 채소류의 특성에 기인하는 것으로 사료되었다. 특히 식용유지를 이용하여 볶기와 튀기기한 시료는 대체로 큰 폭으로 증가하는 경향을 나타내었다.