Introduction
야생형 녹색형광 단백질(wtGFP)의 아미노산을 점 돌연변이 시켜 만들어진 EGFP (enhanced green fluorescent protein) 단백질은 야생형에 비해 높은 강도를 나타내는 녹색형광 단백질로(Cinelli et al., 2000), 세포 및 분자생물학 분야에서 녹색형광 발현 형질전환체를 제작하거나 형
질전환체 선별을 위한 선발마커 등에 흔히 이용되고 있으며(Arun et al., 2005, Joo and Wang, 2008), 우리나라에서도 GFP 발현 쥐와 닭 모델이 개발 되어 있다(Sim et al., 2009, Kwon et al., 2004). 이러한 유전자변형생물체를 상업화하기 위해서는 잠재적인 위해요소가 있는지의 안전성 검정이 필요하며 우리나라의 경우 LMO법에 의거하여 환경 및 인체에 대한 위해성평가가 수행되어 진다. 현재 GFP발현 형질전환체 중 위해성 심사까지 고려중인 것으로는 누에가 대표적이다. 누에는 지난 수 천년동안 양잠산업에 이용되어 온 견사곤충으로, 최근에는 인간 삶의 질 향상을 위한 차세대 발현시스템으로서 주목받고 있으며, 이를 이용한 실크의 고부가가치 실현 및 농가의 소득증대 기여를 위한 여러 방안들이 모색되고 있다(Lee and Kim, 2000). 최초의 형질전환누에가 개발된 이래 형질전환누에에서 기능성 단백질을 생산하기 위한 연구가 활발히 진행되고 있으며, 이 중 인공 실크 생산을 위한 곤충으로서의 이용가능성이 대두되고 있다(Imamura et al., 2003, Prudhomme and Couble, 2002, Satoshi et al. 2007, Tamura et al., 2000). 우리나라에서도 현재 피기백(piggyBac) 전이인자를 이용하여 녹색형광실크를 생산하는 누에형질전환체가 성공적으로 제작되어, 새로운 산업소재로서의 녹색형광실크가 개발되었다(Kim et al., 2013a, Kim et al., 2013b, Piao Y et al., 2014). 이렇게 개발된 형광누에 및 녹색형광 실크소재를 의류 및 의료용 신소재 산업에 응용하기 위하여 인체위해성평가 중 OECD 테스트가이드라인(OECD, 2002, No.420)에 기초하여 EGFP 단백질이 독성으로 작용할 가능성을 평가하고자 하였으며, 이를 위해 암·수 ICR 마우스를 이용하여 단회 경구투여 독성평가를 하였다.
Materials and Methods
EGFP 단백질 정제
pET21a-EGFP벡터로 E. coli SGK244 strain을 형질전환(transformation)시킨 후 콜로니를 취하여 200 ml LB broth 배지에서 seed culture 한 후에 5 L 배양기(fermentor)를 이용하여 OD600값이 0.7 이 될 때까지 37℃에서 배양한 후, IPTG 1 mM로 induction하여 단백질을 과발현하였다. EGFP 단백질이 과발현된 세포를 4,000 rpm으로 원심분리하여 모으고 French press로 세포를 파괴하고 15,000 rpm으로 원심분리하여 세포를 pellet과 단백질이 포함된 상등액을 분리하였다. 분리된 상등액을 Fast protein liquid chromatography (FPLC)를 이용하여 Ni-NTA His-tag 친화성 크로마토그래피 방법으로 lysis (50 mM Na-phosphate pH 8.0, 500 mM NaCl, 10 mM 2-Mercaptoethanol), wash (50 mM Na-phosphate pH 8.0, 500 mM NaCl, 5 mM 2-Mercaptoethanol, 20 mM imidazole과 50 mM Na-phosphate pH 8.0, 5 mM 2-Mercaptoethanol, 20 mM imidazole)와 elution (50 mM Na-phosphate pH 8.0, 2 mM 2-Mercaptoethanol, 250 mM imidazole) 버퍼를 이용하여 EGFP 단백질을 분리하였다. 각 분획별로 정제한 단백질을 sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE)를 통하여 확인한 후에 여막분석법(dialysis)을 이용하여 단백질 정제 중에 유입된 버퍼 성분들을 최대한 제거 한 후, 동결건조기로 동결 건조하여 순수한 EGFP 단백질 분말을 획득하였다.
CD 분석
발현된 EGFP 단백질의 이차구조를 CD (Circular dichroism) spectrum을 분석하여 확인하였다. 1 mm 폭을 가진 cuvette을 사용하여 25℃에서 260 nm부터 195 nm의 wavelength range까지 circular dichroism spectrum (Chirascan, Applied photophysics Corp., UK)을 이용하여 분석하였으며 단백질 농도는 0.2 mg/ml를 사용하였다.
시험물질
시험 당일에 EGFP 단백질을 전자저울(CP323S, Sartorius, Germany)로 측량하여 유발에 넣고, 부형제(주사용수, Choongwae Pharma Corp., Republic of Korea)를 일부 넣어 현탁 시켜 조제 병으로 옮긴 후, 부형제를 첨가하여 규정농도 (200 mg/mL)로 조제하였다.
실험동물
의약품 등의 안전성시험에 널리 사용되고 있으며, 비교할 기초자료가 풍부한 ICR 암·수 마우스(CrljOri:CD1(ICR), SPF) 5 주령을 (주)오리엔트바이오(Republic of Korea)부터 수령하여 외관 검사를 육안으로 실시하고, 전자저울(CP323S, Sartorius, Germany)로 체중 측정 후, 3 일간 일반증상을 관찰하고, 동물실로 이동하여 3 일간 순화하였다. 순화기간 중에 매일 1 회 일반증상을 관찰하였으며 군 분리는 순화종료일(군 분리일)에 실시하였고, 군 분리일의 평균체중에 가까운 개체 암·수 각 10 마리를 선발하였다. 잔여동물은 군 분리 종료 후 시험계로부터 제외시켰다. 실험은 실험동물윤리위원회의 승인을 거쳐 이루어졌으며, 실험기간 동안 사육환경은 스테인레스 철망사육장(100 W×200 D×130 H)에 수용동물 수는 3 마리(순화기간)/ 1 마리(관찰기간), 온도는 22.2±0.7℃, 상대습도는 52.5±5.4%, 환기횟수는 시간 당 10-15 회, 조명은 12 시간 명암주기(오전 7 시부터 오후 7 시), 조도는 150-300 Lux로 유지하였으며, 사육상자 및 급이기는 2 주당 1 회, 급수병은 주당 1 회 교환하였다. 그리고 실험동물용 고형사료(Harlan Laboratories, Inc., U.S.A.)와 음수는 자유 섭취시켰다.
실험군 구성 및 투여
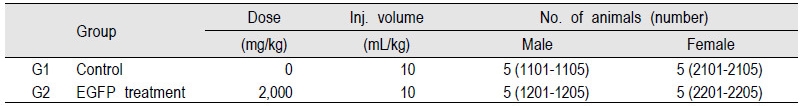
단회 경구투여 독성 평가를 위한 실험군 구성은 EGFP의 독성을 평가하기 위하여 부영제 처리군인 G1 군과 EGFP 처리군으로 나누어 진행 되었다. 또한 G1 군과 G2군은 6 주령(군 분리일)의 암컷 5마리와 수컷 5마리 총 10마리를 각각 사용하여 총 20마리에 대한 독성 평가를 수행하였다. 실험에 사용된 20마리 모두에 고유 식별번호를 부여하였다. 첫 번째 자리는 수컷의 경우 1로 암컷의 경우 2로 표기하였으며 두 번째 자리는 G1군의 경우 1로 G2군의 경우 2로 표기하였다. 나머지 두자리는 각 군의 개체별로 순차적으로 번호를 부여하였다(Table 1). 투여액량은 10 mL/kg 으로 하였고, 개체별 투여액량은 절식 후 (투여당일)의 체중을 기준으로 산출하였으며, 경구 투여용 존데를 부착한 일회용 주사기(1 mL)를 이용하여 위내에 단회 강제 투여하였다. 모든 동물은 투여 전에 약 4 시간 이상 음수는 자유 섭취시키면서 절식시키고, 투여 후 약 2 시간에 사료를 급여하였다. 투여용량을 설정하기 위하여 본시험의 예비시험으로 Organization for Economic Cooperation and Development (OECD)의 급성독성시험 허용 한계용량(OECD, 2001)인 2,000 mg/(10 mL/kg)을 암·수 마우스 각 1 마리에 단회 경구 투여한 결과 사망례가 관찰되지 않아, 본시험의 투여용량은 2,000 mg/kg로 설정하였다. 대조군에는 시험물질 투여군과 동일한 액량의 부형제를 투여하였다.
임상 관찰 및 검사
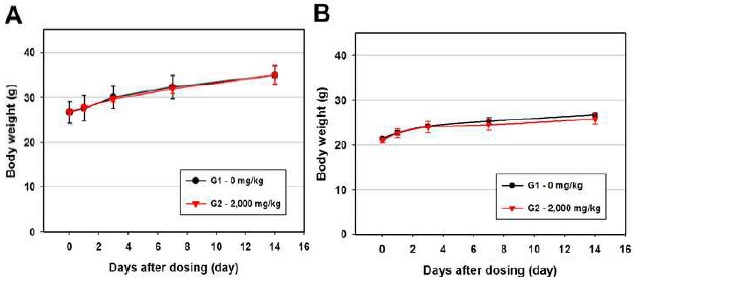
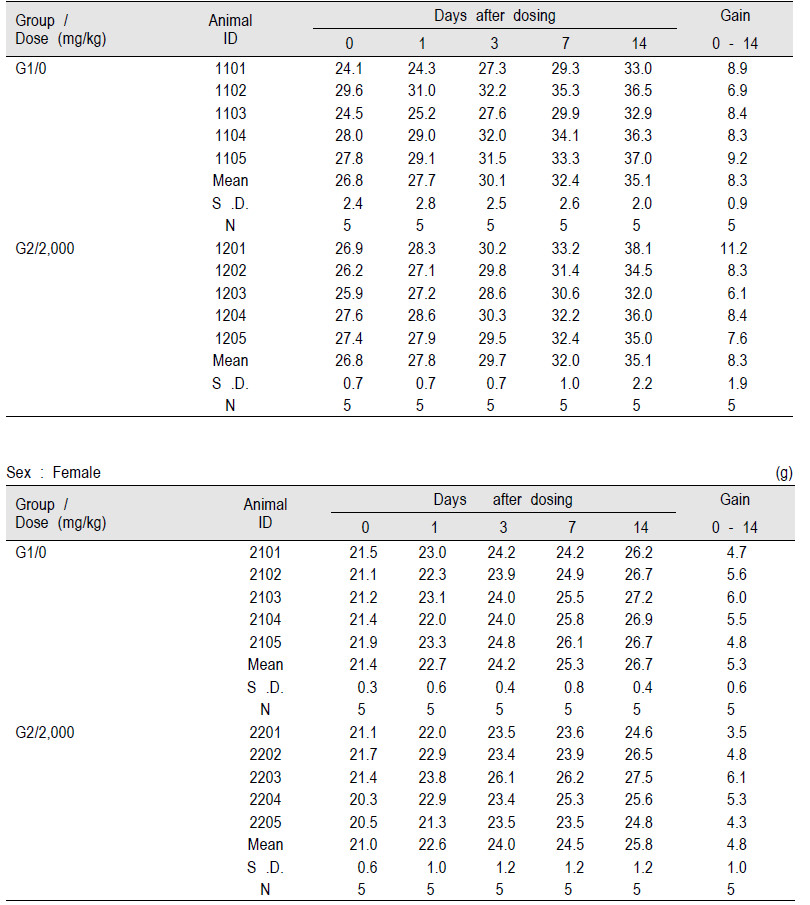
일반증상 관찰은 투여당일(0 일)에는 투여 후 30 분, 1, 2, 4 및 6 시간째에 일반상태(독성징후의 종류, 발현시기, 회복시기 등) 및 사망유무를 관찰하였으며, 투여 후 1 일부터 14 일까지는 매일 1회 일반증상을 관찰하였다. 동물들에 대하여 투여당일(투여 전), 투여 후 1, 3, 7 및 14 일(부검일)에 체중변화를 측정하였으며 관찰기간 종료 후, 모든 동물에 대해서 CO2 가스를 흡입시켜 배대동맥에서 방혈하여 안락사 시키고 부검하여 장기대한 육안 검사를 통해 병변의 유무를 검사하였다.
통계처리
실험에서 얻어진 대조군과 투여군의 체중 결과는 SAS (version 9.3, SAS Institute Inc., U.S.A.)를 사용하여 검정하였으며, Folded-F 검정법을 사용하여 등분산성을 검정한 결과(유의수준: 0.05), 등분산인 경우 Student t-test를, 등분산이 기각되면 Aspin-Welch t-test를 실시하여 유의성을 확인하였다(유의수준: 양측 0.05 및 0.01).
Results and Discussion
EGFP 단백질 생산
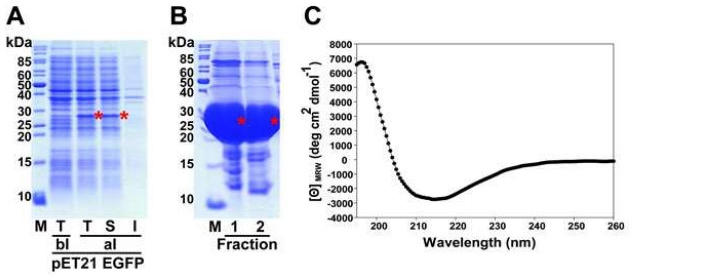
대장균에서 발현된 순수한 형질전환 형광누에 EGFP 단백질을 얻기 위한 실험에서 정제 후 SDS-PAGE 및 Western blot으로 확인 한 결과(Fig. 1) 순수한 EGFP 단백질을 확인할 수 있었다. 또한 발현된 EGFP 단백질의 이차구조를 CD (Circular dichroism) spectrum을 분석하여 확인한 결과 GFP의 전형적인 이차구조를 보였다.
임상증상 및 치사율
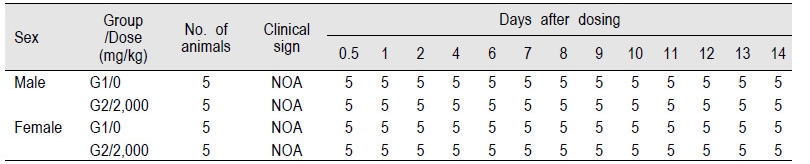
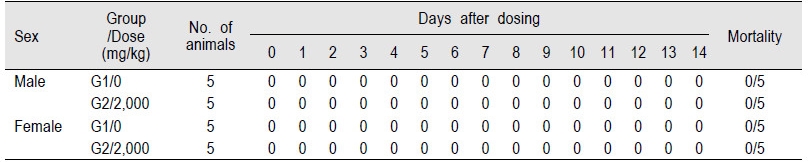
EGFP 단백질 2,000 mg/kg을 단회 투여한 G1 군과 대조군인 G2 군의 암·수 ICR 마우스를(0 일)에는 투여 후 30 분, 1, 2, 4 및 6 시간째에 상태를 관찰하고 다음날부터 14일 까지 매일 1회씩 관찰한 결과, 대조군인 G2 군과 비교하여 투여물질과 관련된 어떠한 임상적 이상소견도 관찰되지 않았으며(Table 2), 사망사례 또한 관찰되지 않았다(Table 3). 따라서 본 실험에서 사용한 시험물질의 최소 치사량(minimal lethal dose)은 암·수 ICR 마우스 모두 2,000 mg/kg을 훨씬 상회하는 것으로 나타났다.
|
Table 2. Clinical signs of ICR mice treated with EGFP on single-dose toxicity test.
|
|
|
NOA : No observable abnormality |
|
육안적 부검소견
시험물질 단회 투여일로부터 14 일(부검일)에 모든 암·수 ICR 마우스에 대하여 부검을 실시한 결과 암·수 대조군 및 시험물질 2,000 mg/kg 투여 군에서 육안으로 이상 소견은 관찰되지 않았다.
Conclusion
본 연구는 형질전환 형광누에 EGFP 단백질의 급성독성을 실험적으로 평가하고자 재조합 EGFP 단백질 생산 대장균으로부터 추출한 순도 >95% 의 EGFP 단백질로 시험물질을 만들어 ICR 마우스에 시험물질을 투여한 후 체중변화 및 임상증상 그리고 치사율과 부검소견을 관찰한 결과, 형질전환 형광누에 EGFP 단백질의 마우스에 대한 최소 치사량(minimal lethal dose)은 2,000 mg/kg 이상의 고용량인 것으로 확인되었으며, 2,000 mg/kg 투여 용량에서도 임상증상 및 부검소견 등에서 특별한 이상소견은 전혀 발견되지 않았고, 육안적 병변 및 무게변화를 측정 하였을 때도 대조군과 유의한 차이가 관찰되지 않았다. 급성독성 시험 결과로 형질전환 형광누에 EGFP 단백질은 급성독성의 측면에서 매우 안전한 물질은 것으로 판단되며, 현재 진행 중인 형광누에 실크에 대한 피부감작시험 등 인체유해성 평가가 완료를 통하여 추가적인 위해성 평가가 이루어 질 것으로 사료된다. 본 연구에서 기존 단기투여독성 시험과의 차이점은 구강투여를 위한 단백질을 준비과정에서 우선적으로 단백질 이차구조를 분석함으로써 정제된 단백질이 기존에 알려진 단백질 접힘(folding)과 동일함을 조사하였다는 점이다. 이와 더불어 형광분석 및 효소활성 시험 등의 기능 평가가 우선적으로 이루어짐으로써 형질전환체에 형질전환된 단백질의 독성 및 알레르기 유발성에 대한 분석이 이루어지는 것이 단기투여독성에서 생길 수 있는 오류를 우선적으로 배재할 수 있다. 이를 통하여 본 실험은 GFP를 발현시키는 다른 형질전환체에 대한 기본적인 참고문헌을 제공하며 앞으로 장기투여 독성 및 피부감작시험 등의 형질전환체에 대한 비 임상 시험을 수행하는데 지침이 될 것으로 생각된다.